STTT :哈尔滨医科大学杨宝峰/杜伟杰发现心肌细胞分泌的外泌体抑制缺血性心力衰竭中肿瘤铁死亡的敏感性
时间:2023-03-31 14:24:33 热度:37.1℃ 作者:网络
一般来说,心力衰竭(HF)患者患癌症的风险较高。铁死亡已被认为是一种有前途的治疗策略人类癌症。外泌体在近端和远端器官-器官通信中起着至关重要的作用,并以旁分泌方式调节疾病。然而,在缺血性心衰中,外泌体是否通过调节心肌细胞-肿瘤细胞的串扰来控制癌症对铁死亡的敏感性尚未被探索。
2023年3月27日,哈尔滨医科大学杨宝峰及杜伟杰共同通讯在Signal Transduction and Targeted Therapy在线发表题为“Exosomes secreted from cardiomyocytes suppress the sensitivity of tumor ferroptosis in ischemic heart failure”的研究论文,该研究表明心肌细胞分泌的外泌体抑制缺血性心力衰竭中肿瘤铁死亡的敏感性。该研究证明心肌梗死(MI)降低了癌细胞对典型铁死亡激活剂erastin或咪唑酮erastin的敏感性异种移植瘤小鼠模型。MI后的血浆外泌体都能有效地减弱肿瘤细胞对铁死亡诱导物的敏感性。miR-22-3p在慢性心肌梗死小鼠和心衰患者心肌细胞和血浆外泌体中的表达显著上调。
将肿瘤细胞与从心肌梗死后小鼠血浆中分离的外泌体孵育,或单独过表达miR-22-3p,可消除乳脂素诱导的体外铁性坏死细胞死亡。心肌细胞富集的miR-22-3p被包装在外泌体中并转移到肿瘤细胞中。AAV9海绵对心肌细胞特异性miR-22-3p的抑制增加了癌细胞对铁死亡的敏感性。实验证实ACSL4是一种嗜铁原基因,是肿瘤细胞中miR-22-3p的靶基因。综上所述,该研究结果首次揭示了MI通过释放源自心肌细胞的miR-22-3p富集外泌体来抑制erastin诱导的铁死亡。因此,靶向外泌体介导的心肌细胞/肿瘤病理通讯可能为基于铁死亡的抗肿瘤治疗提供一种新的途径。

心血管疾病(CVDs)和癌症是最严重的威胁生命的疾病,它们有许多共同的危险因素和发病机制。越来越多的临床证据表明心血管疾病,特别是包括心肌梗死(MI)在内的各种病因引起的心力衰竭(HF)与肿瘤发生风险的增加密切相关。这加强了人们对这两种疾病之间因果关系的理解。癌症治疗耐药是癌症研究和临床治疗的主要挑战,其与HF的关系仍不明确。
由过度脂质过氧化引起的铁死亡是一种铁依赖形式的调节细胞死亡,在治疗耐药癌症和其他退行性疾病方面具有很大的潜力。因此,靶向铁死亡被认为是一种治疗癌症的新方法。最近的研究已经确定了某些决定铁死亡抗性的因素。例如,多不饱和脂肪酸生物合成途径可能是预测铁坠瘤介导的癌症治疗效果的标志。内源性谷氨酸对抑制XC−系统诱导肺腺癌LUAD细胞铁死亡敏感性至关重要。抑制铁硫团簇生物合成酶NFS1与抑制半胱氨酸转运协同触发铁死亡和减缓肺肿瘤生长。然而,HF与癌症中铁死亡敏感性之间的关系尚不完全清楚。
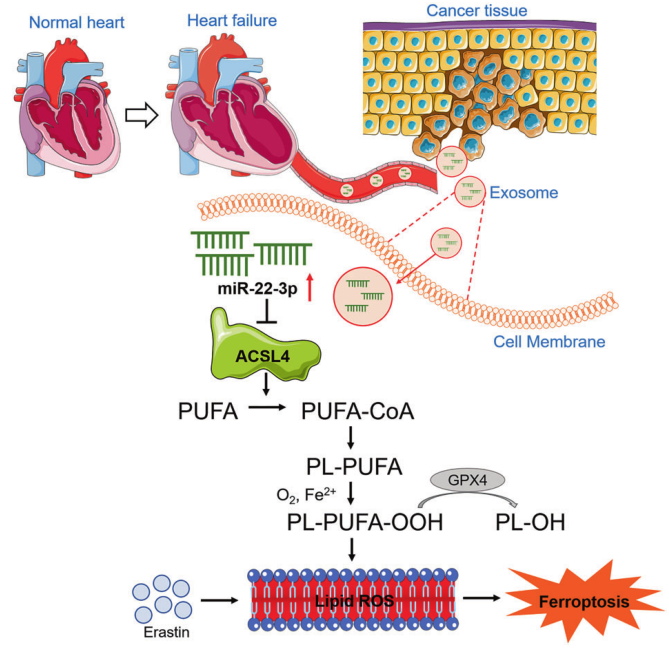
机理模式图(图源自Signal Transduction and Targeted Therapy )
外泌体是由大多数细胞类型分泌到细胞外环境中,随后可以被受体细胞内化。外泌体相关蛋白、RNA、DNA、miRNAs甚至代谢物在细胞间通信中发挥着重要作用,可以通过旁分泌和自分泌机制改变受体细胞的命运。细胞外miRNAs被认为是细胞间通信的重要介质和疾病治疗的潜在候选者。此外,外泌体在肿瘤发展、转移和免疫过程中被广泛研究。据报道,癌症相关成纤维细胞(CAFs)分泌的外泌体miR-522通过靶向ALOX15和阻断胃癌细胞中脂质-ROS的积累来抑制铁死亡。心肌梗死后心肌组织可释放几种可溶性趋化因子、细胞因子、生长因子和循环miRNAs。然而,心肌梗死后心肌分泌的外泌体是否能调节肿瘤的发展仍有待研究。
该研究发现心肌外泌体是一种新的信使,可以保护癌症细胞免受心肌梗死后铁死亡的影响。具体而言,该研究首次发现了心肌梗死背景下心脏与肿瘤之间新的信号通路:心肌梗死→心脏源性外泌体→肿瘤细胞→外泌体释放miR22-3p→抑制ACSL4→抑制脂质过氧化→抑制铁死亡活化易感→肿瘤生长加剧。这一信号通路是新颖的,此前从未被描述过。这些发现具有重要的临床意义。
原文链接:
https://www.nature.com/articles/s41392-023-01336-4


