【Pathology】Richter转化弥漫大B细胞淋巴瘤的免疫表型和基因谱系
时间:2023-03-31 14:27:52 热度:37.1℃ 作者:网络
弥漫性大 B 细胞淋巴瘤 (DLBCL) 是慢性淋巴细胞白血病/小淋巴细胞淋巴瘤 (CLL/SLL) 患者最常见的组织学转化形式,也称为 Richter 转化 (RT),高达10.7%的 CLL 患者在CLL 初诊后中位2年内进展为RT-DLBCL。文献报道的 RT-DLBCL 的发生率具有高度变异性,反映出与进展相关的各种生物学危险因素的影响。除这些因素外,评估疑似 RT 患者的临床实践相关的差异,以及 RT-DLBCL 诊断固有的困难,同样会影响RT率的差异。
CLL 患者出现不明原因的 B 症状、淋巴结迅速增大、高钙血症和/或血清乳酸脱氢酶水平显著升高时,应怀疑 Richter 转化。使用18FDG-PET的放射学成像通常可显示显影摄取部位,然后进行活检;但活检程序差异很大,包括细针穿刺、经皮粗针活检或手术活检。虽然大 B 细胞片是 RT-DLBCL 的标志,但这些病例的免疫表型和分子学数据仍然支离破碎,且多来源于重点解决其他问题的研究。
RT-DLBCL患者接受强化化疗的中位总生存期 (OS) 不足12个月,因此准确的诊断是最佳治疗选择的先决条件。尽管如此,因为RT-DLBCL 不常见且多种临床疾病可在组织学水平模拟RT-DLBCL,导致其诊断准确性和最佳表征和亚分类指南仍具有挑战性。首先,RT-DLBCL需要与组织学侵袭性(加速期)CLL区分开来,其特征是增殖中心扩大。此外,自限性病毒驱动的增殖在临床和组织学上也可类似RT-DLBCL。导致缺乏疾病免疫表型特征数据的因素包括基于流式细胞术的特征信息有限。此外,区分与CLL 克隆相关的 RT-DLBCL 和与克隆无关的 RT-DLBCL 具有预后和治疗意义,但在大多数实践环境中这种区分仍很困难。具体挑战包括,明确的区分需要比较 CLL 和 RT-DLBCL 疾病阶段重排的 IGH 片段,这一过程需要转化前和转化后样本的可用性,并且需要一个主要限于专业实验室的工作流程。基于上述困难,有学者提出了基于CD5 和 CD23 的表达推断 RTDLBCL 与 CLL 克隆关系的实用性替代方法,但目前尚无大规模研究证实这一理论的临床效果。
近日《Pathology》发表了一篇报道,作者对142例 RT-DLBCL 患者的大型单机构队列进行了系统分析,其目的包括:(1) 深入表征形态学和免疫表型特征;(2) 临床病理学特征与患者结局之间的相关性;(3) 描述细胞遗传学和分子学数据;(4) 重新评估细胞起源和克隆相关性的概念及其临床意义。


研究结果
作者回顾性纳入2005年8月至2021年1月在MD安德森癌症中心就诊的142例组织证实为RT-DLBCL的CLL患者并收集相关临床数据,包括18FDG-PET的最大标准化摄取值 (SUVmax)、免疫组化、流式免疫表型、二代测序 (NGS) 突变谱分析、常规细胞遗传学和 FISH 分析等。所有患者均有活检证实的疾病,符合当前WHO分类中定义的 RT-DLBCL 伴前期或并发CLL的诊断标准。
患者组
研究组包括142例患者,91例 (64.1%) 男性和51例 (35.9%) 女性,RT-DLBCL时中位年龄为65.4岁,患者在 CLL 诊断时的中位年龄为59.6岁,CLL和 RT-DLBCL 之间的中位间隔时间为49.5个月。CLL 时的年龄与 RT时的年龄显著相关(Spearman相关系数0.8310),<60岁诊断 RT-DLBCL相较于≥60岁诊断的患者,前者的CLL诊断年龄显著较小(中位数50.5 vs 62.2岁;p<0.001)。在109例可获得18FDGPET 结果的患者中,中位 18FDG SUVmax 为12.8。130例患者的分期数据可用,其中110例 (84.6%) 为 III 期或 IV 期。研究组的人口统计学和临床特征总结见表1。
形态学特征
大多数 RT-DLBCL 病例由成片的大细胞和偶有中等大小的细胞组成,具有免疫母细胞 (IB) 细胞形态学,这些细胞具有中等量的细胞质和圆形、中心位置或轻微偏心的细胞核,具有明显的核仁。本研究组104/107 (97.2%) 病例以 IB 形态为优势特征(图1和2)。3例的形态为高级别,由具有母细胞样特征的肿瘤细胞和大量核分裂象及凋亡小体组成。值得注意的是,一些主要为 IB 形态的病例携带罕见的霍奇金和Reed–Sternberg(HRS) 样细胞,分散在其他典型 RT-DLBCL 中。

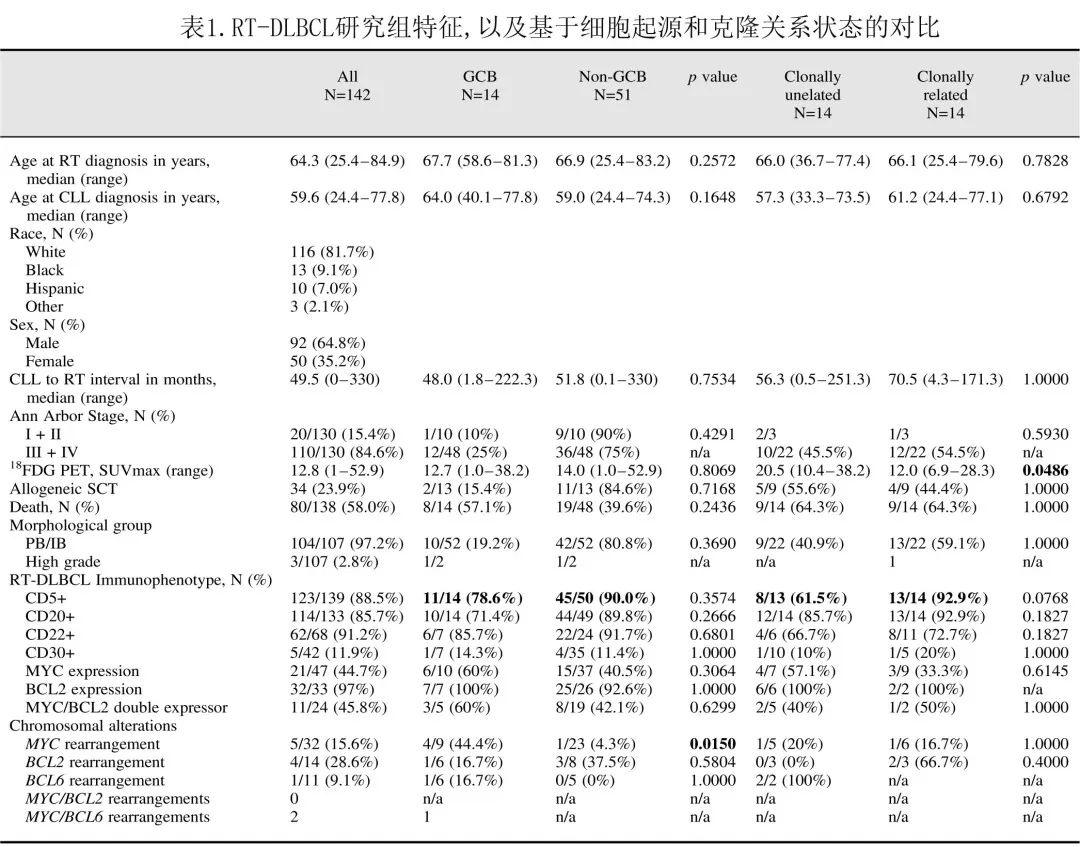
免疫表型数据
RT-DLBCL 的免疫表型景观总结于图3,其中CD19阳性(n=110/110,100%)、PAX5阳性(n=86/86,100%)、LEF1阳性(n=36/38,94.7%)、CD22阳性(n=60/68,90.2%)、CD5阳性(n=117/132,88.6%)、CD20阳性(n=114/133,85.7%)、CD38阳性(n=76/91,83.5%)、MUM1/IRF4阳性(n=65/78,83.3%)、CD23阳性(n=87/113,77%)。在 CD20 表达的病例中,47/114 (41.2%) low/dim强度表达生物标志物,与其在 CLL 中的表达水平相似。在 CD22 表达的病例中也观察到相似的结果,其中20例 (32.3%) 为low强度。中位 Ki67 增殖指数为71%。
采用 Hans 算法进行细胞起源分析证明,大多数 RT-DLBCL 病例为non-GCB 免疫表型 (51/65,78.4%)。对比GCB 和non-GCB RT-DLBCL 患者,发现年龄、性别、人种、CLL至 RT-DLBCL 间期、18FDG-PET SUVmax或中位总生存期 (OS) 均无显著差异。此外RT-DLBCL 中的 IB 形态与细胞来源无关(10/11 GCB vs 42/43 non-GCB;p=0.207)。
常规细胞遗传学和FISH结果
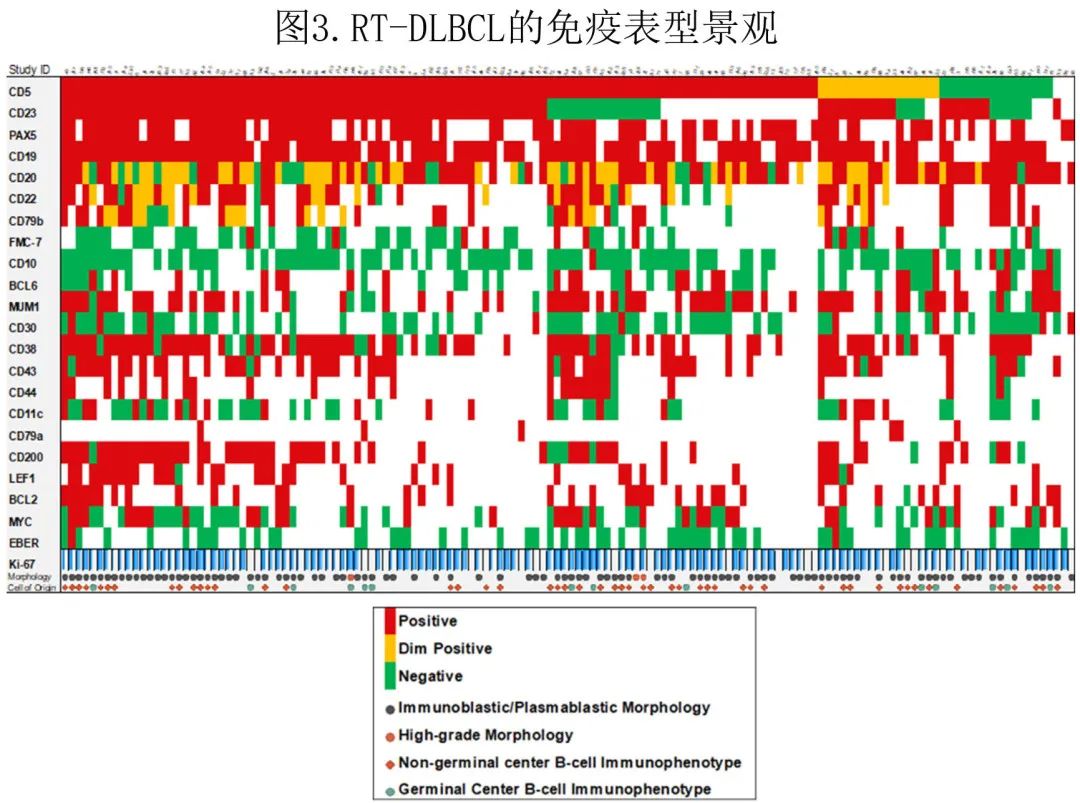
32例 RT-DLBCL 样本进行了常规核型分析,显示24例 (75%) 为复杂核型,5例 (16%) 为异常非复杂核型,3例 (9%) 为正常二倍体核型。后者为骨髓样本,伴RT-DLBCL 累及20%、50%和80%。分析了12例具有一个或连续样本的患者的 RT-DLBCL 和配对前期 CLL 核型:9例患者在CLL 和 RT-DLBCL 期共享一个或多个染色体异常,而其余3例患者没有共享异常(图4A)。在部分患者中,CLL获得进行性克隆性细胞遗传学异常,随着疾病进展而数量增加(复杂性)并在RT-DLBCL达到顶峰。所有具有表面免疫球蛋白轻链表达数据的患者 (11/12) 在疾病的 CLL 和 RT-DLBCL 期具有一致的表达,包括无共享细胞遗传学异常的患者。对 RT-DLBCL 和 CLL 常染色体的异常进行并排比较显示,前者涉及6、17、21、22号染色体异常的数量较多(图4B),而11号染色体异常在 CLL 中更常见。
克隆相关性
根据表面轻链表达和结构细胞遗传学改变的对比,可以推断患者 CLL 和 RT-DLBCL 之间的潜在克隆关系。能够表明28例患者的克隆关系状态(14例相关,14例不相关)。当 CLL 和 RT-DLBCL 中表达的表面轻链相同时无法推断克隆相关性,可能导致克隆无关病例比例升高这一偏倚。尽管如此,两组在诊断 RT-DLBCL 或 CLL 时的年龄、CLL和 RT-DLBCL 之间的时间间隔、总生存期、死亡人数以及评估的所有组织学、免疫表型和分子标志物方面没有显著差异。所有可能克隆无关的病例均有 IB 形态,包括6例non-GCB 中的4例 (66.7%) 和6例 GCB 中的2例。值得注意的是,在不相关的病例中8/13例检测到 CD5 表达(5例有 CD23 共表达),3/4例检测到LEF1。这些发现表明,CD5、CD23和 LEF1 表达状态,以及细胞来源免疫表型,均不是克隆相关性的可靠鉴别因素。此外,IB形态似乎代表了 RT-DLBCL 固有的主要特征,无论其与CLL 的致癌关系如何。
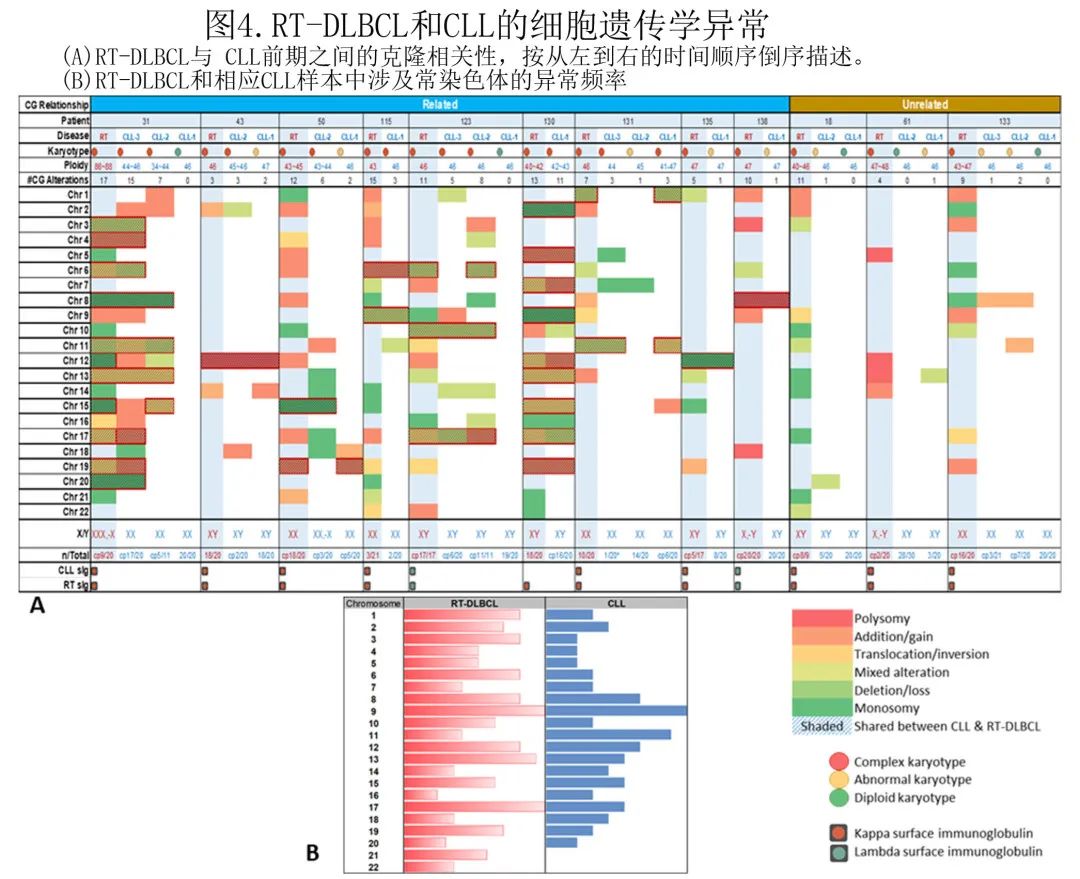
5例患者在不同时间点有涉及不同解剖位置的免疫表型差异性 RT-DLBCL 克隆。1例患者 (#60) 在初诊时同时诊断为 CLL 和淋巴结RT-DLBCL。而 CLL 细胞为CD5+/CD23+/skappa+,RT-DLBCL细胞为CD5-/CD23+/skappa+。该患者6个月后在骨髓中发现RT-DLBCL,该位置 RT-DLBCL 为CD5+/CD23+/skappa+(图5A)。2例患者 (#125,126) 在初诊 CLL 后12个月和15个月骨髓中存在RT-DLBCL;CLL和 RT-DLBCL 期在2例患者中具有相同的免疫表型,分别为CD5+/CD23+/skappa+ 和CD5+/CD23+/ slambda+。这2例患者并发的淋巴结 RT-DLBCL 分别为CD5-/CD23+(轻链状态未知)和CD5-/CD23+/lambda+(图5B,C)。另一例患者 (#135) 在初诊 CLL 后14年发生淋巴结RT-DLBCL,CD5+/CD23+/skappa+,2年后出现第2个淋巴结RT-DLBCL,CD5-/CD23-/sIg-(图5D)。第5例患者 (#11) 诊断为 lambda 单型CLL,并发kappa单型RT-DLBCL,均为CD5+/CD23 +,但5个月后再次诊断为RT-DLBCL,CD5+/CD23-(图5E)。
双打击和双表达状态
评估的38/82 (46.3%) 例 RT-DLBCL 病例中检测到 MYC 过表达,而在39/40 (97.5%) 例病例中检测到 BCL2 表达,在14/30 (46.7%) 例病例中检测到 MYC 和 BCL2 表达(双表达)。9/47例(19.1%) 检测到 MYC 重排,5/22例(22.7%) 检测到 BCL2 重排,2/15例 (13.3%) 检测到 BCL6 重排。无 MYC 和 BCL2 重排病例;2例有 MYC 和 BCL6 重排(#127和128)。与non-GCB RT-DLBCL 相比,GCB中单独 MYC 重排显著更常见 (4/9,44.4% vs 1/23,4.3%;p=0.015)。3例高级别形态中均表达BCL2,2例共表达MYC。在评估的2例病例中有1例 BCL2 重排,两例均无 MYC 重排。
RT-DLBCL的突变和细胞遗传学特征
对14例 RT-DLBCL 进行突变分析,最常见突变有TP53 (n=9,64.3%)、NOTCH1 (n=4,28.6%) 和ATM (n=3,21.4%)(图6)。在 TP53 突变的 RT-DLBCL 病例中,5/8 (62.5%) 有 TP53 拷贝数丢失,在该亚群中4/8(50%)在CLL 期检测到TP53 拷贝数丢失。值得注意的是,GCB与non-GCB 病例或克隆相关与不相关病例之间的突变或拷贝数丢失发生率均无显著差异。

临床病理学的预后相关性
中位随访8个月,80/138例 (56.3%) 患者死亡,中位总生存期 (OS) 为15个月,累积1、2、5年生存率分别为58.4%和40.1%、27.3%(图7A)。GCB 与non-GCB RT-DLBCL 患者的 OS 无显著差异,只有 CD5 表达与 OS 显著相关 (HR=2.732;95%CI 1.397-5.345;p=0.0374)(图7B)。单因素分析显示各种临床病理因素(RT时年龄、CLL时年龄、性别、人种、分期、SUVmax、TP53突变)与 OS 均无相关性(图7C)。
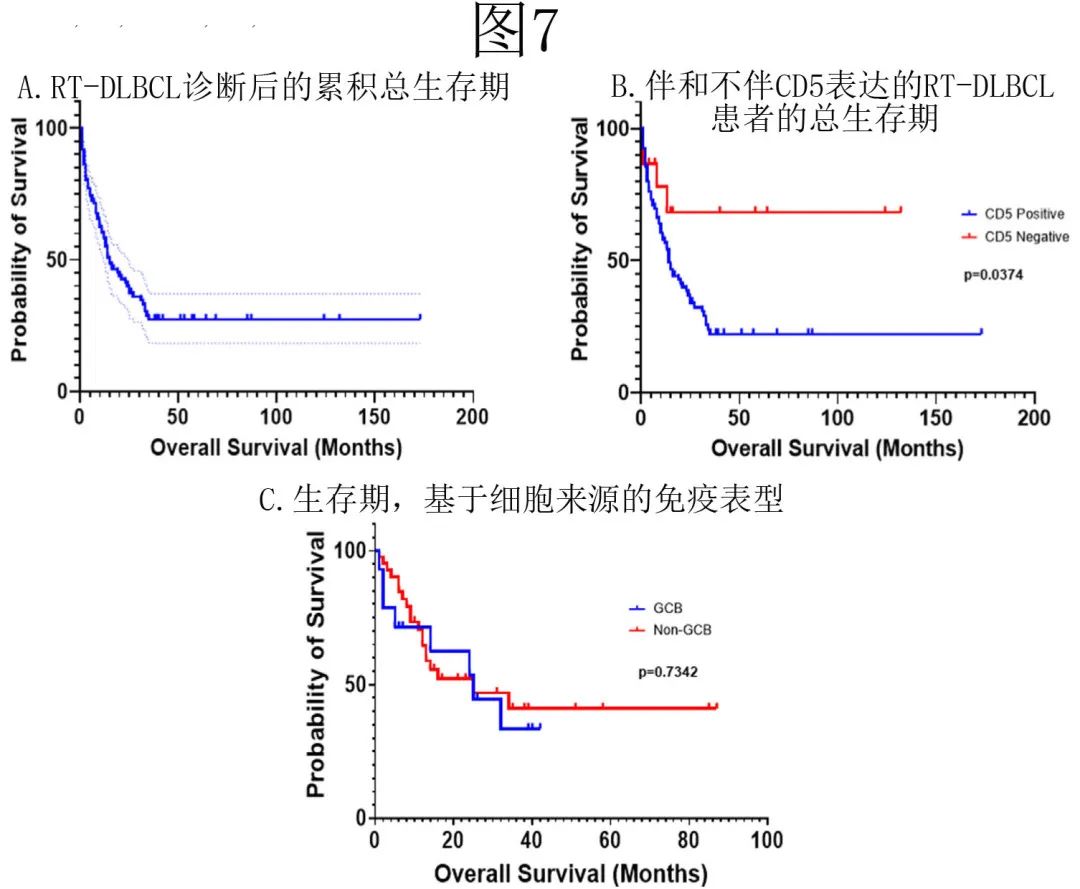
通过拟合具有选定预测因素的多变量模型,并基于向后、向前和逐步方法进行变量选择,进一步证实了这一观察结果;证明CD5表达在 RT-DLBCL保留与 OS 的重要独立关联。

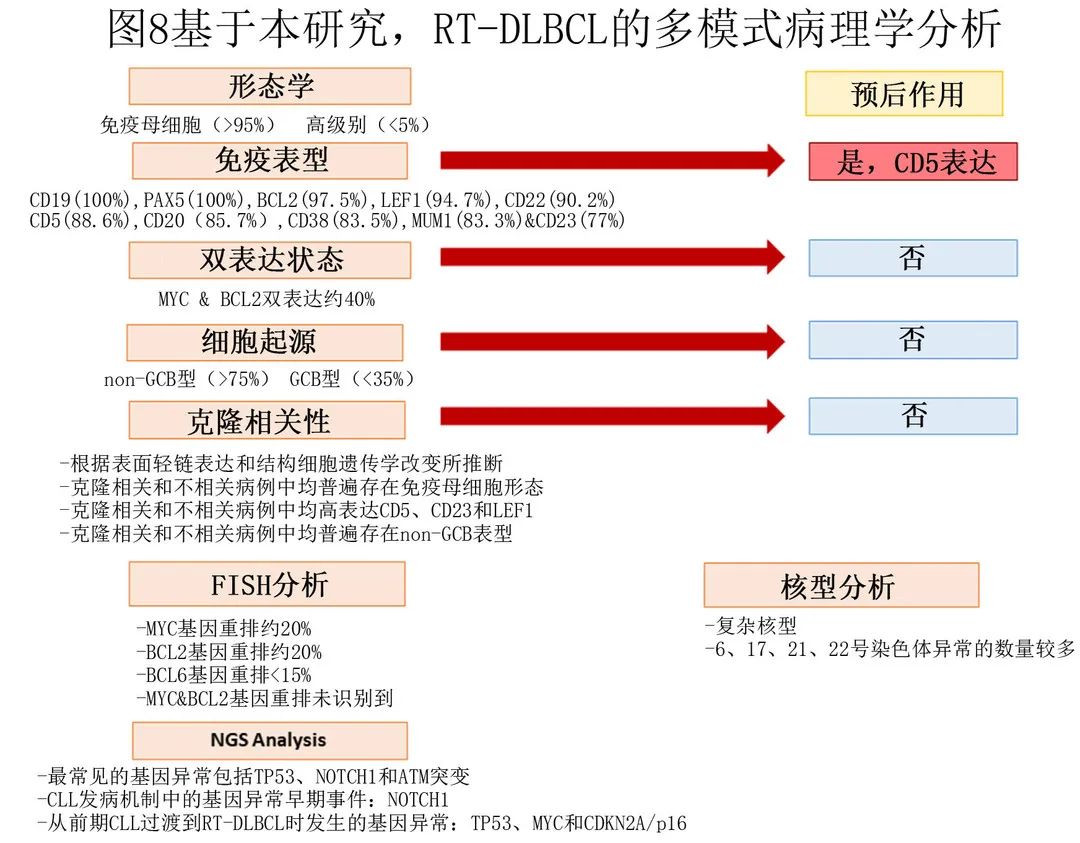
作者对大型、单中心队列的 RT-DLBCL 患者进行了系统分析,深入描述了形态学和免疫表型特征,描述了细胞遗传学和分子学数据,以及临床病理学特征与患者结局之间的相关性。此外重新评估了细胞起源和克隆相关性的概念及其临床意义。作者发现 RT-DLBCL 具有独特的形态学和免疫表型特征,以 IB 形态和CD5、MUM1和 LEF1 的共表达为特征。此外,细胞起源在 RT-DLBCL 中没有预后意义。本研究基于 RT-DLBCL 的多模式分析,将结果总结于图8。
参考文献
Siba El Hussein,et al. Immunophenotypic and genomic landscape of Richter transformation diffuse large B-cell lymphoma.Pathology . 2023 Feb 25;S0031-3025(23)00075-2. doi: 10.1016/j.pathol.2022.12.354.


