【专题论著】| 前哨淋巴结活检在皮肤型和肢端型黑色素瘤临床诊疗中的价值
时间:2023-08-17 17:47:33 热度:37.1℃ 作者:网络
[摘要]
背景与目的:前哨淋巴结活检(sentinel lymph node biopsy,SLNB)是评估皮肤型和肢端型黑色素瘤区域淋巴结转移情况及病理学分期的重要手段。SLNB作为外科诊疗规范的重要环节,已在各大诊疗指南中被推荐,也已在中国临床应用近10年。自2017年靶向和免疫治疗应用于中国黑色素瘤治疗领域,患者预后得到显著改善。本研究旨在分析复旦大学附属肿瘤医院近5年恶性黑色素瘤患者的临床资料,评估在新药治疗时代前哨淋巴结(sentinel lymph node,SLN)状态在临床应用的价值和对预后的影响。
方法:对2017—2021年在复旦大学附属肿瘤医院黑色素瘤诊治中心接受诊治的381例恶性黑色素瘤患者的临床资料进行回顾性分析。每例患者均接受原发灶扩大切除和相应的SLNB,手术后随访至少6个月。SLN定位使用美兰染色或同位素示踪。
结果:本研究共入组381例恶性黑色素瘤患者,平均Breslow浸润深度为3.10 mm,69.8%为肢端型,溃疡率为57.1%,SLN阳性率为34.6%,中位无复发生存率(relapse-free survival,RFS)为17个月。SLN状态是显著影响患者预后的独立危险因素。在N1a和T4亚组,SLN活检数>2枚的患者具有更好的RFS。接受完整的区域淋巴结清扫(complete lymph node disp,CLND)和未清扫患者的RFS差异无统计学意义,在SLN活检数>2枚和SLN微转移直径<1 mm的亚组未清扫者反而具有更优的RFS。结论:SLN状态仍是影响临床无显性转移的黑色素瘤预后的重要因素,对于恶性黑色素瘤患者应常规开展SLNB,在保证微创的前提下,提高SLN定位的准确性,保证SLNB充分。SLN阳性后行即刻CLND对于皮肤型和肢端型黑色素瘤患者未能带来进一步的预后改善。
[关键词] 恶性黑色素瘤;前哨淋巴结活检;区域淋巴结清扫;预后
黑色素瘤是一种起源于皮肤或其他脏器内黑色素细胞的恶性肿瘤,是全球常见的恶性肿瘤之一。黑色素瘤的发病呈现明显的地域性差异,高发区域主要位于高纬度、日照强度高及以白种人为主要人群的国家或地区。而在亚洲,包括中国、日本和韩国等以黄种人为主要人种的国家和地区,黑色素瘤的发病率显著较低。根据最新的全球癌症发病率统计显示,2020年中国黑色素瘤粗发病率0.53/10万,年龄标化发病率为0.36/10万,新发7 714例,占非皮肤癌恶性肿瘤发病排行第24位[1]。尽管发病率较低,但根据国内的流行病学调查,1990年—2019年中国黑色素瘤的发病率以每年3.5%的幅度逐年增高[2]。并且中国的优势亚型为肢端型和黏膜型黑色素瘤,前者占比超过40%[3],无论疾病负荷、生物学行为、药物疗效和远期预后,都明显差于欧美主流的亚型。
前哨淋巴结活检(sentinel lymph node biopsy,SLNB)是目前临床早期皮肤型和肢端型黑色素瘤外科诊疗中的重要环节,能够及时发现淋巴道的微转移状态,提供准确的病理学分期,从而制定后续合理的临床诊疗策略。复旦大学附属肿瘤医院黑色素瘤诊治中心是全国最早常规开展前哨淋巴结活检技术的临床诊疗中心之一,曾经总结过2009年—2016年接受外科治疗的黑色素瘤患者的预后情况,结果显示前哨淋巴结的状态是影响无临床显性转移黑色素瘤预后的独立因素[4]。近5年,黑色素瘤的诊疗发生了一些变化,首先在外科治疗方面,对于前哨淋巴结(sentinel lymph node,SLN)阳性的患者,可选择不做即刻的完整的区域淋巴结清扫(complete lymph node disp,CLND),在系统性治疗方面,免疫治疗和靶向治疗已成为黑色素瘤术后辅助治疗和晚期一线治疗的金标准。因此本研究旨在通过回顾本院过去5年的黑色素瘤外科治疗病例,再次探索在新时代,SLNB对于皮肤型和肢端型黑色素瘤临床诊疗的价值。
1 资料和方法
1.1 研究对象
本研究纳入了复旦大学附属肿瘤医院2017年1月—2021年12月,接受SLNB手术的皮肤型和肢端型黑色素瘤的临床数据,剔除淋巴结病理学信息不全或术后随访小于6个月的患者。
所有的临床和病理学信息,通过医院病史系统进行采集。所有患者均在治疗前签署知情同意书、授权委托书及手术风险告知书。患者在术后的辅助治疗方案、复发和转移情况,通过翻阅医院住院及门诊病史系统进行采集。死亡信息通过医院临床信息中心的随访数据库中提取。随访至死亡或 2022年1月31日。对于失访且随访小于6个月的患者进行数据剔除。
1.2 术前评估
所有患者在术前均通过原发灶活组织病理学检查诊断为恶性黑色素瘤,淋巴结引流区域既往未接受手术,并通过术前体检及至少接受1项影像学检查评估,包括多普勒超声、增强CT、增强MRI或PET/CT,诊断为无显性淋巴结转移和脏器转移的临床Ⅰ、Ⅱ期黑色素瘤。对于影像学表现为肿大的淋巴结,需通过术前细针抽吸细胞学印片检查排除转移。
1.3 SLNB的操作流程
1.3.1 SLNB的手术指征
根据目前的临床指南和外科共识,对于无临床显性转移的黑色素瘤,当原发病灶Breslow浸润深度≥0.8 mm时均需接受前哨淋巴结活检;对于Breslow浸润深度<0.8 mm,但合并有原发灶溃疡、消退、神经脉管累及年龄较小等危险因素时,也需接受前哨淋巴结活检。
1.3.2 SLNB的手术时机
SLNB一般与原发灶扩大切除手术同时进行,或在原发灶手术后3个月内进行。超过3个月,局部手术后瘢痕形成影响淋巴回流,将降低前哨淋巴结示踪的准确性。
1.3.3 SLN的定位和示踪
根据原发病灶的部位确认SLN所在的淋巴池。通常以脐上2 cm为界线,界线以上的躯干病灶和上肢病灶,一般认为淋巴回流首先入同侧腋窝淋巴池;界线以下的躯干部分及下肢,淋巴回流首先入腹股沟淋巴池。位于脐上2 cm界线及人体正中线周围的病灶,可出现一个以上的回流途径(multiple lymphatic drainage basin,MLDB),需接受多个淋巴池的前哨定位。对于肢端型的病灶,除常规的腋窝和腹股沟为第一站淋巴池外,也会出现肘部或腘窝的途中淋巴池(intransit nodal basin)的回流。头面部病灶由于淋巴回流可呈多向性而难以定位,故暂不接受前哨淋巴结活 检。
SLN的示踪方法目前包括核素定位和美兰定位两种方法。核素定位法是在术前12~24 h内在原发病灶周围多点皮下注射99mTc硫胶体1~2 mL,在注射后的15和30 min分别进行核素摄片或SPECT扫描,确认核素摄取SLN的位置并做体表标记,术中通过Neoprobe 2000伽马射线探测仪再行核素热点探测(Hot Spot)。美兰染色是在术前10 min在原发灶周围多点皮下注射美兰(亚甲蓝)1~2 mL,局部按摩后帮助染色剂于淋巴管内弥散。
在目前操作熟练的情况下,单用核素或美兰定位SLN的成功率都接近90%。但对于考虑存在MLDB的情况,包括躯干中线、躯干位于脐上2 cm水平线周围、小腿后侧、足跟等部位,全部在术前通过核素定位,明确是否需要活检多个淋巴池。
1.3.4 SLN的手术切除
前哨淋巴结活检手术是一种创伤较小的淋巴结摘除手术,术中尽量保留淋巴池内的小血管和神经,避免造成术后感觉麻木和肢体水肿。淋巴结切除后,残腔应注意缝合严密,结扎淋巴管断端,避免造成术后淋巴瘘而延误后续治疗。
SLNB应保证彻底性。在美兰染色定位的情况下,摘除所有蓝染的淋巴结。若通过核素定位,在术中使用核素探测仪探测离体淋巴结的核素最高摄取值,即热点值。要求淋巴结摘除后,残腔的核素摄取值低于热点值的10%,方认为SLN已全部切除。
1.4 SLN的病理学评估
根据目前的临床指南和共识,所有切除的组织均需通过术后常规病理学评估,包括石蜡包埋切片后常规的H-E染色及相应的免疫组织化学染色,选用的抗体可包括HMB45、MART-1/Melan A及S-100等恶性黑色素瘤特异性标志物。
1.5 SLN阳性后的治疗
根据目前的临床指南和共识,SLN阳性的患者可选择性即刻CLND,或进行密切的临床随访观察。
根据患者术后病理学分期、基因或分子改变及患者自身意愿,进行术后包括程序性死亡[蛋白]-1(programmed death-1,PD-1)单抗(帕博丽珠单抗、特瑞普利单抗)、BRAF抑制剂(维莫非尼、达拉非尼)、MEK抑制剂(曲美替尼)、干扰素等辅助治疗,也可单纯随访观察。
1.6 统计学处理
本研究的全部数据录入和分析使用SPSS for Mac 21.0软件完成。Kaplan-Meier生存曲线图使用R 4.2.0软件绘制。分析SLN状态、CLND状态和各临床因素相关性时,采用Pearson χ2检验。 SLN阳性相关因素的分析采用二分类logistic回归分析。无复发生存率(relapse-free survival,RFS)的分析使用Kaplan-Meier生存曲线法计算。RFS相关因素的分析采用Cox回归分析。各亚组间RFS差异分析采用log-rank检验。P<0.05为差异有统计学意义。
2 结 果
2.1 一般情况
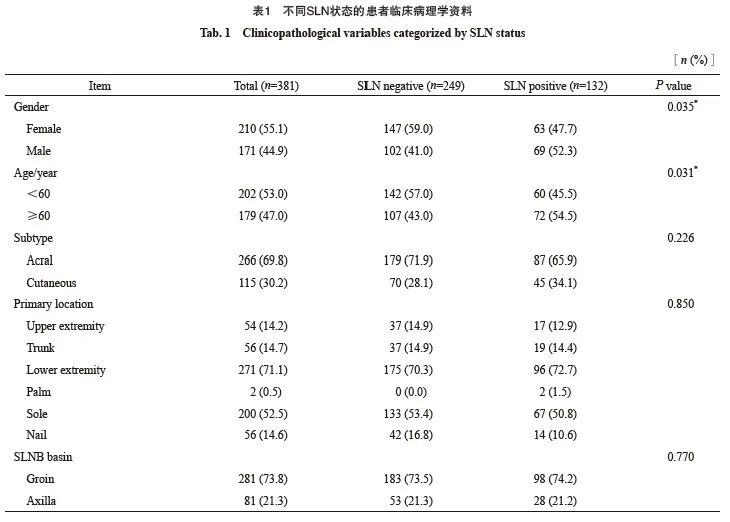
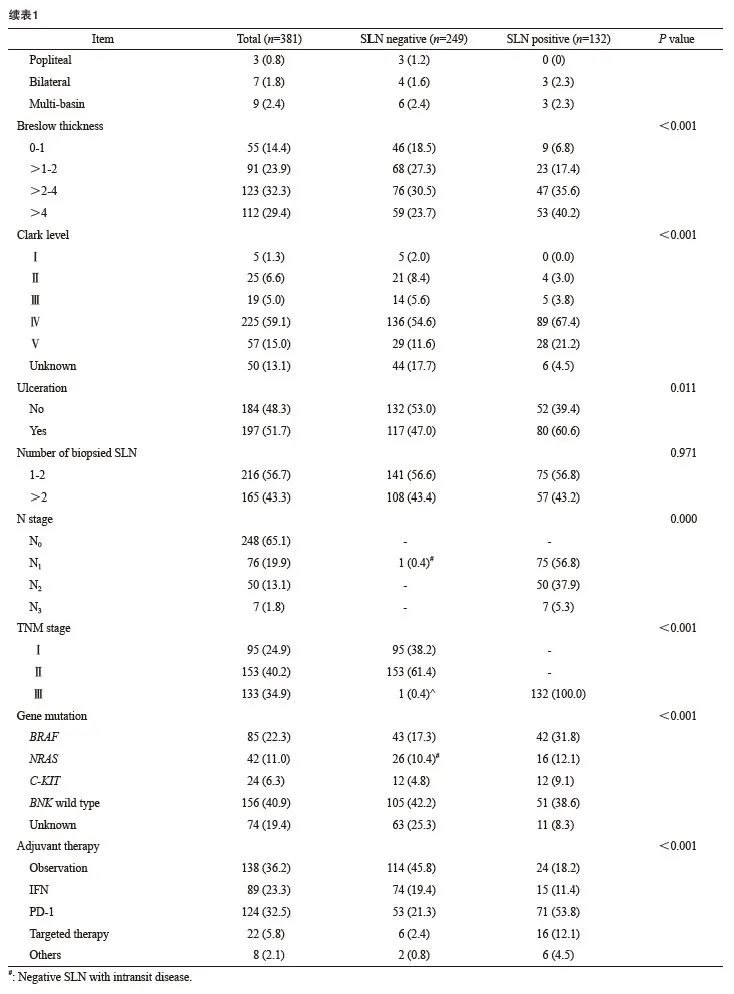
本研究时期内诊断治疗恶性黑色素瘤且病史完整的患者共585例,包括188例(32.1%)皮肤型和297例(67.9%)肢端型。根据本研究入组条件共入组381例患者,其中包括115例(30.2%)皮肤型,266例(69.8%)肢端型,男性171例(55.1%),女性210例(44.9%)。患者年龄为19~89岁,中位年龄为58岁。原发灶的中位Breslow浸润深度为2.7 mm,平均Breslow浸润深度为3.1 mm,溃疡率为51.6%。
根据美国癌症联合会(American Joint Committee on Cancer,AJCC)第8版黑色素瘤TNM分期标准,在经过原发灶扩大切除手术和SLNB后对所有入组患者进行分期,其中95例(24.9%)为Ⅰ期,153例(40.2%)为Ⅱ期,133例(34.9%)为Ⅲ期,其他详细资料见表1。
2.2 SLNB结果
SLNB的活检区域包括单侧腹股沟281例(73.8%),单侧腋窝81例(21.3%),单侧腘窝3例(0.8%),以及多引流途径,包括双侧(7例,1.8%)和MLDB(9例,2.4%)。其中最大SLN摘除个数为20,最小为1,中位数为2,四分位数Q1=1,Q3=4。
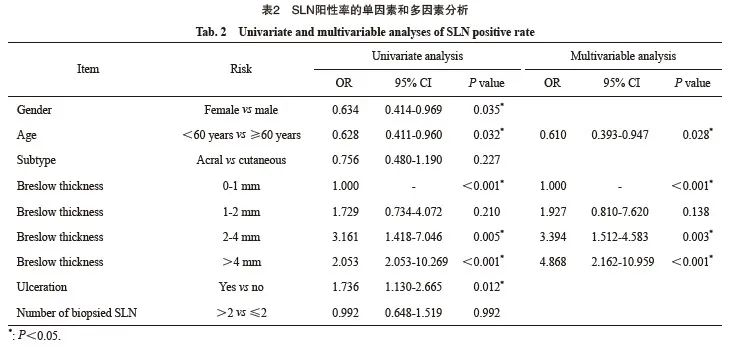
381例患者中,共检出SLN阳性132例(34.6%)。单因素分析显示,本研究中性别、年龄、Breslow浸润深度和溃疡与SLN阳性率相关,溃疡(P=0.019)、SLN活检数(P=0.024)与非前哨淋巴结(non-sentinel lymph node,NSLN)阳性率相关。多因素分析显示,年龄、 Breslow浸润深度是SLN阳性的独立危险因素。前哨淋巴结阳性率的单因素和多因素分析见表2。
2.3 生存分析
2.3.1 单因素分析和多因素分析
本组的中位随访时间为24个月。SLN阴性患者的1年RFS、2年RFS分别为93.5%、81.4%。 SLN阳性患者的1年RFS、2年RFS为77.4%、 61.3%。SLN阳性和SLN阴性患者的RFS差异有统计学意义(P<0.001)。不同SLN阳性状态以及各SLN和NSLN状态的RFS生存曲线见图1。
预后分析发现,影响RFS的单因素是性别、 SLN状态、Breslow浸润深度、溃疡。
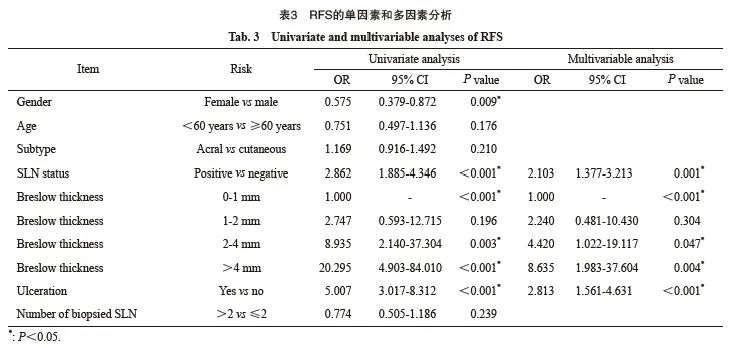
多因素分析发现,黑色素瘤SLN阳性、溃疡、Breslow浸润深度是影响RFS的独立预后因素。RFS的单因素和多因素分析见表3。
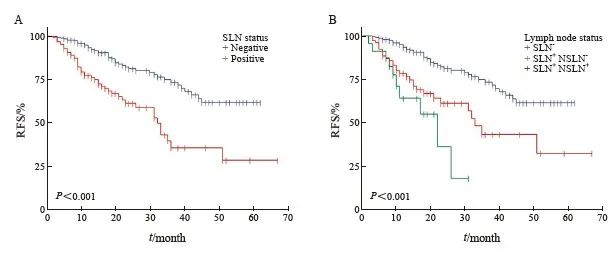
图1 不同淋巴结侵犯状态的RFS生存曲线
Fig. 1 RFS for different lymph node status
NSLN: Non-SLN. A: Compared between different SLN status alone; B: Compared between different SLN and NSLN status.
2.3.2 SLN检出数目对预后的影响
本组的中位前哨淋巴结检出数目为2枚,将患者分为活检数目1~2枚和>2枚两组,预后分析发现,对于总体人群而言生存差异无统计学意义(P=0.235)。对于SLN阳性(P=0.076)和肢端型患者(P=0.070),活检数目>2枚组的生存呈现获益趋势,但差异无统计学意义。而在N1a期(P=0.004)、T4期(P=0.010) 及未接受CLND(P=0.044)的亚组中,活检>2枚的患者的生存显著更优(图2)。
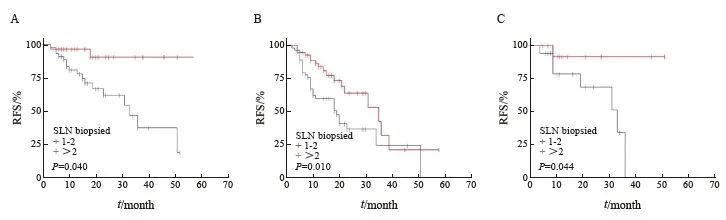
图2 不同SLN活检数患者的RFS生存曲线
Fig. 2 RFS for patients with different biopsied SLN number
A: N1a stage; B: T4 stage; C: No CLND.
2.3.3 SLN阳性后即刻清扫对预后的影响
在132例SLN阳性的患者中,31例患者未接收即刻的CLND,101例患者接受了即刻清扫。总体的NSLN的阳性率为22.5%。
即刻CLND和未清扫的患者,在各临床因素间基本平衡(表4)。生存分析发现,两组间的RFS差异无统计学意义(P=0.227)。即使是对于T4(P=0.725)、溃疡(P=0.908)和肢端型(P=0.564)亚组差异无统计学意义。在SLN活检>2(P=0.105)和SLN微转移直径<1 mm (P=0.017)的患者中,未清扫患者反而具有更优的无复发生存趋势,其差异具有统计学上的显著性意义(图 3)。
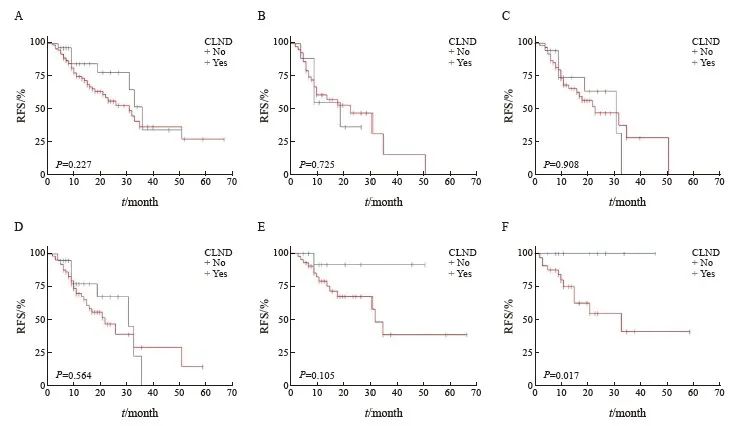
图3 是否接受CLND患者的RFS生存曲线
Fig. 3 RFS for patients who received immediate CLND and those who did not
A: All cases; B: T4 stage; C: Ulceration; D: Acral subtype; E: Biopsied SLN number >2; F: SLN micro metastasis diameter <1 mm.
3 讨 论
本研究对复旦大学附属肿瘤医院黑色素瘤诊治中心,过去5年行外科治疗的381例皮肤型和肢端型恶性黑色素瘤患者的SLN状态等临床病理学特征和预后进行回顾性分析。结果显示,本组患者SLN阳性率为34.6%,NSLN阳性率为22.5%。对于无临床显性淋巴结转移的患者,SLN的状态仍然是影响患者RFS的独立因素,再次证明了SLN在黑色素瘤外科规范治疗中的重要地位。
以往认为相较于欧美人群,中国人群恶性黑色素瘤的预后较差,是由于肢端型恶性黑色素瘤的预后比皮肤型差。但在近期的中国人群回顾性分析中,并未显示中国皮肤型和肢端型患者在术后生存上的显著差异[5]。在另一项关于1 000多例中国肢端型恶性黑色素瘤的回顾性分析中,溃疡是影响预后的重要因素,特别是对于Breslow浸润深度小于1 mm的病例。但该研究其中接受SLNB的比例仅25.4%,可能影响分期的准确性,无法有效分析SLN对于预后的作用[6]。美国最新的一项研究纳入了2012年—2015年新诊断的 60 148例恶性黑色素瘤,其中959例为肢端雀斑样黑色素瘤(acral-lentiginous melanoma,ALM)。该研究总体的平均Breslow深度为 2.1 mm,溃疡率为23.2%,ALM的平均Breslow深度为2.2 mm,溃疡率为42.8%,总体的SLN阳性率为10%,ALM的阳性率为22%,其中ⅠB期和Ⅱ期ALM的SLN阳性率分别为18.4%和39.5%。ALM亚型是SLN阳性的独立危险因素[7]。
在本研究的结果中,皮肤型和肢端型的SLN阳性率分别为39.1%和32.7%,NSLN阳性率为25.7%和20.9%。均高于欧美临床研究中的数据。其主要原因可能与Breslow的浸润深度相关,因SLN和NSLN的转移风险都随着T分期和溃疡而上升。从本组数据可知,肢端型和皮肤型黑色素瘤在SLN和NSLN的阳性率上差异无统计学意义,其原因可能在于两种亚型的Breslow浸润深度差异无统计学意义。因此,中国黑色素瘤患者预后较差,仍与原发灶的肿瘤负荷相关。
规范的SLN示踪、活检和病理学评估,是保证准确的病理学分期从而制定合理的术后治疗策略的重要前提。目前临床常用的前哨示踪方法有两种:美兰染色和核素示踪。核素示踪灵敏度高,能事先确定是否存在多引流途径,提高SLN定位的准确性,但缺点是需要具备核素示踪资质的人员完成相对复杂的临床操作,配备核素探测装置,并且存在一定的放射污染。同时,当原发灶与引流区域距离太近时,核素局部注射后的高摄取背景无法准确定位淋巴结。美兰染色易操作,可视化,但需在切开皮肤后才能看到蓝染淋巴结,无法在术前评估多引流途径的存在。同时,对于原发灶已进行扩大切除的患者,也不推荐再进行美兰局部注射。目前正在开发的吲哚菁绿示踪技术,同时具备美兰和核素的优势,具备可视化及实时显像的优点,值得未来在临床应用[8]。
尽管目前的指南和共识中并没有对SLNB数目提出要求,但在实际操作中,应确保所有蓝染或核素摄取热点的淋巴结彻底摘除送检。通常一个淋巴池的前哨淋巴结不只一枚。通过本次分析发现,SLN>2枚的患者在N1a、T4和未行CLND亚组具有更好的RFS。这一结果提示,对于仅切除1~2枚淋巴结的患者中,可能存在SLNB不充分,实际分期偏晚、预后偏差的情况。另一项关于头颈部恶性黑色素瘤的研究中也指出,相较于活检1或2个SLN的病例,活检3个及以上SLN的病例拥有更高的阳性检出率、更低的假阴性率以及更高的灵敏度[9]。因此在确保手术微创的前提下,应尽可能充分地活检SLN,从而提高分期的准确性,改善患者的预后。
根据目前MSLT-Ⅱ和DeCOG-SLT研究的结果[10-11],对于SLN阳性的患者即刻采取CLND与否对患者预后无显著影响。既往认为由于中国人群的黑色素瘤,特别是肢端亚型,存在原发病灶Breslow浸润深度深、溃疡率高的特点,SLN和NSLN阳性率也较高,因此即刻清扫能带来更多的生存获益。但本次分析显示,即使是对于T4和溃疡的人群,CLND也并未带来更长的RFS时间。因此对于患者是否需要在SLN阳性后行即刻CLND,仍有待前瞻性的研究。同时在SLN活检数>2枚,即认为活检相对充分的亚组以及SLN微转移直径<1 mm的亚组,CLND反而降低了患者预后,提示清扫手术可能会影响患者整体的免疫状态,特别是目前以PD-1单抗免疫治疗为主要辅助治疗手段的时代,CLND对于药物疗效的影响也急需进一步验证。此外,目前还有很多研究,通过制作预后模型等手段,在不进行CLND的情况下预测SLN阳性后NSLN的阳性风险,也有助于对患者实施更为精准的手术[12-15]。
本研究仍存在一些不足之处。单中心的数据来源限制了患者的地区分布及实际诊疗过程,对结论可能产生影响,也导致一些包含特定特征的黑色素瘤样本量偏少,无法得出准确结论。回顾性的研究方式也可能产生选择偏倚,出现资料不详细或存在偏差的情况。同时,本研究剔除了失访患者,未纳入无需接受SLNB的极早期的T1a期患者,及一部分未规范治疗的患者,使结果可能存在偏差。本研究收集了入组患者的总体生存(overall survival,OS)信息,但因本组患者随访时间较短,仅有16例死亡病例,样本量较小,因此未纳入最终分析范围。
目前对于皮肤型和肢端型黑色素瘤,在无临床显性淋巴结转移的情况下,仍应积极推行SLNB,以获得准确的临床分期,决定后续临床治疗策略,判断患者的预后。在保证手术微创的前提下,提高SLN定位的准确性,保证SLNB充分,以确保分期的准确性。SLN阳性后即刻的CLND是否能进一步改善患者预后,还是其反而会影响接受辅助治疗的效果,仍需进一步开展前瞻性研究。
利益冲突声明:所有作者均声明不存在利益冲突。
[参考文献]
[1] World Health Organization (WHO). The Global Cancer Observatory: Cancer Today[EB/OL]. [2022-07-01] https://gco.iarc.fr/today/home.
[2] BAI R H, HUANG H, LI M M, et al. Temporal trends in the incidence and mortality of skin malignant melanoma in China from 1990 to 2019[J]. J Oncol, 2021, 2021: 9989824.
[3] CHI Z H, LI S M, SHENG X N, et al. Clinical presentation, histology, and prognoses of malignant melanoma in ethnic Chinese: a study of 522 consecutive cases[J]. BMC Cancer, 2011, 11: 85.
[4] 徐 宇, 朱蕙燕, 陈 勇, 等. 前哨淋巴结活检在中国皮肤和肢端恶性黑色素瘤患者诊治中的临床意义[J]. 中国癌症杂志, 2018, 28(11): 819-826.
XU Y, ZHU H Y, CHEN Y, et al. The clinical significance of sentinel lymph node biopsy in the Chinese patients with cutaneous and acral melanoma[J]. China Oncol, 2018, 28(11): 819-826.
[5] WEN X Z, LI D D, ZHAO J J, et al. Time-varying pattern of recurrence risk for localized melanoma in China[J]. World J Surg Oncol, 2020, 18(1): 6.
[6] WEI X T, WU D, CHEN Y, et al. Prognostic value of ulceration varies across Breslow thicknesses and clinical stages in acral melanoma: a retrospective study[J]. Br J Dermatol, 2022, 186(6): 977-987.
[7] CHERAGHLOU S, UGWU N, GIRARDI M. Sentinel lymph node biopsy positivity in patients with acral lentiginous and other subtypes of cutaneous melanoma[J]. JAMA Dermatol, 2022, 158(1): 51-58.
[8] PAMEIJER C R, LEUNG A, NEVES R I, et al. Indocyanine green and fluorescence lymphangiography for sentinel node identification in patients with melanoma[J]. Am J Surg, 2018, 216(3): 558-561.
[9] PUZA C J, JOSYULA S, TERANDO A M, et al. Does the number of sentinel lymph nodes removed affect the false negative rate for head and neck melanoma? [J]. J Surg Oncol, 2018, 117(7): 1584-1588.
[10] FARIES M B, THOMPSON J F, COCHRAN A J, et al. Completion disp or observation for sentinel-node metastasis in melanoma[J]. N Engl J Med, 2017, 376(23): 2211-2222.
[11] LEITER U, STADLER R, MAUCH C, et al. Final analysis of DeCOG-SLT trial: no survival benefit for complete lymph node disp in patients with melanoma with positive sentinel node[J]. J Clin Oncol, 2019, 37(32): 3000-3008.
[12] SUN W, XU Y, YANG J L, et al. The prognostic significance of non-sentinel lymph node metastasis in cutaneous and acral melanoma patients-a multicenter retrospective study[J]. Cancer Commun (Lond), 2020, 40(11): 586-597.
[13] ULMER A, DIETZ K, WERNER-KLEIN M, et al. The sentinel lymph node spread determines quantitatively melanoma seeding to non-sentinel lymph nodes and survival[J]. Eur J Cancer, 2018, 91: 1-10.
[14] MARCHETTI M A, DUSZA S W, BARTLETT E K. Utility of a model for predicting the risk of sentinel lymph node metastasis in patients with cutaneous melanoma[J]. JAMA Dermatol, 2022, 158(6): 680-683.
[15] TROPEA S, DEL FIORE P, MAURICHI A, et al. The role of sentinel node tumor burden in modeling the prognosis of melanoma patients with positive sentinel node biopsy: an Italian melanoma intergroup study (N=2 086)[J]. BMC Cancer, 2022, 22(1): 610.


