非对称鼻腔高流量通气可提高CO2从解剖死区的清除率,并增加气道正压
时间:2023-08-22 11:40:31 热度:37.1℃ 作者:网络
随呼吸动态变化的气道正压和清除解剖死腔是鼻腔高流量(NHF)无创呼吸支持的关键机制。压力主要取决于流速和鼻腔闭塞度。我们的假设是,增加不对称的鼻腔闭塞会导致死腔清除的改善,从而减少再呼吸。在一个成人上气道模型中,用容积式呼吸描记法研究了清除率,该模型在呼吸频率(RR)为15-45每分钟和慢性阻塞性肺病(COPD)呼吸模式为18次每分钟时,由肺部模拟器夹带二氧化碳(CO2)进行通气。在NHF为20-60L/min时,用对称界面(SI)和不对称界面(AI)评估清除率。通过红外光谱可视化的二氧化碳动力学和数学模型被用来研究清除机制。在较高的RR(35每分钟)和NHF为60L/min时,与SI相比,AI在上气道的清除率明显较高(29.64±9.96%,P<0.001),而在较低的RR(15每分钟)(1.40±6.25%,P>0.05),(平均值±SD)。
随着COPD的呼吸,NHF的清除率降低,但相对于NHF 20 L/min的SI,AI明显改善了45.93%(P < 0.0001)。在呼气结束时,AI达到的最大压力为6.6cmH2O,NHF为60L/min。鼻腔之间的压力差异导致了光学模型中观察到的反向流动。不对称的NHF通过逆向流动增加了死腔的清除,并加速了通过较少闭塞的鼻腔对呼出气体的清除。
新的&值得注意的:不对称界面在鼻腔和鼻孔中产生逆流,导致上呼吸道的呼出气体单向清除。这加速了解剖死腔的清除,减少了再呼吸,而流动阻力的增加导致呼气末正压(PEEP)升高。这些发现与呼吸频率升高或呼气流量受限的患者有关,在这些患者中,NHF的死腔清除率可以显著降低。
介绍
鼻腔高流量(NHF)治疗是一种确定的无创呼吸支持形式,用于急性和慢性护理,通过鼻导管接口提供加热和加湿的空气,含或不补充氧气。NHF已成为急性呼吸衰竭患者的标准护理,成人的典型流量范围在20-60 L/min之间,最高可达80 L/min,并已广泛应用于COVID-19患者。
气道正压随着呼吸流量动态变化,上呼吸道废气再呼吸减少,被认为是NHF的关键机制。这使得它区别于其他形式的压力控制治疗方法,如持续气道正压通气(CPAP)或无创通气(NIV)。值得注意的是,为了使NIV对急性呼吸窘迫综合征(ARDS)有效,需要最小的呼气末正压(PEEP)为5cmH2O。NHF治疗期间的呼气末正压主要取决于流速和流动阻力,这是由鼻孔阻塞决定的。一个更大的横截面积可以在NHF期间增加呼气末正压,但可能有完全闭塞鼻孔的风险。闭上嘴,这可能会导致无法控制的气道压力上升,以及无法通过鼻子呼吸。在过去的文献中已经报道过NHF患者的气压损伤。
通过NHF稀释和吹扫上气道中的呼出气体,减少再呼吸,改善气体交换。这是通过降低死腔通气量来实现的,并且与各种生理结果相关,包括呼吸功的减少。死腔清除率依赖于流量和时间,在较高呼吸频率(RRs)时会降低,主要是由于呼气时间缩短,这在急性呼吸衰竭中常见。RR的降低会增加死腔的清除率,改善气体交换,并进一步降低呼吸频率。这被认为是在呼吸急促患者中增加NHF设置有益的理由。在慢性阻塞性肺疾病(COPD)等阻塞性肺疾病中,呼气流量限制可能影响呼吸模式,但对死腔清除效率的影响尚未研究。鼻尖大小对死腔清除率的影响尚不完全清楚。尺寸较小的导管会增加气体速度,但可能会因泄漏增加而降低压力,而且关于这对死腔清除的影响也有矛盾的数据。已经对单个鼻导管进行了研究,发现它可以改善高碳酸血症COPD患者的气体交换。
与标准对称鼻导管接口(SI)相比,新型不对称鼻导管接口(AI)可以增加呼气末正压,同时降低由于鼻塞孔径不同而导致的完全闭塞的风险。该假设是,鼻孔不对称阻塞的增加会导致死腔间隙的改善,从而导致再呼吸的减少。
材料和方法
上气道模型是基于欧洲成人上气道的平均几何形状,前庭的最小横截面积为78.5mm2/nare(总面积157mm2)。在第二个模型中,鼻腔大小被放大到170%,以测试更大的泄漏面积的影响。
这些模型是由Somos GP Plus 14122树脂(DSM,中国)使用宏泰立体光刻三维(3-D)打印机(补充材料)制作的。
在台式实验中,市售的对称插管接口(SI)(Optiflow þ,Fisher & Paykel Healthcare Ltd.,新西兰)和非对称插管接口(AI)(Optiflow Duet,Fisher & Paykel Healthcare Ltd.,新西兰)被用于解剖学上正确的三维打印上气道模型,与肺部模拟器(ASL 5000,IngMar Medical)连接,使用容积式呼吸描记器测量气道压力和再呼吸。ASL 5000用于在SmartPump模式下产生一致的呼吸模式,以确保尽管阻力发生变化,但流量模式是可控的和一致的。二氧化碳(CO2)被夹带,以模拟呼气气体浓度,使用低流量的100% CO2,通过一个穿孔软管滴定到ASL的活塞中。20、40和60升/分钟的NHF是使用市面上的集成流量发生器和加湿器(Airvo 3,新西兰斐雪派克医疗有限公司)产生的。
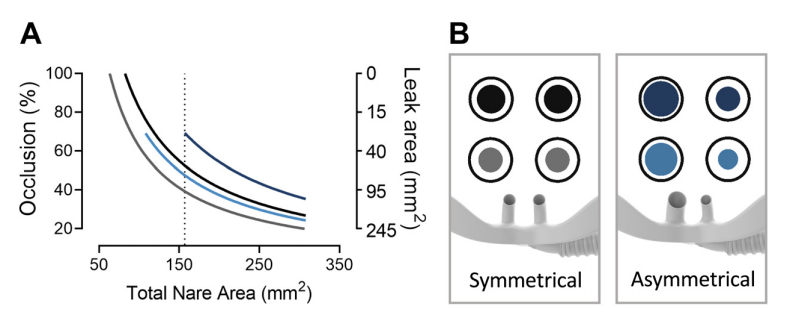
图1:A:研究中使用的大(黑色OP946)和中(灰色OPT944)对称界面(SI)以及非对称大(深蓝色OPT966)和中(浅蓝色OPT964)界面(AI)之间的总鼻孔面积、闭塞百分比和总渗漏面积之间的关系。鼻孔面积的减少可能会导致两个鼻孔与SI完全闭塞,这在AI的不同大小的鼻塞中不太可能。虚线表示模型中使用的平均成年鼻孔面积。B:鼻塞横截面积(内圆)和鼻孔(外圆)的示意图,泄漏面积为内圆和外圆之间的间隙;这些都是按比例描述的
AI有不对称的鼻塞;与SI相比,右鼻塞的直径减少了,左鼻塞的直径增加了。这使两个鼻塞的总横截面积增加了30%到40%(图1)
对大号SI和中号AI进行了比较,因为它们具有相似的闭塞面积,阻挡了模型50%的鼻腔(图1)。灰色和蓝色的内圈分别代表SI和AI的鼻塞。较大的AI几乎完全堵塞了模型中的一个鼻孔,被用来研究可实现的最高阻力和最大气道压力值。
一个光学透明的模型被用来通过红外光谱来观察二氧化碳的清除动力学。在这个模型中,鼻腔被安置在水平面上,有对称的反射,夹在两个蓝宝石光学窗之间(补充视频S1)。和以前一样,使用肺部模拟器来模拟呼吸。两个模型都有位于鼻腔内的压力端口(距外鼻20毫米),以测量腔内的压差。
为了研究提高RR对清除死腔的影响,使用了15、25每分钟的RR(Ti:Te 1:2)和35、45每分钟的RR(Ti:Te 1:1)。为了研究呼吸模式对清除死腔的影响,使用了以下模拟呼吸模式:稳定的COPD患者,呼气流量受限,RR为18每分钟;COPD 1呼气时间延长(Ti:Te 1:3);COPD 2(Ti:Te 1:2),具有内在的PEEP,其特点是呼气结束前呼气流量较大。正常呼吸模式(Ti:Te 1:2)被作为对照。在呼气结束和吸气开始时清除100毫升的时间被用作上呼吸道死腔清除的时间,如以前的详细描述。最后一次呼气和第一次吸气100毫升的时间是成人上呼吸道大部分死腔清除发生的时间。对于测试的每一种呼吸模式,肺部模拟器产生了10次呼吸,其中第一和最后两次呼吸被排除在分析之外,以避免任何过渡性的伪影;使用了中间最稳定的6次呼吸。
由操作者通过光学模型进行呼吸,以复制不同界面和NHF速率下可变呼吸模式对死腔清除的影响。在气管水平的再呼吸(补充材料)使用容积式二氧化碳监测仪(OG3800K和TG-980P,Nihon Kohden,日本和Fleisch Pneumotachograph,尺寸2,范围±2.5 L/s,瑞士)进行量化,并使用红外光谱仪(FLIR X6998SC,Teledyne FLIR LLC)调查鼻腔内的清除动力学,该光谱仪带有集成冷却的二氧化碳过滤器,以500帧/s的速度记录。一块涂有Vantablack(Surrey NanoSystems,英国)的面板被加热到150℃,作为均匀的中红外辐射源。这两种方法在以前都有详细描述。
数学建模是基于惠斯通电桥电路和已知的通道内大量流动的经验流体动力学关系。达西-魏斯巴赫方程被用来模拟鼻塞中的湍流DP= RQ²,哈根-波伊塞尔方程被用来模拟气道中的流动DP = RQ²(P-压力、R-阻力和Q-流量)。计算是用MATLAB软件(MathWorks)来预测呼吸时鼻腔内的流量和压力差,更详细的描述见补充材料。
结果
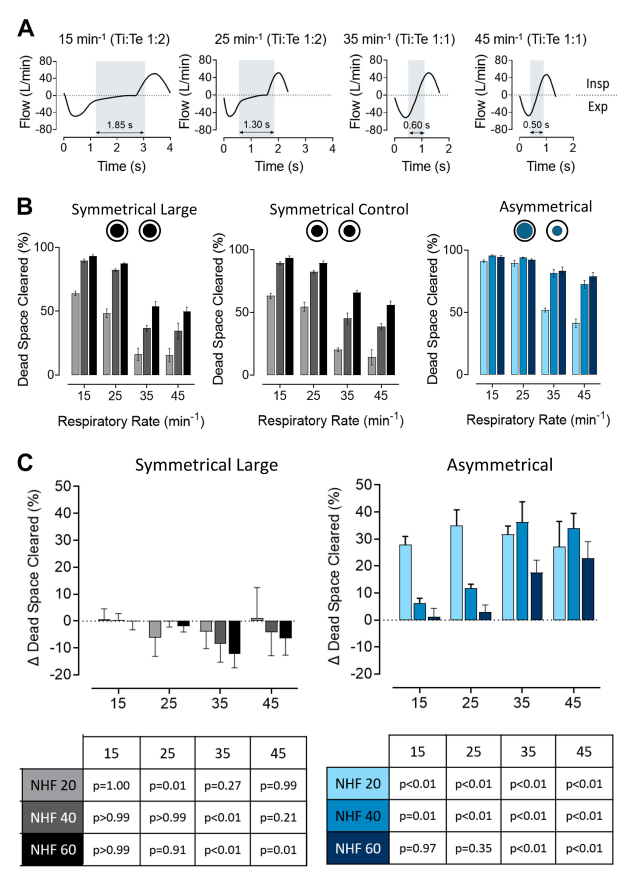
图2:鼻腔高流量(NHF)20、40和60 L/min及呼吸频率(RR)增加时,对称插管界面(SI)和非对称插管界面(AI)增加阻塞对解剖正确的三维上气道模型死腔清除率的影响。A:在RRs为15、25、35和45 每分钟时,肺模拟器中使用的呼吸模式。灰色竖条显示呼气和吸气时最后和第一个100毫升的时间。这与大部分间隙出现的时间相对应。RR增加导致清除时间缩短。B:通过SI(左)和AI(右)增加鼻孔总阻塞获得的清除率。使用标准中等大小的SI作为对照,如中心图C所示:这说明了由于SI(左)和AI(右)相对于SI对照增加鼻孔阻塞而导致的清除差异。不对称闭塞增加死腔清除。对称闭塞导致RR较高时清除减小,其中两个界面之间的清除差异最大当RR为15 每分钟,NHF为60 L/min时,差异不显著(参见图中的P值表)。
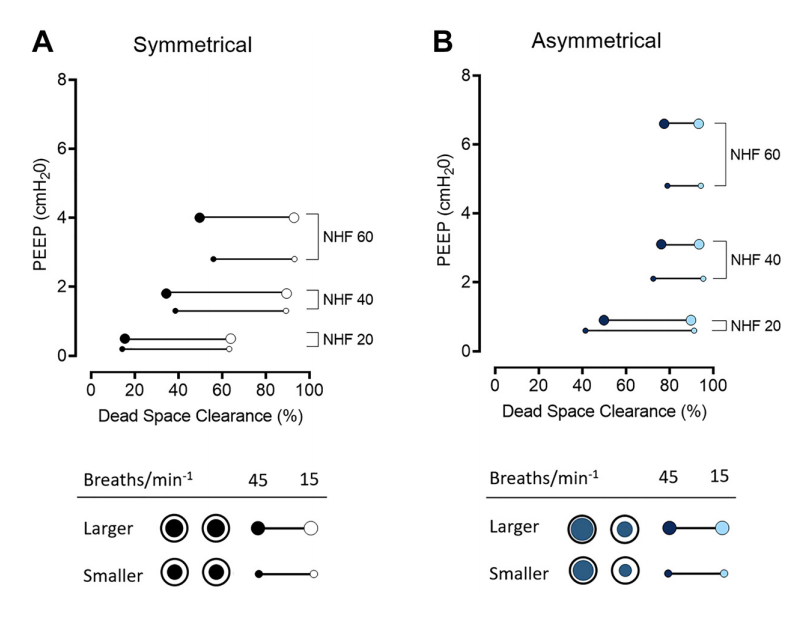
图3. 鼻腔高流量(NHF)速率为20、40和60L/min时,在上气道模型中,在呼吸频率(RR)为45每分钟(Ti:Te 1:1)和15每分钟(Ti:Te 1:2)的模拟呼吸中,使用对称鼻塞接口(SI;A)和不对称鼻塞接口(AI;B)测量的死腔清除和正呼气压力(PEEP)之间的关系,闭塞程度不同(较大和较小鼻塞)。与AI相比,RR为45每分钟时的SI显示出清除率和PEEP之间更多的线性关系(分别为R2=0.79和R2=0.65)。
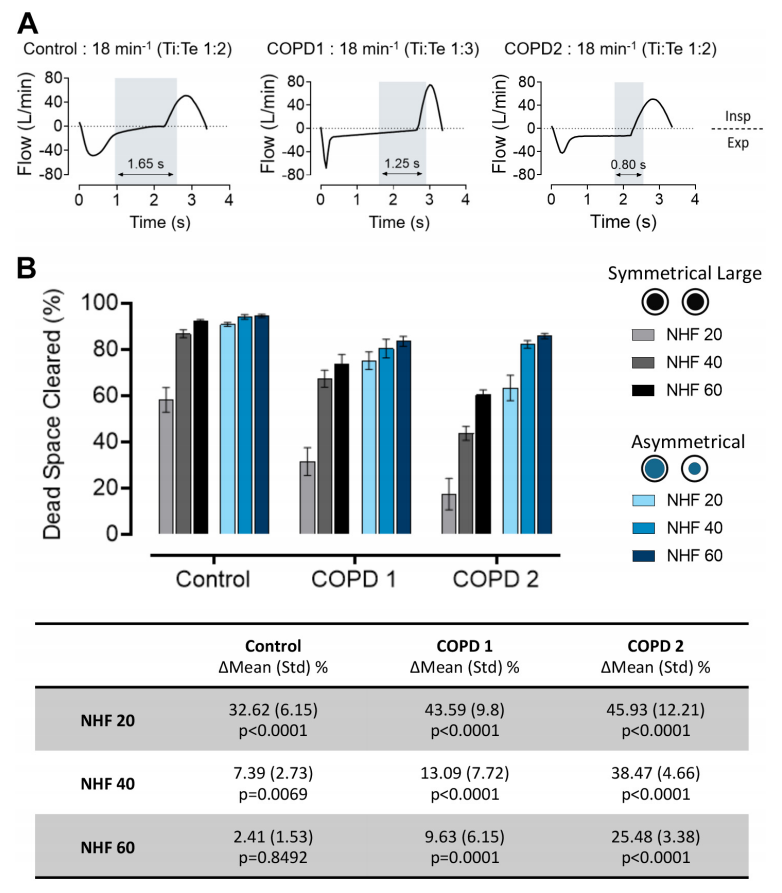
图4:呼吸速率(RR)为18 min -1时模拟呼吸模式对鼻腔高流量(NHF)速率为20、40和60 L/min时对称鼻塞界面(SI)和非对称鼻塞界面(AI)死区清除的影响。A:实验中使用的呼吸模式有(慢性阻塞性肺疾病,COPD 1和2)和无(对照)呼气流量限制。COPD 2还产生“固有的呼气末正压(PEEP)”,在呼气末有较高的呼气流量,但与对照组相同的Ti:Te比率。灰色竖条显示了呼气和吸气期间最后和第一个100毫升的时间,其中大部分死腔清除发生。B:在COPD 1和COPD 2中,使用SI获得的间隙减小;AI清除率受清除时间缩短的影响较小。在NHF为60 L/min时SI与20 L/min时AI的死腔清除率差异不显著。该表显示了各组内使用的不同流速下AI和SI之间的平均间隙百分比差异(平均值±SD)。两个COPD组的呼吸模式显示,无论Ti:Te比例如何,清除时间都减少,导致死腔清除减少,NHF和AI显著改善了死腔清除。
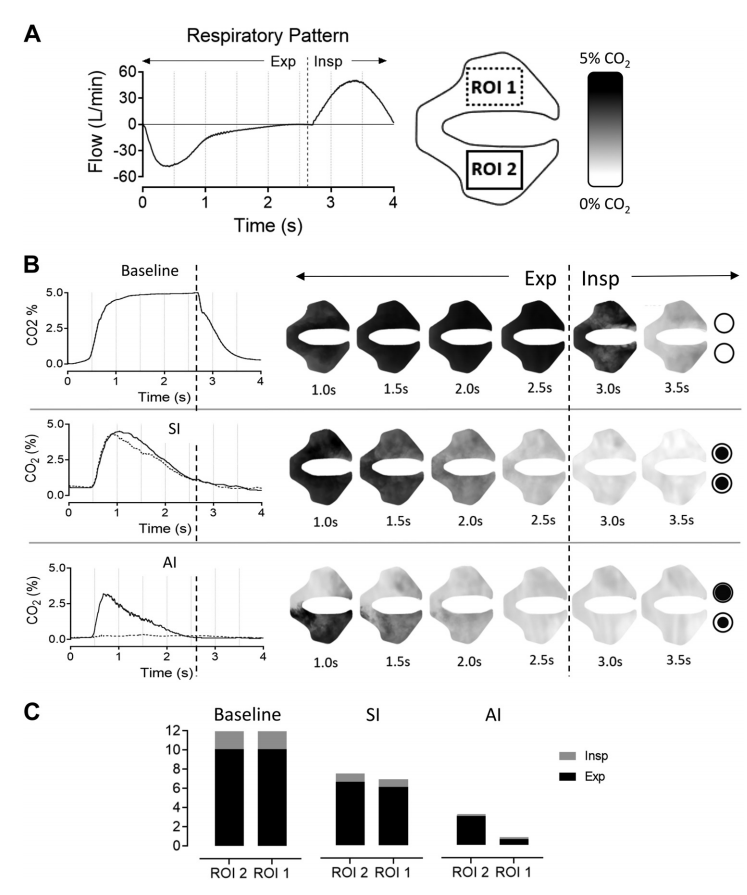
图5:在呼吸频率(RR)为15 min - 1,鼻腔高流量(NHF)为40 L/min时,光学上气道模型中的CO2动力学。A:后续图表中使用的呼吸模式。在感兴趣的矩形区域(ROI 1和ROI 2)用红外光谱测量CO2百分比。B:时间图以及单次呼吸时两个鼻腔的相应屏幕截图。垂直虚线表示呼气变为吸气的时间。图表上的虚线表示顶部空腔,实线表示底部空腔。在整个呼吸过程中,具有较大不对称鼻塞的空腔的CO2明显较少。C:使用B中时间曲线下的面积,呼气时鼻腔中的CO2量(黑色)和吸气时鼻腔中的CO2量(灰色)。
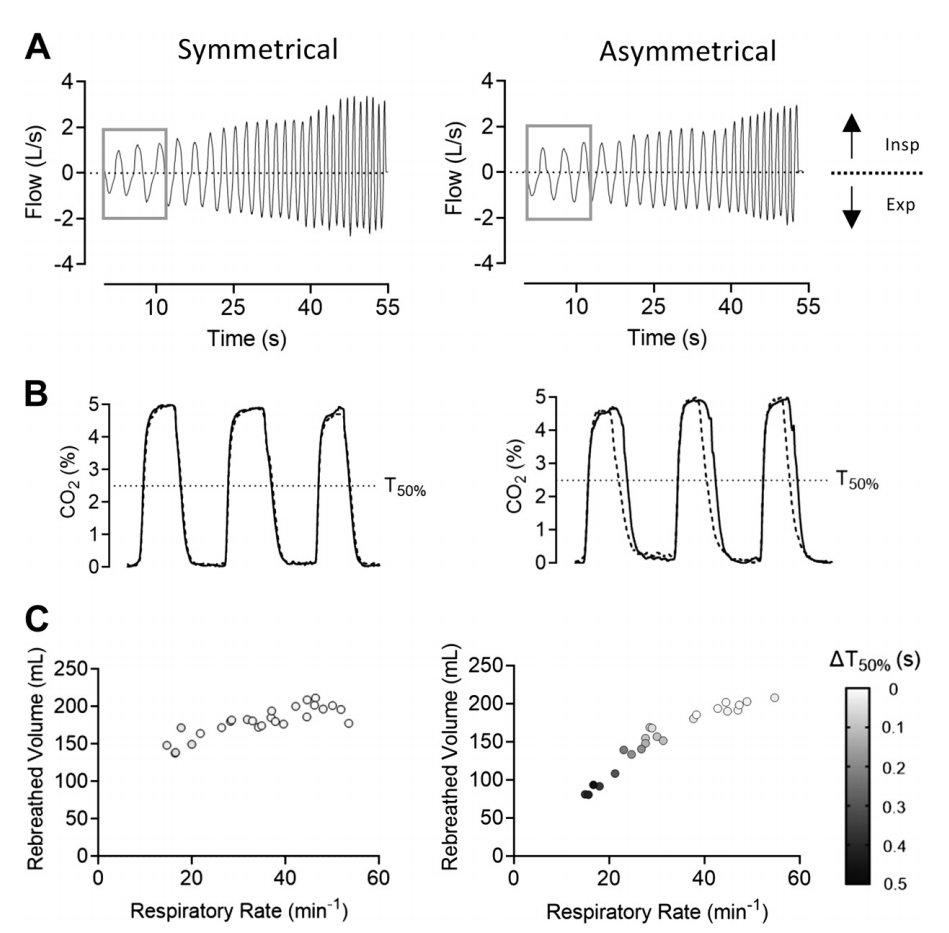
图6:鼻腔高流量(NHF)20 L/min时,操作者通过光学模型通过对称界面(SI)和非对称界面(AI)进行呼吸。A:呼吸频率(RR)在一分钟内自主增加。B:A的前三次呼吸显示每个鼻腔中CO2的百分比(通过红外光谱测量)(实线->右鼻腔,虚线->左鼻腔)。在AI中,左鼻塞的直径较大,通过虚线的左移可以看到T50%的差异。C:多变量曲线图显示,在低RR和AI条件下,再呼吸(在气管中测量)的减少与清除相应鼻腔中50%CO2(DT50%)的时间差有关。
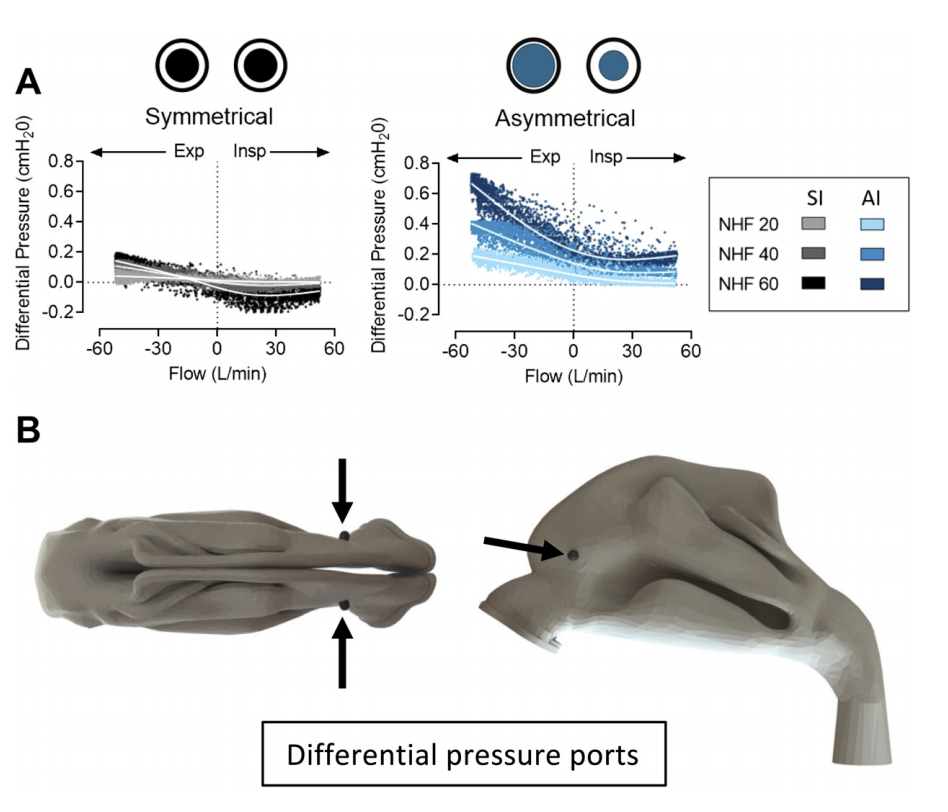
图7:A:通过对称界面(SI)和非对称界面(AI)在20、40和60 L/min的鼻腔高流量(NHF)下测量三维模型鼻腔中的压差,呼吸频率(RR)在15到45 min - 1之间。将下线拟合到每个数据集。0.001),流速为0.1和0.1 L/min时,SI和AI的压力分别为:20 L/min 0.016±0.005 vs.0.066±0.017,P<;40 L/min 0.023±0.011比0.120±0.021,P<0.001;60 L/min时0.007±0.027比0.201±0.019,P<0.001。B:模型中的压差端口。
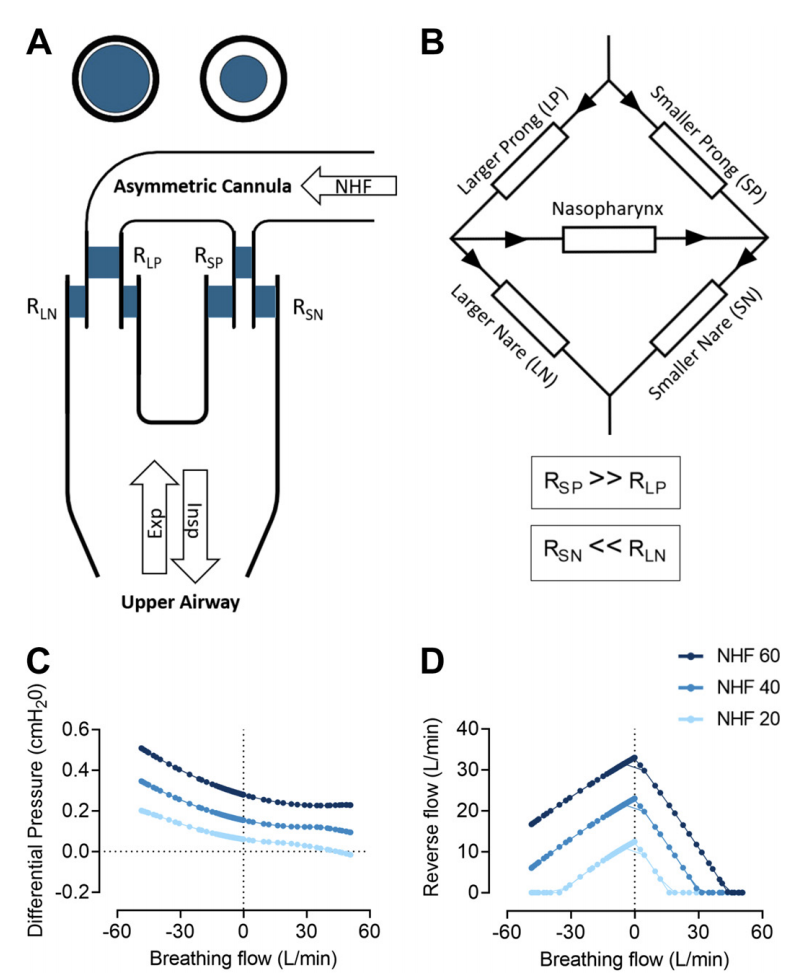
图8:具有非对称界面(AI)的上气道流动的数学建模。A:AI的上气道示意图显示在大鼻塞(RLP)、大鼻塞伴随鼻孔阻塞(RNL)、小鼻塞(RSP)、小鼻塞伴随鼻孔阻塞(RSN)、鼻腔高流量(NHF)和潮气呼吸流(呼气和吸气)存在阻力。B:惠斯通电桥回由五个阻力组成:小鼻塞中的阻力高于大鼻塞中的阻力,被小鼻塞堵住的鼻孔中的阻力低于被大鼻塞堵住的鼻孔中的阻力,而鼻咽部的阻力非常小。在吸气时,鼻塞中阻力最小的是大管子。在呼气时,阻力最小的是被较小的鼻塞堵塞的鼻咽部,这就造成了不对称性,使呼出的气体通过被堵塞的鼻咽部转移。C:20、40和60升/分钟的NHF在呼吸周期中在鼻腔之间产生了与流量有关的压力差。D: 鼻腔之间的反向流动在呼气结束时达到顶峰,并导致呼出的气体通过被较小的鼻塞闭塞的鼻孔单向排出。
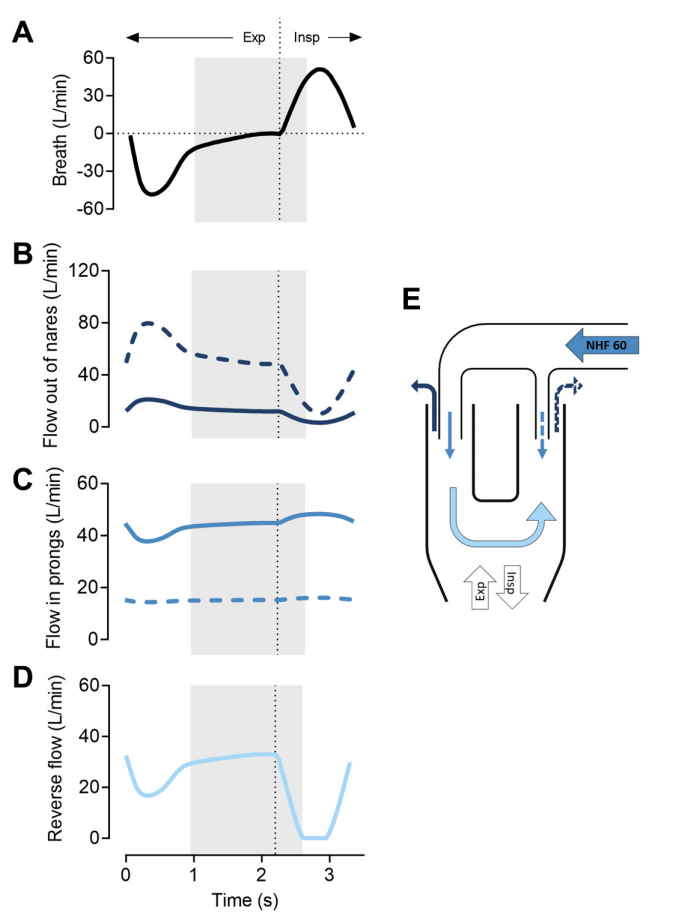
图9:单次呼吸时鼻腔高流量(NHF)为60 L/min时,鼻腔和非对称鼻塞端内的流量。阴影区域表示清除时间,分别为最后一次和第一次100 mL的排出和吸入。垂直虚线表示从呼气到吸气的变化。A:单次呼吸流量(呼吸频率18 min-1,Ti:Te 1:2)。B:单次呼吸时鼻孔流出(实线=鼻孔较大,虚线=鼻孔较小)。C:单次呼吸时鼻腔鼻尖处的流量(实线=鼻孔与较大的鼻尖,虚线=鼻孔与较小的鼻尖)。D:通过鼻后孔的逆流;在呼气末达到最大值,吸气时下降。E:流程示意图。
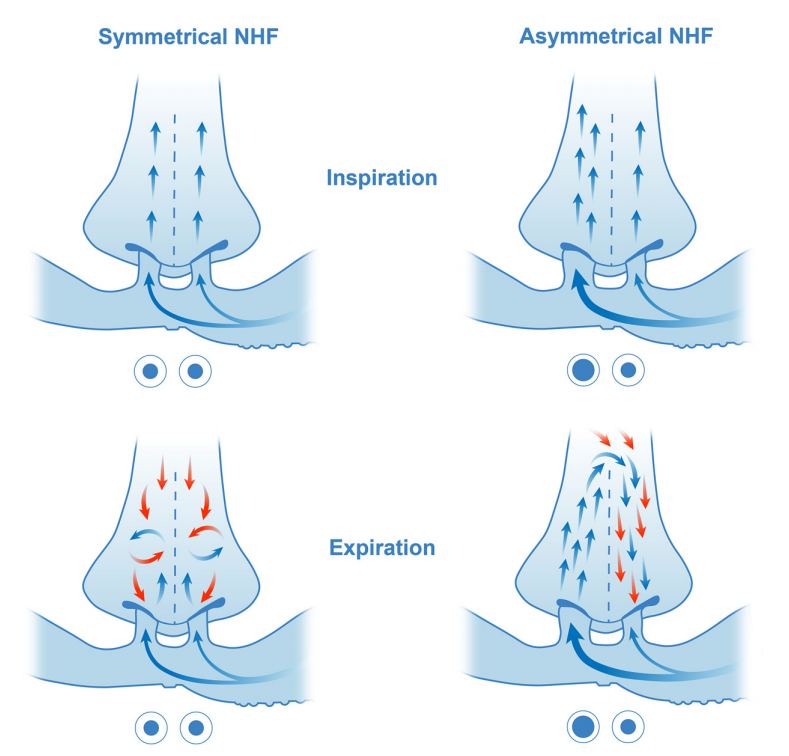
图10:在对称界面(SI)(左)和非对称界面(AI)(右)中,吸气(顶部)和呼气(底部)期间鼻塞和上气道的流动方向示意图。蓝色箭头表示鼻腔高流量(NHF),其在SI中的鼻塞之间均分。在AI中,NHF由于其较低的阻力和套管内的气流速度流线而偏向较大的鼻塞。呼出气体流量用红色箭头表示。在呼气期间,SI通过两个鼻孔导致相等的混合和吹扫。在AI系统中,鼻孔被较小的鼻塞堵塞,为排出鼻腔的呼出气体创造了较低的阻力路径。从较大的鼻塞流出的偏流也通过鼻咽部流向对侧鼻腔,形成反向流,在呼气结束时达到峰值。
临床意义
这些实验可能无法直接外推到临床环境中,但它们表明,当清除时间减少时,SI和AI之间的死区清除率存在显著差异。
无创呼吸支持期间的气道正压在管理急性呼吸衰竭患者方面发挥着重要作用。Morais等人证明,增加PEEP可以最大限度地减少严重ARDS患者的努力依赖性肺损伤。最近一项针对新冠肺炎所致低氧性呼吸衰竭患者的多中心随机临床试验表明,与常规氧气治疗相比,CPAP显著降低了气管插管的风险。
在这项研究中,NHF与传统的氧合没有什么不同,但作者承认在这种比较中动力不足。然而,与CPAP相比,NHF对新冠肺炎危重患者的低压支持可能会对结果产生影响。
在一项研究中,气道正压也得到了解决,其中NHF与头盔接口相结合,在使用NHF时保持CPAP。在这项生理学研究中,作者在健康志愿者的NHF 50 L/min期间,用头盔将PEEP控制在3、5和8 cmH2O。这些压力得以维持,但复杂的设置使临床应用受到质疑。
具有AI的NHF可以在没有诸如面罩或头盔之类的密封接口的情况下提供临床显著水平的PEEP。
气道正压可通过较大的对称鼻塞增加,但这可能导致鼻孔完全密封,并产生不受控制的压力。
通过使用AI,可以减轻完全密封和压力失控的风险。即使较大的鼻塞产生完全密封,较小的鼻塞也会允许泄漏。
所以,增加AI的阻塞可以增加气道压力,以及通过不对称流动的死腔间隙。这减少了再呼吸,并与呼吸功的改善有关。
此前有人推测,较大的套管接口可能会影响死腔的清除,因为鼻腔容积相对于NHF较小。最近的一项研究表明,死腔的清除实际上与RR密切相关,因为稀释和吹扫呼出气体的时间减少,闭塞程度更高。目前的研究对此进行了扩展,表明除了RR增加外,呼吸模式也可能降低清除效率,特别是当呼气阶段结束时的呼气流量高并且随着吸气开始而迅速改变方向时。这与呼气流量受限的患者有关,尤其是有内源性PEEP患者,后者会导致过度充气。
这些患者可用于死腔清除的时间较少,即使在低RR的情况下也是如此。在高碳酸血症COPD患者中,他们通常表现为呼气流量限制和内源性PEEP,再呼吸的减少与组织和动脉CO2的减少有关。
Jiang 等人也描述了单向气流的再呼吸减少,他发现在噘唇呼吸期间的单向气流归因于功能性解剖死腔的显著减少和呼吸效率的提高。后来有人提出,呼吸效率的提高可能与COPD患者的益处相关。
与之前的工作一致,NHF速率较低时,在低RR下,清除效率较高。本研究还发现,正常呼吸时(Ti:Te 1:2)的RR为15 每分钟,低NHF时SI和AI之间的差异显著,由于两者在高NHF时均有效。需要无创呼吸支持的急性呼吸衰竭和高RR重症监护患者可能受益于NHF和气道正压增加。在高RRs时,AI的使用可显著改善死腔清除率。模拟呼气流量限制和低RR时,由于呼气到吸气的快速过渡,NHF清除率降低;在这种情况下,即使在低NHF设置下,AI也显著提高了清除率。呼气流量受限的患者,如稳定期COPD患者,通常使用低NHF以提高耐受性;使用AI,NHF可以设置为较低的流量,同时保持清除率。
结论
在NHF期间,使用不对称形状的鼻腔接口增加鼻腔闭塞,提高了气道压力并改善了死腔清除。在呼吸频率增加或呼气流量受限的情况下,这种清除率的提高是最高的,因为在这种情况下可用于清除的时间较少。不对称的NHF在鼻腔之间产生逆向流动,这加速了通过较少闭塞的鼻腔清除呼出的气体。这些发现需要在临床上进行评估。


