【协和医学杂志】整合素αvβ3靶向放射性药物99mTc-RGD联合抗PD-L1抗体增强肿瘤治疗效果的研究
时间:2023-08-27 13:42:18 热度:37.1℃ 作者:网络
恶性肿瘤是威胁人类生命健康的主要疾病之一,近年来癌症的发病率和死亡率在世界范围内仍呈上升趋势,对人类健康构成了严重威胁[1]。我国人口基数大,老龄化人口多,癌症的发病率和死亡率均居世界首位,且大部分癌症患者发现时已处于晚期。因此,研发癌症早期诊断和治疗的方法尤为重要。
靶向放射性核素治疗作为一种新兴的癌症治疗方法,近年来取得了良好的治疗效果,如177Lu-DOTA-TATE[2]、177Lu-PSMA-617[3]等已被美国食品药品监督管理局批准上市。基于该疗法良好的靶向性、特异性和低非靶器官毒性,研究者试图应用放射性核素的靶向治疗与免疫检查点抑制剂对肿瘤进行联合治疗。
笔者研究团队前期开展了系列相关研究,应用131I直接标记抗程序性死亡受体配体1(PD-L1)抗体,将131I-抗PD-L1(αPD-L1)联合αPD-L1抗体用于肿瘤治疗,结果发现131I-αPD-L1联合αPD-L1抗体可显著提高MC38和CT26肿瘤模型的治疗效果[4]。
由于131I标记长循环的抗体在体内本身具有局限性,故再次探索了177Lu-EB-RGD联合αPD-L1抗体的“靶向-触发-治疗(TTT)”效果,结果发现经1777Lu照射后肿瘤细胞表面的PD-L1表达上调,并于照射4 h后注射αPD-L1抗体治疗效果最佳,证实了时间窗对于放射性核素联合免疫治疗的重要性[5]。
为进一步探究放射性核素治疗与免疫检查点抑制剂联合治疗的有效性以及时间窗的重要性,笔者团队选择了诊疗一体化核素64Cu,其既可发射β+射线用于PET显像,也可产生β-粒子用于治疗[6]。但单纯应用64Cu标记的药物治疗肿瘤效果十分有限,而采用64Cu-EB-RGD联合αPD-L1抗体在间隔4 h时间窗时取得了最优的肿瘤治疗效果[7]。
在此基础上,研究团队引入临床上应用最广泛的PET显像剂2-[18F]FDG调节肿瘤微环境,并联合αPD-L1抗体进行免疫治疗,结果显示2-[18F]FDG的刺激使得肿瘤微环境由“冷”变“热”,可通过重塑其免疫状态,使肿瘤细胞对PD-L1免疫抑制剂产生更好的响应,改善了治疗效果[8]。该研究证实了这种优化组合可能是消除PD-L1低表达患者治疗耐药并改善其临床结局的一种有效治疗策略。
由于合适的半衰期(6.02 h)及发射纯γ射线的性质,99mTc成为临床上单光子发射计算机断层显像(SPECT)最常用的核素,通过钼锝发生器即可淋洗得到足量的核素,制备简单,操作方便,在医院即可开展。如开展基于99mTc标记的化合物联合免疫检查点抑制剂的抗肿瘤治疗方式,则可弥补传统治疗核素来源有限、昂贵、较难获得的问题,并扩大99mTc的应用范围。
而整合素作为一类促进肿瘤生长和转移的蛋白质,在肿瘤细胞和肿瘤微环境的多种细胞中高度表达[9]。整合素受体αvβ3在肿瘤内皮细胞的过表达对于肿瘤细胞的存活和迁移发挥重要作用[10]。因此,整合素αvβ3作为肿瘤成像和治疗的重要靶点被广泛研究。
前期的研究主要探讨发射β+或β-射线的核素在联合治疗中发挥的作用,而单纯的γ射线是否可引起一定的生物学效应尚未可知。基于此,本研究选择SPECT最常用的核素99mTc,其发射纯γ射线可避免β-射线本身具有的杀伤作用,应用99mTc-RGD对肿瘤组织的PD-L1表达水平进行调控,并联合αPD-L1抗体对MC38结直肠癌肿瘤鼠进行协同治疗,探索其在肿瘤鼠中的联合治疗效果。
1 材料与方法
1.1 实验材料与设备
CT26和MC38肿瘤细胞购自中国细胞系资源基础设施库,4T1和B16F10肿瘤细胞购自美国细胞培养物收藏中心细胞库。采用CRC-55tR活度计(CAPIN-TEC Inc.,USA)检测放射性活度,采用nanoScan-SPECT/CT扫描仪(Mediso,Hungary)完成小动物SPECT/CT显像,采用Beckman coulter CytoFLEX(Beckman coulter,USA)检测流式细胞术。
从钼锝发生器淋洗获取高锝(99mTc)酸钠注射液,并利用高锝酸钠注射液标记RGD药盒制备获取放射性药品99mTc-RGD,其合成、标记及质控过程可参考文献[11-12],成功制备获取99mTc-RGD,并进行后续的生物学评价。
1.2 流式细胞术分析
将CT26、MC38、4T1、B16F10肿瘤细胞在6孔板中铺板过夜至贴壁,然后将99mTc-RGD加入细胞中进行诱导,以生理盐水处理的细胞作为对照组,分别在不同的诱导时间点(0.5 h、2 h、4 h、8 h、24 h),收集细胞,并用冰冷的PBS洗脱2次,然后用鼠源的αPD-L1抗体(MIH6;Abcam)进行染色。采用FACS Aria Ⅲ流式细胞仪检测染色后细胞的荧光强度,通过FlowJo软件评估和定量分析数据。
1.3 动物模型构建
订购6~8周龄的雄性C57BL/6小黑鼠,将其饲养在12 h明/暗交替的动物饲养室,温度为22 ℃,提供足够的食物和水。于C57BL/6小鼠右下肢皮下接种2×106个MC38结直肠癌细胞后,使用游标卡尺监测肿瘤体积,肿瘤体积(mm3)= 长×宽×宽/2。当小鼠肿瘤体积达到约50 mm3时,被随机分配至不同的实验组别,进行治疗实验。当小鼠肿瘤体积达到约200 mm3时,进行SPECT显像研究。
本研究已通过厦门大学实验动物中心动物管理和使用委员会批准(ID:XMULAC20190150)。
1.4 SPECT显像
为评估99mTc-RGD在肿瘤鼠中的分布情况,对MC38肿瘤鼠进行了SPECT/CT显像研究。每只小鼠通过尾静脉注射18.5 MBq 99mTc-RGD,在注射后0.5 h、2 h、4 h、24 h时间点分别进行SPECT/CT显像,显像过程中采用2%的异氟烷与空气混合物对小鼠进行麻醉,使其呼吸平稳。
SPECT显像通过Nucline nanoScan-SPECT/CT扫描仪获得,具体参数:20~30 s/frame,窗口宽度:20%,矩阵:256×256。能量峰为140 keV。采用低能量高分辨率准直器,应用3D迭代算法软件(Tera-Tomo)重建图像,在重建后的SPECT图像上绘制感兴趣区域,并进行相对定量的比较分析。
1.5 治疗实验
选取MC38肿瘤鼠作为实验对象,当肿瘤体积达到约100 mm3时将其随机分为13组,每组8只,具体分组如下:生理盐水注射组、400 μg αPD-L1抗体注射组、不同剂量99mTc-RGD注射组(18.5 MBq、37 MBq、74 MBq)、99mTc-RGD+αPD-L1抗体联合治疗组(时间窗设置:0 h、4 h、24 h;放射性配体剂量设置:18.5 MBq、37 MBq、74 MBq;抗体剂量设置:200 μg、400 μg)。
根据分组给予小鼠相应的治疗,每只小鼠在第0天和第4天时分别尾静脉注射上述药物,每隔1 d进行肿瘤体积和小鼠体质量的监测,观察至给药后90 d。当肿瘤体积超过1500 mm3或小鼠体质量下降超过20%时,对小鼠实施安乐死。
1.6 统计学处理
采用GraphPad Prism 7.0软件进行统计学分析。小鼠的肿瘤生长曲线、生存曲线和体质量变化曲线均以线形图形式呈现。所有计量资料符合正态分布,以均数±标准差表示,组间比较采用方差分析或独立样本t检验。以P<0.05表示差异具有统计学意义。
2 结果
2.1 流式细胞术评估肿瘤细胞PD-L1表达水平
流式细胞术检测表明,经99mTc-RGD诱导后,CT26、MC38、4T1、B16F10四种肿瘤细胞表面的PD-L1表达水平均显著上调(图1A)。图1B展示了4种肿瘤细胞PD-L1表达水平在不同时间窗的定量结果,相较于对照组,PD-L1阳性细胞的比例增加,且每种细胞的PD-L1表达增加均具有统计学意义(P均<0.01)。
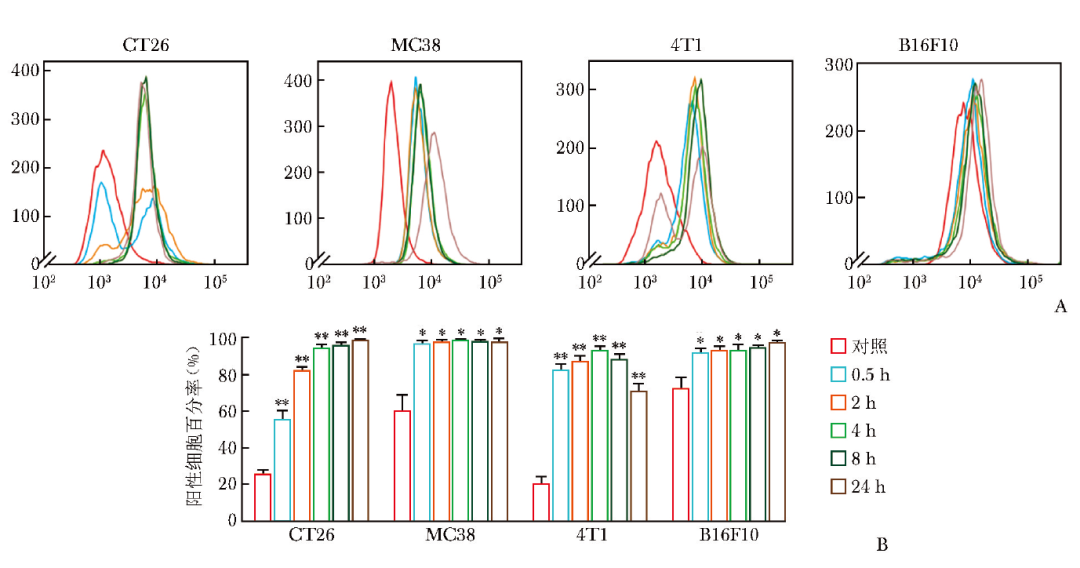
图1 流式细胞术评估肿瘤细胞表面PD-L1表达水平变化
A.99mTc-RGD诱导后4种肿瘤细胞在不同时间窗的PD-L1表达水平上调情况;B.99mTc-RGD诱导后4种肿瘤细胞在不同时间窗的PD-L1表达水平定量结果(*P<0.01,**P<0.001)
2.2 SPECT显像鉴定肿瘤模型探针摄取
注射99mTc-RGD后0.5 h、2 h、4 h、24 h,MC38肿瘤鼠模型的SPECT/CT显像图明显可见放射性探针摄取(图2),为调控肿瘤微环境和联合治疗提供了基础。
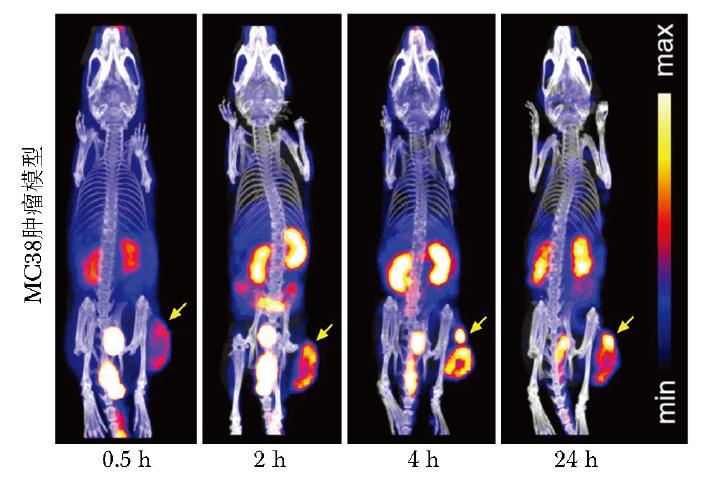
图2 MC38肿瘤鼠模型注射99mTc-RGD后不同时间窗的SPECT/CT显像图
此外,在肾脏也观察到明显的放射性信号聚集,由于该探针为水溶性,通过肾脏代谢造成一定的肾摄取,而其他主要脏器如心、肝、肺等均无明显摄取。
2.3 联合治疗改善MC38肿瘤鼠的治疗效果
通过动物实验探究99mTc-RGD联合αPD-L1抗体对MC38肿瘤鼠的治疗效果,治疗方案如图3A所示。
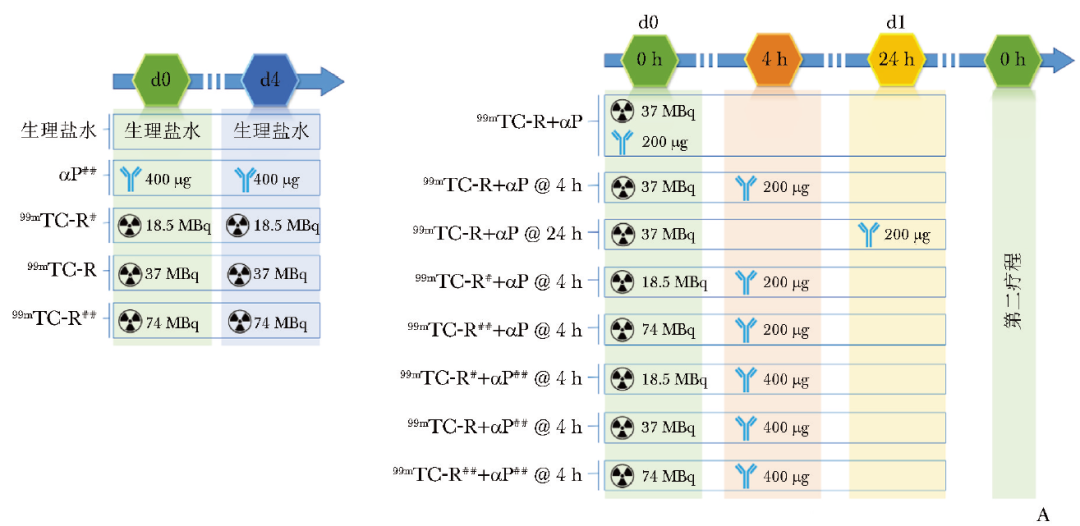
图3A 99mTc-RGD联合αPD-L1抗体治疗MC38肿瘤鼠模型的程序和时间窗示意图(当肿瘤体积达到50 mm3 左右时开始治疗,小鼠被随机分为13组,每组8只,治疗第4天行第二疗程给药)
实验结果表明,单纯99mTc-RGD或αPD-L1抗体治疗组无明显治疗效果,MC38肿瘤鼠的肿瘤体积均在30 d内超过1500 mm3。而对于联合治疗组,37 MBq 99mTc-RGD联合200 μg αPD-L1抗体在同时给药以及间隔4 h时间窗给药效果最佳,荷瘤鼠肿瘤生长速度减缓,间隔4 h时间窗的肿瘤鼠总生存期更长,故4 h为联合治疗的最佳时间窗。
随后探索了不同剂量99mTc-RGD(18.5 MBq、37 MBq、74 MBq)联合200 μg αPD-L1抗体在间隔4 h时间窗时的治疗效果,结果表明相较于37 MBq、18.5 MBq 99mTc-RGD联合200 μg αPD-L1抗体的治疗效果更弱;对于74 MBq 99mTc-RGD联合200 μg αPD-L1抗体,75%的小鼠肿瘤生长速度未被显著延缓,表明单纯增加放射剂量并不能改善肿瘤治疗效果。
随后探索增加抗体剂量对肿瘤治疗效果的影响,发现37 MBq 99mTc-RGD联合400 μg αPD-L1抗体取得了更好的治疗效果,75%的小鼠肿瘤体积逐渐减小并消退,监测至第90天未出现肿瘤复发迹象,其余25%的小鼠肿瘤生长速度减慢,生存时间延长(图3B)。
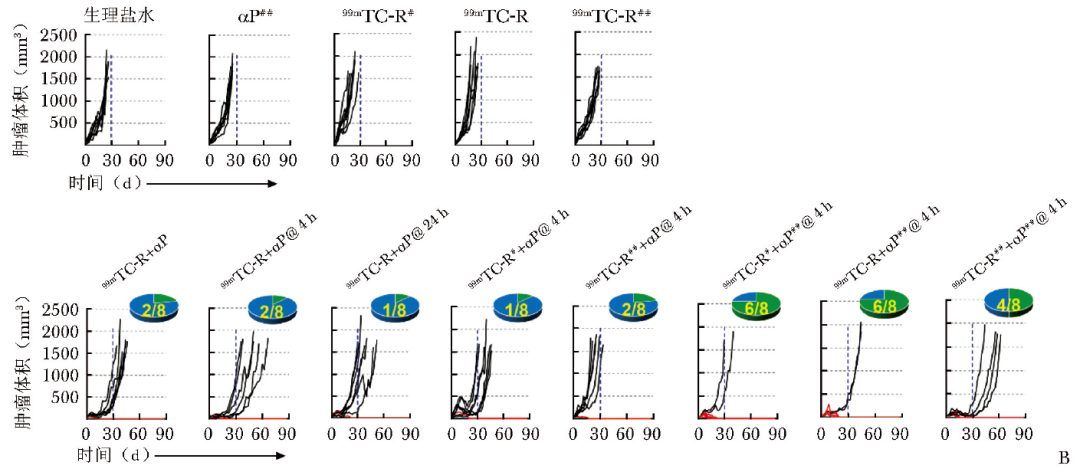
图3B 不同治疗组MC38肿瘤鼠模型90 d内单只小鼠的肿瘤生长曲线
该研究结果表明,相较于对照组和单一治疗组,联合治疗组的治疗效果更优,且与时间窗和给药剂量存在密切关系,而过高或过低的放射性剂量均会减弱治疗效果。
此外,根据每组肿瘤鼠的肿瘤体积平均大小,计算出了肿瘤生长曲线、生存曲线及体质量变化曲线(图4A)。37 MBq或74 MBq 99mTc-RGD联合400 μg αPD-L1抗体治疗组在给药后42 d内平均肿瘤生长速度最慢,相较于对照组和单一治疗组差异具有显著统计学意义(P<0.001)。
从监测至第90天的肿瘤生存曲线可以看出,37 MBq或18.5 MBq 99mTc-RGD联合400 μg αPD-L1抗体治疗组的生存率最高,75%的肿瘤鼠生存周期大于90 d,而74 MBq 99mTc-RGD联合400 μg αPD-L1抗体治疗组仅50%的肿瘤鼠生存周期为90 d。相比之下,对照组和单一治疗组小鼠的生存周期均小于30 d(图4B)。
小鼠体质量变化数据显示,无论联合治疗组还是对照组,肿瘤鼠体质量均保持稳定,无明显下降趋势(图4C),提示该治疗策略安全性良好。图4D显示最佳治疗组在给药后以及监测至第90天时的代表性外观及SPECT显像,可以看出小鼠肿瘤消退,外观恢复正常,无明显可见的肿瘤摄取信号。
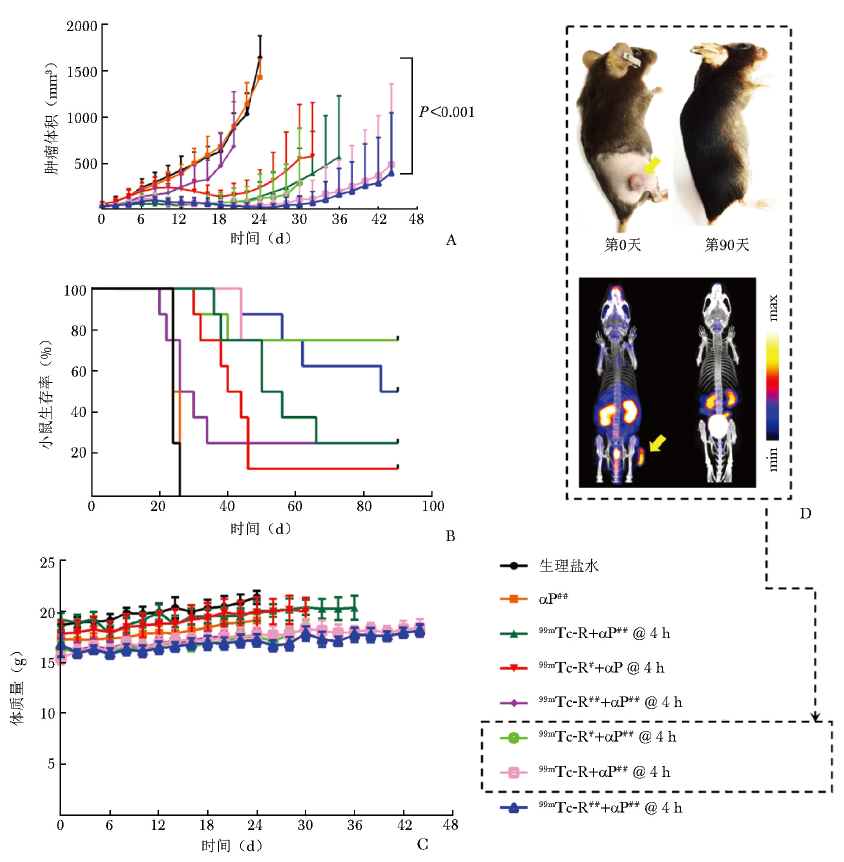
图4 99mTc-RGD联合不同剂量αPD-L1抗体治疗MC38肿瘤鼠模型的肿瘤生长曲线、生存曲线及体质量变化曲线
A.肿瘤生长曲线;B.生存曲线;C.体质量变化曲线;D.肿瘤监测期间获得的MC38肿瘤鼠模型照片及SPECT显像图,监测至90 d 时部分小鼠肿瘤完全消除
#区分不同的给药剂量,同图3A; 99mTc-R、αP、@4 h:同图3
3 讨论
本研究发现,99mTc-RGD可显著上调肿瘤细胞表面PD-L1表达水平;以MC38肿瘤鼠为模型,18.5 MBq或37 MBq 99mTc-RGD联合αPD-L1抗体在间隔4 h时间窗时可产生最佳抗肿瘤效果。
在肿瘤治疗方法中,手术、放疗、化疗是“并驾齐驱的三驾马车”,占据举足轻重的地位[13],但治疗过程中出现的肿瘤复发、耐药、转移以及免疫逃逸等使得患者的预后不佳[14]。
肿瘤免疫逃逸是指肿瘤细胞通过多种机制逃避机体免疫系统的识别和攻击,如肿瘤细胞通过表达PD-L1与T细胞表面的PD-1受体识别并相互作用,以逃避T细胞的攻击[15]。研究人员利用该特点对PD-L1/PD-1等位点的蛋白表达进行抑制,以激活T细胞,解除免疫抑制。
因此,一系列免疫检查点抑制剂被开发应用于临床[16]。但免疫检查点抑制剂在癌症患者中的响应率约为10%~30%,大部分患者对免疫治疗并无响应[17],如何提高免疫检查点抑制剂的响应率是目前临床亟待解决的难题。
近年来,随着放射性药物与核医学的发展,许多放射性示踪剂被开发用于肿瘤等多种疾病的诊断和治疗。其中18F、68Ga、99mTc、64Cu、89Zr等作为最常用的诊断性核素,不仅在临床前研究中占据主要地位,且在临床中的应用也较为广泛,尤其在肿瘤与心血管疾病领域是非常重要的检测手段。
作为治疗药物,放射性配体靶向疗法近年来受到广泛关注,其中177Lu、131I、90Y、225Ac等治疗性核素因释放β-或α粒子对组织进行破坏,其对复发转移性全身肿瘤以及化疗耐药肿瘤仍表现出不错的杀伤效果,因此其治疗潜力较大。
免疫治疗具有独特的肿瘤杀伤效果,使其成为临床部分癌症如非小细胞肺癌的治疗选择之一,然而较低的响应率也阻碍了其在多种癌症中的广泛应用。越来越多的研究人员开始探索不同癌症疗法联合免疫治疗的策略,其中靶向放射性配体疗法与免疫检查点抑制剂联合是目前最为火热的治疗方法之一。
大部分联合治疗均是基于治疗性核素177Lu、131I、90Y与免疫检查点抑制剂如αPD-1/PD-L1抗体联合进行治疗,利用治疗性核素对肿瘤组织进行直接破坏,同时通过免疫检查点抑制剂激活免疫细胞,更进一步对肿瘤组织进行杀伤。笔者团队曾采用177Lu-EB-RGD联合αPD-L1抗体对CT26和MC38肿瘤鼠进行治疗,9.25 MBq或18.5 MBq 177Lu-EB-RGD联合200 μg αPD-L1抗体组在间隔4 h时间窗时均取得了较好的治疗效果[5]。
最优治疗组的小鼠肿瘤在单次给药后全部消除,且无复发现象,治愈的小鼠再次接种相同的肿瘤细胞后不再生长,证实免疫记忆效应的产生。此外,诊断治疗性核素64Cu标记的EB-RGD联合αPD-L1抗体治疗肿瘤的研究结果表明,18.5 MBq 64Cu-EB-RGD联合200 μg αPD-L1抗体治疗方案在间隔4 h时间窗时取得了最优治疗效果,该组小鼠肿瘤体积均逐渐减小并消退,且监测至第90天亦无复发迹象,这些研究结果均表明放射性配体联合αPD-L1抗体在适当时间窗时治疗策略的可行性。
为进一步验证该策略的有效性,选择临床最常用的PET示踪剂2-[18F]FDG联合αPD-L1抗体,在经剂量和时间窗的探索之后,研究证实了即使是单纯的诊断性核素,在合适的剂量与时间窗的联合下也可显著延缓肿瘤的生长,甚至缩小肿瘤体积,直至消除肿瘤。
由于整合素受体αvβ3具有高亲和力、高特异性和广谱性,本研究选择整合素αvβ3靶向多肽RGD作为靶向分子,利用99mTc标记RGD作为放射性示踪剂以调节肿瘤微环境,研究结果表明99mTc-RGD可上调多种肿瘤细胞(如CT26、MC38、4T1、B16F10等细胞)表面的PD-L1蛋白表达水平。
基于前期研究结果,放射性核素诱导PD-L1表达上调可重塑肿瘤微环境,这种暂时的PD-L1表达上调可阻止肿瘤微环境中免疫系统的过度激活,且可增加肿瘤细胞对αPD-L1抗体的摄取量。因此,通过SPECT显像验证了99mTc-RGD在MC38肿瘤模型中的高摄取。
基于此,联合99mTc-RGD与αPD-L1抗体在MC38肿瘤鼠模型中进行治疗,结果显示剂量和时间窗的设置均对肿瘤治疗效果影响较大,且99mTc-RGD的剂量与治疗效果不成正比,相较于18.5 MBq和74 MBq,37 MBq 99mTc-RGD产生的联合治疗效果最佳。本研究也证实了99mTc-RGD联合αPD-L1抗体治疗肿瘤在4 h间隔时间窗时产生了最佳疗效。
本研究存在不足之处:与传统治疗核素177Lu标记的化合物相比,99mTc-RGD需更高的给药剂量(37 MBq),且二次给药方可达到明显的治疗效果,而177Lu标记的RGD或PSMA等靶向配体单次给药(7.4 MBq)即可缩小肿瘤体积,甚至完全抑制肿瘤生长;不同核素对于不同肿瘤模型的PD-L1表达调节效果不尽相同,本研究仅对MC38肿瘤鼠模型进行了联合治疗,后续将在更多种类的肿瘤鼠模型中进行实验,以探索99mTc-RGD的最大治疗优势,并观察该核素在免疫抑制性肿瘤中的作用。
此外,除对整合素αvβ3靶向分子进行研究外,未来将探索更多靶向配体,包括PSMA、SSTR、FAP、GRPR等靶向多肽或小分子抑制剂标记不同核素后改善PD-L1相关免疫检查点抑制剂的疗效。
综上所述,不同的放射性核素标记的药物与免疫检查点抑制剂联合在合适的剂量和时间窗时均可产生显著的治疗效果,即使是单纯的诊断性核素,其对于免疫微环境的调控也有利于αPD-L1抗体发挥作用,提高免疫治疗的响应率和敏感性,如若将其应用于临床,将使更多肿瘤患者获益。
参考文献
[1]Sung H,Ferlay J,Siegel RL,et al. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries[J]. Ca Cancer J Clin,2021,71: 209-249.
[2]Das S,Al-Toubah T,El-Haddad G,et al. Lu-177-DOTA-TATE for the treatment of gastroenteropancreatic neuroendocrine tumors[J]. Expert Rev Gastroent,2019,13: 1023-1031.
[3]Hennrich U,Eder M. [Lu-177]Lu-PSMA-617 (Pluvicto (TM)): The First FDA-Approved Radiotherapeutical for Treatment of Prostate Cancer[J]. Pharmaceuticals,2022,15: 1292.
[4]Wen XJ,Zeng XY, Shing CR,et al. PD-L1-Targeted Radionuclide Therapy Combined with alpha PD-L1 Antibody Immunotherapy Synergistically Improves the Antitumor Effect[J]. Mol Pharmaceut,2022,19: 3612-3622.
[5]Wen XJ,Zeng XY,Shi CR,et al. Optimum Combination of Radiopharmaceuticals-Based Targeting-Triggering-Therapy Effect and PD-L1 Blockade Immunotherapy[J]. Adv Therap,2023, 6: 22001
[6]Gutfilen B,Al Souza S,Valentini G. Copper-64: a real theranostic agent [J]. Drug Des Dev Ther,2018,12: 3235-3245.
[7]Wen XJ,Zeng XY,Liu J,et al. Synergism of Cu-64-Labeled RGD with Anti-PD-L1 Immunotherapy for the Long-Acting Antitumor Effect[J]. Bioconjugate Chem,2022,33: 2170-2179.
[8]Wen XJ,Shi CR,Zeng XY,et al. A Paradigm of Cancer Immunotherapy Based on 2-[18F]FDG and Anti-PD-L1 mAb Combination to Enhance the Antitumor Effect[J]. Clin Cancer Res,2022,28: 2923-2937.
[9]Niu G,Chen XY. Why Integrin as a Primary Target for Imaging and Therapy[J]. Theranostics,2011,1: 30-47.
[10]Hamidi H,Ivaska J. Every step of the way: integrins in cancer progression and metastasis[J]. Nat Rev Cancer,2018,18: 532-547.
[11]Zhou Y,Kim YS,Chakraborty S,et al. 99mTc-Labeled Cyclic RGD Peptides for Noninvasive Monitoring of Tumor Integrin αvβ3 Expression[J]. Mol Imaging,2011,10: 386-397 .
[12]Zhou Y,Kim YS,Lu X,et al. Evaluation of 99mTc-labeled cyclic RGD dimers: impact of cyclic RGD peptides and 99mTc chelates on biological properties[J]. Bioconjug Chem,2012,23: 586-595.
[13]Baskar R,Lee K A,Yeo R,et al. Cancer and Radiation Therapy: Current Advances and Future Directions[J]. Int J Med Sci,2012,9: 193-199.
[14]Norouzi S,Gorgi Valokala M,Mosaffa F,et al. Crosstalk in cancer resistance and metastasis[J]. Crit Rev Oncol Hematol,2018,132: 145-153.
[15]Kornepati AVR,Vadlamudi RK,Curiel TJ. Programmed death ligand 1 signals in cancer cells[J]. Nat Rev Cancer,2022,22: 190.
[16]Topalian SL,Taube JM,Pardoll DM. Neoadjuvant checkpoint blockade for cancer immunotherapy[J]. Science,2020,367: eaax0182.
[17]de Miguel M,Calvo E. Clinical Challenges of Immune Checkpoint Inhibitors[J]. Cancer Cell,2020,38: 326-333.


