【衡道丨干货】2024版CSCO食管癌指南更新,国内外权威共识指南中的食管癌的病理诊断有何异同?
时间:2024-08-01 17:00:27 热度:37.1℃ 作者:网络
一、内镜活检标本
所有标本应及时、充分固定:4%甲醛溶液(10%中性缓冲福尔马林)固定液,活检标本应立即固定,手术切除标本尽可能半小时内固定,建议在病理申请单或相应的信息系统上记录标本离体时间和固定时间,以备查询。固定液应超过标本体积的10倍以上;
标本离体后,应由内镜医师展平,平贴在滤纸上,立即放入固定液中固定。活检黏膜全部取材,应将黏膜包于滤纸中以免丢失。取材时应滴加伊红,利于包埋和切片时技术员辨认。包埋时需注意要将展平的黏膜立埋。
大体检查
Ⅰ级推荐:组织大小与数目
镜下检查
Ⅰ级推荐:明确病变性质和类型:肿瘤/非肿瘤;良性/恶性;癌前病变/癌;组织学类型;组织学分级。
-
食管癌的癌前病变包括鳞状细胞癌的癌前病变和腺癌的癌前病变,即鳞状上皮和腺上皮的上皮内瘤变/异型增生。上皮内瘤变和异型增生两个名词可通用。
-
食管癌WHO组织学类型(参照2019版WHO消化系统肿瘤分类):
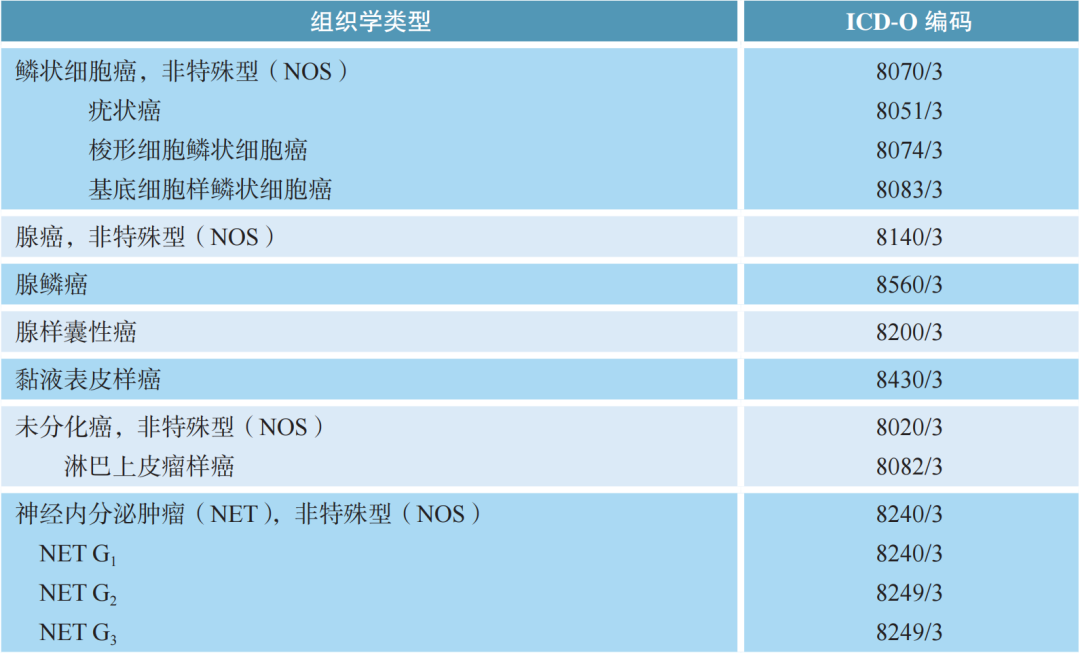

-
组织学分级:鳞状细胞癌和腺癌依据分化程度分为高分化、中分化和低分化。
免疫组织化学/分子病理检测:
Ⅱ级推荐:用于鉴别诊断的免疫组化标志物检测;晚期食管胃交界部腺癌需做HER-2免疫组化,2+的病例需进一步行FISH检测;晚期食管胃交界部腺癌应做MMR或MSI检测;对拟采用PD-1抑制剂治疗的食管或食管胃交接部癌患者,推荐评估癌组织中PD-L1表达。
-
根据鉴别目标选取,食管鳞状细胞癌典型的免疫表型为CK5&6+/P40+/P63+;食管小细胞癌典型的免疫表型为Syn+/ChrA+/CK5&6-/P40-/P63-。
-
食管胃交界部腺癌是横跨解剖学上食管胃交界部的腺癌。解剖学上食管胃交界部是指管状食管变为囊状胃的部位,即食管末端和胃的起始,相当于腹膜返折水平或希氏角或食管括约肌下缘,与组织学上的鳞柱交界不一定一致。
-
错配修复(MMR)蛋白的检测:免疫组织化学方法检测4个常见MMR蛋白(MLH1、MSH2、MSH6和PMS2)的表达,阳性表达定位于细胞核。任何一个蛋白表达缺失为dMMR(错配修复功能缺陷),所有4个蛋白表达均阳性为pMMR(错配修复功能完整)。
-
微卫星不稳定(MSI):建议采用美国国家癌症研究院(NCI)推荐的5个微卫星(MS)检测位点(BAT25、BAT26、D5S346、D2S123和D17S250)。判断标准为三级:所有5个位点均稳定为MSS(微卫星稳定),1个位点不稳定为MSI-L(微卫星低度不稳定),2个及2个以上位点不稳定为MSI-H(微卫星高度不稳定)。MSI多由MMR基因突变及功能缺失所致,也可以通过检测MMR蛋白缺失来反映MSI状态。一般而言,dMMR相当于MSI-H,pMMR相当于MSI-L或MSS。
Ⅲ级推荐:晚期患者可考虑行NGS检测;可疑遗传性肿瘤综合征患者,推荐胚系突变检测
-
条件允许,可进行NGS检测TMB和NTRK基因融合等。
-
低龄、肿瘤家族史和多原发癌患者,推荐胚系突变检测(血液或唾液NGS检测),推荐先检测先证者。
与NCCN指南比较
NCCN指南指出病理报告中应包括:
-
浸润(若存在);将Barrett食管中重度不典型增生报告为上皮内瘤变(不典型增生)(Tis);
-
组织学类型;
-
分级;
-
是否存在Barrett食管;
-
推荐对所有新诊断的患者通过PCR/NGS进行MSI或通过IHC行MMR通用检测。
二、内镜下切除标本(EMR/ESD)
内镜下黏膜切除术(EMR)/内镜下黏膜下剥离术(ESD)标本:应由内镜医师展平标本,黏膜面向上,固定于软木板(或泡沫板)上,标记口侧及肛侧方向,立即完全浸入足量固定液中。测量并记录标本大小(最大径×最小径×厚度),食管胃交界部标本要分别测量食管和胃的长度和宽度。记录黏膜表面的颜色,是否有肉眼可见的明显病变,病变的轮廓是否规则,有无明显隆起或凹陷,有无糜烂或溃疡等,记录病变大小(最大径×最小径×厚度)、大体分型以及病变距各切缘的距离(至少记录病变与黏膜侧切缘的最小距离)。多块切除的标本宜由手术医师根据内镜下病变的轮廓/碘不染色轮廓(食管鳞状上皮病变)在标本固定前进行重建。应全部取材。宜涂碘识别病变(碘不染色区)和最近侧切缘,垂直于最近侧切缘取材。黏膜侧切缘与基底切缘宜用不同颜色的墨汁或染料标记。食管胃交界部标本宜沿口侧—肛侧的方向取材。每间隔2~3mm平行切开,全部取材,按同一方向立埋。记录组织块对应的部位。建议将多块切除的标本分别编号和取材,不需考虑侧切缘的情况。
大体检查
Ⅰ级推荐:标本大小、肿瘤大体分型、肿瘤大小
-
食管癌的大体分型:
早期/表浅食管癌推荐巴黎分型(同早期/表浅食管癌日本大体分型,即0型)。
隆起型(0~Ⅰ):又可分为有蒂隆起型(0~Ⅰp)和无蒂隆起型(0~Ⅰs)。
表浅型(0~Ⅱ):又可分为表浅隆起型(0~Ⅱa)、表浅平坦型(0~Ⅱb)和表浅凹陷型(0~Ⅱc)。同时具有表浅隆起和表浅凹陷的病灶根据表浅隆起/表浅凹陷的比例分为表浅凹陷+表浅隆起型(0~Ⅱc+Ⅱa型)和表浅隆起+表浅凹陷型(0~Ⅱa+Ⅱc型)。
凹陷(溃疡)型(0~Ⅲ):凹陷和表浅凹陷结合的病灶根据凹陷/表浅凹陷的比例分为表浅凹陷+凹陷型(0~Ⅱc+Ⅲ型)和凹陷+表浅凹陷型(0~Ⅲ+Ⅱc型)。
-
进展期食管癌推荐国内分型:
髓质型:以食管壁增厚为特点,边缘坡状隆起。
蕈伞型:肿瘤边缘隆起,唇状/蘑菇样外翻,表面可伴有浅溃疡。
溃疡型:少见,此类型也可见于早期/表浅癌。中央有明显溃疡,通常伴有边缘隆起(与Borrmann分型的2或3型对应)。
缩窄型:以管腔明显狭窄为特点,患者的吞咽困难症状明显。
腔内型:少见,此类型也可见于早期/表浅癌。病变像蘑菇样或大息肉样,有细蒂。
镜下检查
Ⅰ级推荐:癌前病变(上皮内瘤变/异型增生);高级别/低级别癌:组织学类型、组织学分级、浸润深度/层次、黏膜下层浸润深度(μm)、侧切缘和基底切缘、脉管侵犯
-
对于黏膜下层浸润癌,如为内镜下切除标本,应测量黏膜下层浸润深度(μm),超过200μm的转移风险高,需补充食管切除+淋巴结清扫术或放化疗。
-
脉管侵犯:淋巴管/血管浸润(尤其是对于内镜下切除标本,如果怀疑有淋巴管/血管浸润,建议做免疫组化CD31、D2-40确定是否有淋巴管/血管浸润;弹性纤维染色判断有无静脉侵犯)。
免疫组织化学/分子病理检测:
Ⅱ级推荐:用于鉴别诊断的免疫组化标志物检测
Ⅲ级推荐:可疑遗传性肿瘤综合征患者,推荐胚系突变检测
与NCCN指南比较
NCCN指南指出病理报告中应包括:
-
浸润(若存在);
-
组织学类型;
-
分级;
-
肿瘤浸润深度;
-
⾎管/淋巴管浸润;
-
黏膜及深部切缘状态;
-
推荐对所有新诊断的患者通过PCR/NGS进行MSI或通过IHC行MMR通用检测。
三、根治术标本
根治术标本:沿肿瘤对侧打开食管壁。黏膜面向上,固定于软木板(或泡沫板)上,立即完全浸入足量固定液中。取材时记录切除食管长度、肿瘤部位、肿瘤距口侧切缘和肛侧切缘及环周切缘的距离、肿瘤大体分型、大小、切面颜色、质地、浸润深度、累及/未累及食管胃交界部(累及食管胃交界部者,记录肿瘤中心距食管胃交界部的距离)、肿瘤旁或肿瘤周围食管黏膜/肌壁检查所见。食管胃交界部腺癌建议采用Siewert分型。取材必要时涂碘识别病变(碘不染色区)。食管取材可自肿瘤中心从口侧切缘至肛侧切缘取一条组织分块包埋(包括肿瘤、肿瘤旁黏膜及两端切缘),并记录组织块对应的方位(宜附照片或示意图并做好标记)。推荐纵向取两端切缘与肿瘤的关系,对肿瘤距两端切缘较远者,也可横向取两端切缘。单独送检的闭合器切缘应剔除闭合器后全部取材观察。对肿瘤侵犯最深处及可疑环周切缘受累处应重点取材。推荐使用墨汁或染料标记环周切缘。对周围黏膜糜烂、粗糙或碘不染色等改变的区域或周围食管/胃壁内结节及食管胃交界部组织应分别取材。若附纵隔胸膜、肺和膈肌等其他邻近器官应观察取材。对早期食管癌或新辅助治疗后根治术标本,建议将可疑病变区和瘤床全部取材。
Siewert分型:
Siewert分型是Siewert等学者基于食管胃交界部的解剖学特点提出的分型,也称Munich分型。他们认为,远端食管腺癌和贲门腺癌应属同一种疾病,即食管胃交界部腺癌。食管胃交界部腺癌是指肿瘤中心位于解剖学上食管胃交界部(解剖学上的食管胃交界部是指管状食管变为囊状胃的部位,即食管末端和胃的起始,相当于希氏角或腹膜返折水平或食管括约肌下缘,与组织学上的鳞柱交界不一定一致)上、下各5cm这段范围内的腺癌,可分为三型。
Ⅰ型:相当于远端食管腺癌,肿瘤中心位于食管胃交界部上1~5cm处。
Ⅱ型:相当于贲门腺癌,肿瘤中心位于食管胃交界部上1cm至下2cm处。
Ⅲ型:相当于贲门下腺癌,肿瘤中心位于食管胃交界部下2~5cm处。
大体检查
Ⅰ级推荐:标本类型;肿瘤部位;食管长度;肿瘤大体类型;肿瘤大小和数目;肿瘤距离两侧切缘和环周切缘的距离;淋巴结检出数目、大小
-
环周切缘是指食管的基底切缘,食管全周均没有浆膜覆盖。环周切缘阳性是指环周切缘有肿瘤,建议用0、>0~<0.1cm及≥0.1cm注明肿瘤距环周切缘的距离
-
送检的分组淋巴结应全部包埋取材。标准的二野或三野清扫且未经新辅助治疗的根治术标本应检出15枚以上淋巴结。若第一次未找到15枚淋巴结,建议复检
镜下检查
Ⅰ级推荐:组织学类型;组织学分级;浸润深度;脉管侵犯;神经侵犯;壁内转移;周围粘膜情况;两侧切缘;环周切缘;淋巴结转移数和总数;有无淋巴结被膜外侵犯;TNM分期;新辅助治疗后根治术标本的病理学评估
-
食管癌分期采用美国癌症联合会(AJCC)TNM分期第8版。若肿瘤累及食管胃交界部,肿瘤中心在食管胃交界部食管侧者或在胃侧2cm之内者(Siewert分型Ⅰ型和Ⅱ型),按食管癌分期;肿瘤中心在近端胃2cm之外(Siewert分型Ⅲ型)按胃癌分期。肿瘤中心虽在近端胃2cm之内但未累及食管胃交界部者,按胃癌分期。TNM前加前缀p、c、r和y,分别代表病理分期、临床分期、复发性肿瘤分期和治疗后肿瘤分期。T后加后缀m或病灶的具体数目代表多发性原发肿瘤的分期。
-
新增:新辅助治疗后根治术标本的病理学评估:新辅助治疗后根治术标本要充分取材,大体上没有明显肿瘤残存的病例要将瘤床全部取材。食管癌的疗效分级系统宜采用CAP(College of American Pathologists)/NCCN(The National Comprehensive Cancer Network)指南的标准,推荐同时报告残存癌的比例(%)。淋巴结也要报治疗反应情况。
CAP/NCCN指南的新辅助治疗后病理学评估标准:
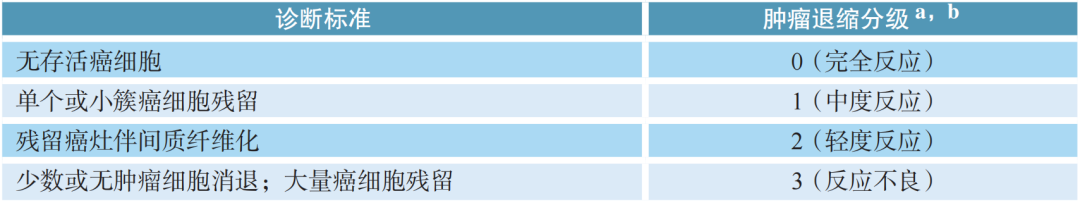
注:
新增:此肿瘤退缩分级只用来评估原发肿瘤。可参考Mandard、Becker、日本食管疾病学会病理学评估标准进行评估。建议同时报告残存肿瘤细胞比例。目前淋巴结的退缩评估尚无统一标准,建议按以下4种情况报告:①淋巴结有治疗反应但无残存肿瘤,淋巴结所在分组及个数;②淋巴结有治疗反应且有残存肿瘤,淋巴结所在分组及个数;③淋巴结有转移癌但无治疗反应,淋巴结所在分组及个数;④淋巴结无转移癌也无治疗反应。
疗效评估根据存活肿瘤细胞决定,经过新辅助治疗后出现的无肿瘤细胞的角化物或黏液湖不能认为是肿瘤残留;淋巴结内出现无肿瘤细胞的角化物或黏液湖不能认为是肿瘤转移。
免疫组织化学/分子病理检测:
Ⅱ级推荐:用于鉴别诊断的免疫组化标志物检测;晚期食管胃交接部腺癌需做HER-2免疫组化,2+的病例需进一步行FISH检测;晚期食管胃交接部腺癌应做MMR或MSI检测
Ⅲ级推荐:
可疑遗传性肿瘤综合征患者,推荐胚系突变检测
与NCCN指南比较
NCCN指南指出病理报告中应包括所有内镜黏膜切除术要素及:
-
与EGJ相关的肿瘤中心位置;
-
肿瘤是否跨过EGJ;
-
淋巴结状态和检出的淋巴结数量;
-
推荐对所有新诊断的患者通过PCR/NGS进行MSI或通过IHC行MMR通用检测(若之前未行)。
四、转移性食管癌手术/活检标本
大体检查
Ⅰ级推荐:标本类型;肿瘤部位;食管长度;肿瘤大体类型;肿瘤大小和数目;肿瘤距离两侧切缘和环周切缘的距离;淋巴结检出数目、大小
镜下检查
Ⅰ级推荐:明确病变性质和类型
免疫组织化学/分子病理检测:
Ⅱ级推荐:用于鉴别诊断的免疫组化标志物检测;晚期食管胃交界部腺癌需做HER-2免疫组化,2+的病例需进一步行FISH检测;晚期食管胃交界部腺癌应做MMR或MSI检测;对拟采用PD-1抑制剂治疗的食管癌或食管胃交界部癌患者,推荐评估癌组织中PD-L1表达。
注:新版更新中删除了“对拟采用 PD-1抑制剂治疗的食管鳞状细胞癌患者,推荐癌组织中评估 PD-L1 表达 CPS 评分。PD-L1(22C3)检测试剂盒已经获批用于食管鳞状细胞癌,作为帕博利珠单抗用于晚期二线治疗的伴随诊断,以CPS≥10作为阳性标准”。
修改为:“对拟采用 PD-1抑制剂治疗的食管或食管胃交界部癌患者,推荐评估癌组织中PD-L1表达。”
Ⅲ级推荐:可考虑行NGS检测;可疑遗传性肿瘤综合征患者,推荐胚系突变检测。
与NCCN指南比较
NCCN指南强调:
微卫星不稳定性(MSD)或错配修复(MMR)检测:
对于适合接受PD-1抑制剂治疗的局部晚期、复发性或转移性食管癌和EGJ癌患者,应考虑通过聚合酶链反应(PCR)NGS检测MSI或MMR。对福尔马林固定石蜡包埋(FFPE)组织进行检测,根据CAP DNA错配修复生物标志物报告指南,结果应判读为MS1-H或错配修复缺陷(dMMR)。
PD-L1检测:
可考虑在适合接受PD-1抑制剂治疗的局部晚期、复发性或转移性食管癌和EGJ癌患者中进行PD-L1检测。应使用FDA批准的用于FFPE组织的伴随诊断检测来识别接受PD-1抑制剂治疗的患者。
参考文献及书籍:
1.中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)食管癌癌诊疗指南 2024[M]. 北京 :人民卫生出版社, 2024.
2.NCCN Clinical Practice Guidelines in Oncology (NCCN Guidelines). Esophageal and Esophagogastric Junction Cancers. Version 3.2024


