严重ARDS(ARDS)的管理:入门
时间:2023-09-01 20:01:36 热度:37.1℃ 作者:网络
摘要
本综述探讨了严重ARDS(ARDS)和难治性低氧血症患者的生理学和循证管理,重点关注机械通气、辅助治疗和静脉-静脉体外膜肺氧合(V-V ECMO)。在COVID-19大流行期间,全球严重ARDS病例急剧增加,病死率很高。改善生存率和无呼吸机天数的主要治疗方法包括俯卧位、保守性液体管理和肺保护性通气策略。呼吸机的设置应尽可能个体化,以改善患者与呼吸机同步性并减少呼吸机诱导的肺损伤(VILI)。通过滴定呼气末正压(PEEP)以实现最佳呼吸系统顺应性,或通过使用先进方法(如电阻抗断层扫描或食道测压)进行个体化调节PEEP以降低高驱动压和机械功(VILI的两种可能的驱动因素)或许更加有益。在难治性低氧血症患者中,抢救性通气模式,如高频振荡通气(HFOV)和气道压力释放通气(APRV)可作为某些特定患者的额外选择。一些辅助治疗也可以审慎地使用,例如肺复张、吸入性肺血管扩张剂、神经肌肉阻滞剂或糖皮质激素,这些措施可以改善氧合,但不能显著降低病死率。对于某些难治性的病例,在上述基础上,追加使用V-V ECMO可改善气体交换,并通过让肺休息而适度改善患者的生存率。除了VILI之外,严重ARDS患者还存在其他并发症风险,包括急性肺源性心脏病(ACP)、身体虚弱以及神经认知功能障碍。即使在最严重的病例中,ARDS也是一种异质性疾病,未来的研究需要确定ARDS亚型,以便进行个性化治疗和更先进的护理。
引言
尽管2020年由于COVID-19大流行,ARDS的病例数量飙升,但曾在1967年就被首次描述的ARDS,依然是ICU中呼吸衰竭的常见原因。仅在美国,每年大约有19万例ARDS病例。ARDS的病理生理学根源于炎性和氧化性损伤对肺泡毛细血管屏障的破坏。这些会导致特征性临床(急性发作)、影像学(双肺阴影)、生理学(顺应性降低、分流增加)和组织学(典型的肺泡损伤)的紊乱。在严重的ARDS,由动脉氧分压(PaO2)与吸入氧浓度(Fi O2)比值(P/F)≤ 100降低,其病死率接近50%。在中-重度ARDS,PEEP可能会干扰P/F比值,并使用“P/FP比值”[(PaO2×10)/(Fi O2×PEEP)]进行校正处理,P/FP ≤ 100定义为重度ARDS。或使用无创指标,脉搏血氧饱和度(SpO2)与Fi O2的比值,即“S/F比值”,尽管目前没有明确界定的S/F比值,但该比值与P/F比值有很好的相关性,并且很容易在床旁获得。S/F比值<89与S/F比值<120更接近严重ARDS标准。
严重ARDS患者发生呼吸机诱导性肺损伤(VILI)的风险较高,可能会进展到难治性低氧血症和高碳酸血症。重度ARDS的传统治疗是支持性的,以肺保护性机械通气、俯卧位和保守性的液体管理为基础。一些辅助疗法(例如,吸入性肺血管扩张剂、糖皮质激素)在某些情况下可以使用,甚至某些患者可能需要静脉-静脉体外膜氧合(V-V ECMO)。本综述将总结基于循证的重度ARDS的管理(图.1),并强调能够改善严重ARDS的结局干预。

低潮气量
无论在压力辅助控制(PC)或容量辅助控制(VC)模式下的低潮气量通气都显著改善了ARDS的病死率,但这两种模式并非完美无缺。VC模式以控制气道压力为代价控制潮气量,而PC模式以潮气量和分钟通气量为代价控制气道压力。压力调节容量控制(PRVC)是一种自适应模式,可调节潮气量以达到设定的压力限值,但在呼吸驱动力较高的患者中可能存在不足之处。
具有里程碑意义的ARMA试验表明,与12 ml/kg 理想体重(IBW)相比,6 ml/kg IBW的潮气量降低了病死率(31% vs. 40%)和无呼吸机的天数增加。虽然在试验中潮气量范围为4-8 ml/kg,但方案中的目标潮气量为4-6 ml/kg,具体潮气量取决于当时的平台压(Pplat)。在试验入组的前5天,干预组的平均潮气量为6.2 ml/kg,在研究中6.5ml/kg被用作指定依从性的截止值。生理上,低潮气量通气降低了ARDS肺的驱动压、机械功和容积伤的风险。然而,低潮气量(4- 6ml/kg)仍可能导致气压伤,尤其在肺的顺应性较差时。气压伤可通过在VC模式或PC模式下进一步减少潮气量(以降低气道压力)来减轻。虽然低潮气量通气可提高ARDS的病死率,但在一些患者中可能耐受性差,进而导致呼吸机非同步性增加和镇静程度加深。
人-机不同步
假设患者呼吸努力与呼吸机输送的呼吸相匹配,患者触发的机械通气模式减少了呼吸功。人-机不同步事件很常见,如果频繁发生则可能会使结果恶化。人-机不同步事件可以通过人-机不同步指数(Asynchrony index,AI)进行量化,其定义为人-机不同步事件次数除以总通气周期数。在一项研究中,24%的患者AI > 10%。有证据表明,AI > 10%可能与ICU和院内病死率增加有关。
常见的人-机不同步情况包括触发不同步、循环不同步和流速不同步。当患者的呼吸努力不足以达到呼吸机送气的阈值时,会出现无效触发,并通过提高呼吸机的触发灵敏度或使用流量触发来改善。当由于内源性PEEP过高导致触发无效时,应努力降低内源性PEEP,或将外PEEP提高至内源性PEEP的75%左右,以降低患者触发呼吸机所需的压力梯度。反向触发可见于深度镇静患者,其中在呼吸机送气时触发肌肉用力,产生“患者触发”呼吸,这种情况可通过降低镇静水平或添加神经肌肉阻滞剂(NMB)来解决。循环不同步的发生可从吸气相到呼气相的循环,或过早或延迟。在过早的循环中,患者的呼吸努力在呼气期持续,导致双重触发和呼吸堆积。这种情况可通过增加PC的吸气时间或增加潮气量或减少VC的流量来解决。在延迟循环期间,与刚才的情况相反,可通过减少PC吸气时间或增加VC的流量来补救。最后,当患者的流量需求与呼吸机的流量需求不匹配时,就会出现流量不同步。流量饥渴更常发生在VC中,患者表现出过度的通气需求,压力-时间波形曲线上通常表现为“吸入”的切迹波形。增加流量或更改为PC模式可以改善这种人-机不同步。反之,可以通过减少VC模式下的流量或降低PC模式下的吸气压力来改善流量过冲现象。
呼气末压正(PEEP)
PEEP打开塌陷的肺泡,使恢复的肺泡参与气体交换,并通过增加潮汐式呼吸的气体分布来降低肺泡的过度膨胀。虽然在所有接受低潮气量通气的患者中,比较高PEEP和低PEEP策略对ARDS的病死率没有明显的好处,然而,对中-重度ARDS患者可能有一定的好处,特别是对PEEP有反应的患者(定义为高PEEP后P/F增加> 25 mm Hg)。由于ARDS存在显著的异质性,不同表型对PEEP的反应可能不同,因此,临床医生在滴定PEEP时应监测氧合的变化和肺的顺应性变化。PEEP滴定的方法是逐步增加PEEP,然后每2 - 5分钟减少2cm H2O,同时检查Pplat并监测肺顺应性的变化。如果患者的氧合或肺顺应性因PEEP的升高而恶化,则提示所用PEEP过高,而如果患者的氧合或肺顺应性改善,则可以继续滴定式增加PEEP,直至没有进一步的改善。
更先进的PEEP个体化方法包括应力指数(SI)、电阻抗断层扫描(EIT)和食管压力(Pes)引导(图2)。SI基于恒速流量(方波)容量控制通气期间的压力-时间曲线。线性压力升高提示肺泡恢复,但没有过度扩张(SI = 1)。随着肺膨胀,顺应性增加(向下凹波形,SI < 1)提示潮汐恢复,并从增加的PEEP中获益。相反,随着肺部膨胀,顺应性降低(凹向上的波形,SI > 1)表明过度膨胀,并从PEEP降低中获益(图2a)。SI并不优于其他PEEP滴定方法。EIT确定肺过度扩张的PEEP和肺塌陷最小的PEEP (PEEP with least over-distended and collapsed lung,PEEPODCL)(图2b)。
在一项重度ARDS研究中,EIT引导下的PEEP滴定可改善氧合、顺应性以及驱动压。最后,食道压监测可用于指导PEEP,并在食管压(Pes)与胸膜内压(Ppl)相等的假设下操作。将PEEP滴定至0 cm H2O的跨肺压(PL),其中PL = Pao−Pes, Pao为气道压。Pplat和PEEP分别代表末吸气和呼气时肺泡扩张压Pao。在EPVent试验中,Pes引导的PEEP滴定改善了氧合,然而,与EPVent-2试验中的经验性高PEEP相比,临床结果没有差异。但在EPVent-2试验的事后分析表明,利用食道压滴定PEEP时,将呼气末PL为 0 cm H2O的生存率均比PL为正压(PL> 0 cm H2O)或者为负压(PL< 0 cm H2O)的要好一些。食道压指导PEEP的理想目标包括(1)吸气末PL < 15-20 cm H2O,(2)呼气末PL = 0 cm H2O(±2 cm H2O),(3)跨肺驱动压(吸气末PL -呼气末PL))< 10-12 cm H2O(图2c)。通过PEEP来确定肺恢复能力的一种更新而优雅的方法是肺复张-膨胀比(Recruitment-to-inflation ratio),若该比值 ≥ 0.5表明肺复张需要较高的PEEP。
无论使用何种方法进行PEEP滴定和使用何种指标评估疗效,监测血流动力学反应也是必要的。PEEP可以减少心输出量(通过减少前负荷和增加后负荷),尽管氧饱和度增加,但可以降低氧输送(DO2)。相反,PEEP可以降低左室后负荷。因此,个体化PEEP滴定应考虑氧合、驱动压以及血流动力学。
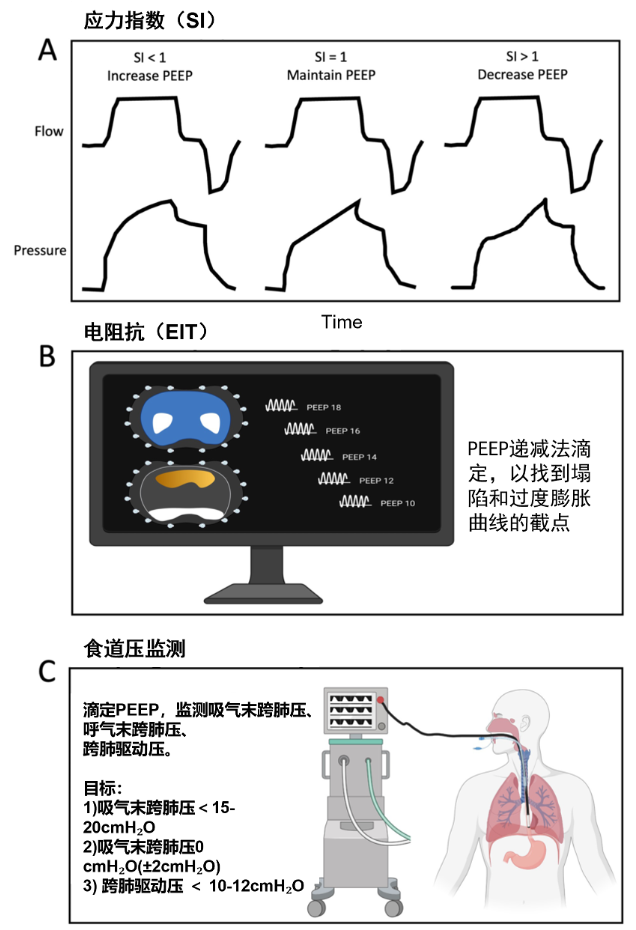
图2. PEEP 滴定的高级方法。 A 应力指数,基于恒流(方波)容量控制通气期间的压力-时间曲线。 B 采用建议的PEEP递减滴定法进行电阻抗断层扫描。上图是总体潮气阻抗,其中白色区域表示最大容量变化,下图是肺泡过度扩张(橙色)和塌陷(白色)的区域。 C 食道测压和相关的跨肺压指标。
肺复张策略
肺复张是一种暂时增加肺部气道压力的技术。常用的方法包括持续肺膨胀法(Sustained inflation,SI),(例如在CPAP模式下,35 - 40 cm H2O持续30-40 s, RR为0)或PEEP递增法(逐步增加PEEP,然后逐渐减少PEEP滴定)。肺复张操作的主要生理原理是在短时间内使用非常高的压力下提供静态或动态肺充气,以复张肺泡单位参与气体交换并改善呼吸系统的顺应性。大多数肺泡单位的复张发生在持续充气的前10秒,而血流动力学不稳定发生在10秒之后。递增PEEP的效果可能在11-20次呼吸后趋于稳定。
肺复张已被证明可以改善氧合,但尚未被证明可以改善病死率,实际上也可能是有害的。在一项研究中,22%接受肺复张的患者出现了非持续性低血压和/或低氧血症。在ART试验中,患者以逐步方式接受4分钟的肺复张操作(PC联合PEEP在25 cm H2O处维持1分钟,35 cm H2O维持1分钟,45 cm H2O维持2分钟),然后递减PEEP。由于在实验组观察到3次心脏骤停,因此在入组中期修改了肺复张操作,总体而言,实验组的病死率增加。评估肺复张策略的研究存在显著的异质性,这使得meta分析难以解释。虽然一些患者可能表现出氧合功能的改善,但有证据表明,没有降低病死率的好处,甚至可能是有害的。虽然不推荐将其作为常规治疗,但部分患者可能反应良好。如果使用PEEP递增法,然后递减滴定可能更有效,但应使用更适度的正压水平(20-25 cm H2O)。应避免长时间持续肺膨胀,以减少其导致的血流动力学不稳定的风险。
驱动压
与根据理想体重(IBW)调节潮气量不同,根据驱动压调节潮气量以达到调节肺的顺应性,是潮气量相对于呼吸系统静态顺应性的变化(Vt/Crs),或肺充气所需的压力差(Pplatp - PEEP)。高驱动压(> 15-17 cm H2O)与ARDS病死率独立相关。Amato等人重新分析了来自9项试验的3562名患者的数据,发现驱动压是风险分层的最佳变量;驱动压的降低与生存率的提高密切相关。LUNG SAFE研究也观察到了驱动压与病死率之间的关联。较新的分析表明,降低潮气量对病死率的益处随呼吸系统的顺应性而变化,肺弹性较高(换言之,顺应性较差)的患者获益更大。降低潮气量以降低驱动压对肺顺应性低的患者有最大的益处。优化呼吸机设置以实现驱动压力< 15 cm H2O可能是首要目标。目前正在进行临床试验,是以研究驱动压力为目标的呼吸机管理方法。
气道压力释放通气
气道压力释放通气(APRV)是治疗难治性低氧血症和ARDS的另一种机械通气方式。APRV是一种压力限制模式,在两个CPAP水平之间循环。在一定时间内(T-high)设置较高的气道压力(P-high) ,在较短时间内(T-low)设置较低的气道压力(P-low)(通常设置在0 cm H2O)。APRV采用倒置的吸:呼比(I:E),因为大部分自主呼吸是在T-high期间完成的,较高的P-high压力理论上允许塌陷的肺泡复张,而T-low压力则允许通气和完全呼气。APRV的益处包括允许自主呼吸,减少呼吸功,减少非同步化(因此减少镇静剂和肌松剂的使用)。也有人认为,与更传统的机械通气模式相比,较高的平均气道压力可能改善氧合。虽然APRV可能增加平均气道压力,但对潮气量和分钟通气的控制较少。一些患者可能还需要深度镇静和/或肌松,从而消除自主呼吸,但会影响充分的通气。这些问题可以通过时间控制自适应通气(Time-controlled adaptive ventilation,TCAV)来解决,在TCAV中,T-low设定为呼气流量峰值的75%时终止,在释放阶段保持足够的肺泡膨胀。如果患者需要更高的分钟通气,则降低T-high以增加释放频率,而T-low则根据呼气气流动力学保持设置。尽管它用于ARDS,但支持APRV的高质量证据缺乏,现有研究报告的结果好坏参半。一项对8项研究的系统回顾和荟萃分析发现,在急性低氧血症性呼吸衰竭的危重成人中使用APRV与改善病死率和氧合有关,尽管这些研究是小型单中心研究。另一项对6项涉及375例患者的研究的系统回顾和荟萃分析发现,APRV与改善氧合和缩短ICU住院时间有关,但对病死率没有影响。
最近,一项针对90名成人COVID-19相关ARDS患者的随机对照试验将APRV与传统低潮气量通气进行了比较,发现APRV与无呼吸机天数或病死率的改善无关。因此,需要更大规模、多中心、随机的研究来进一步阐明与常规通气相比,APRV是否对严重ARDS(或ARDS亚组)患者有益。
高频振荡通气
高频振荡通气(High frequency oscillatory ventilation,HFOV)是一种IMV模式,在极端呼吸频率(例如5-15 Hz或每分钟300-900次呼吸)下使用恒定的气道压力振荡,提供远低于解剖死腔的潮气量。气体交换是通过对流和扩散进行的:在大气道中,对流占主导地位,其中气体流动取决于湍流、整体对流和中央气道振荡压力。在肺外周和肺泡单位,弥散占主导地位,其中气体流动依赖于泰勒弥散(Taylor dispersion)、侧支通气、Pendelluft(译者注:直译‘悬空气流’,个人理解应该是‘气体摆动’?。‘Pendelluft’是呼吸生理学中的一个术语,用来描述呼吸过程中空气从肺内的一个部分移动到另一个部分,而不是从肺中进出的现象。这种肺内空气运动通常发生在具有不同时间常数(阻力x顺应性)的肺区域之间,特别是在不均匀通气或人机不同步通气时。这个词来源于德语中的“悬挂”和“空气”。在慢性阻塞性肺疾病(COPD)等疾病中可以观察到Pendelluft,肺的不同部位由于疾病而具有不同的阻力和顺应性,导致不均匀的充气和去充气区域并存。这种现象在机械通气中尤为重要,它可能导致通气量分布不均,并可能导致肺损伤。对于医疗保健提供者来说,在设置呼吸机参数和监测肺部疾病患者时考虑钟摆是很重要的)和心源性因素混合。较高的振荡压力可促进塌陷的肺泡复张,但在有通气肺泡中受到抑制。在小气道和肺中区,常规气流和扩散气流都是直接气流,取决于湍流、外周气道阻力、Pendelluft以及不对称的吸气和呼气速度分布。虽然HFOV之前被认为是治疗严重ARDS的一种抢救模式,但它的使用已经失宠。先前的研究发现,在中到重度ARDS患者中,结果喜忧参半,而一项针对548名中到重度ARDS患者的更大试验显示,与传统的高PEEP/低潮气量的机械通气相比,随机接受HFOV的患者的住院病死率更高。然而,在对四项研究(共计1552例患者)比较HFOV和常规IMV的荟萃分析中,HFOV与30天病死率的相关性因低氧血症的严重程度而不同:对于重度ARDS患者,HFOV与病死率的改善相关,而在轻至中度ARDS患者(P/F > 100)中,HFOV与病死率恶化相关。尽管各种协会建议不要在中到重度ARDS患者中常规使用HFOV,但可能会有一些患有严重ARDS的患者受益。
机械功
机械功(Mechanical power,MP)是从呼吸机传递到呼吸系统的机械能,已被假设为VILI的总驱动力。重度ARDS患者接受比轻度或中度ARDS患者更高机械能的机械通气,尽管目前尚不清楚这是否与进一步的肺损伤是否与其相关或是其导致进一步肺损伤的原因。功率方程包括潮气量、弹性、吸气和呼气时间、气道阻力、呼气末正压和呼吸频率。然而,这种数学表示并不一定解决能量如何分配到肺实质而非整个呼吸系统。机械能方程的其他简化版本已经使用在床边容易测量的参数来推导。最具临床实用价值的方程为MP = 0.098 × Vt × RR × PPeak−DP,式中MP为机械功,Vt为潮气量,RR为呼吸频率,PPeak为峰压,DP为驱动压。利用这一表述,对两组8207名ARDS患者的分析表明,即使接受低潮气量的患者,较高的机械功率(>17.0J/min)与较高的ICU病死率、住院期间病死率,以及30天的病死率独立相关,但也与无呼吸机天数减少独立相关。Costa等人使用一个更简单的模型,即MP = (4 × DP) + RR,说明了驱动压(DP)和呼吸频率(RR)相当于机械功,并与病死率相关。这表明驱动压和RR可能是VILI更重要的变量。
俯卧位
俯卧位通气改善了很多严重ARDS患者的氧合和呼吸力学。在这些患者的背部肺组织常因出现肺水肿、肺实变和肺不张常而有明显的异质性。俯卧位可以改善这种异质性,增加肺复张、改善通气-血流比例,并减少过度肺膨胀和肺泡张力。这些生理效应已经在使用电阻抗断层扫描(EIT)的动物模型中得到证实。PROSEVA试验是对中-重度ARDS患者(P/F<150,FiO2≥为60%)进行早期俯卧位的最著名研究。俯卧组患者28天的病死率为16%,仰卧组的为32.8%(P<0.001),90天病死率分别为23.6%,41%(P<0.001)。每次俯卧位的平均持续时间为17小时,俯卧位组的每个患者平均经历4次俯卧位。对俯卧位试验的荟萃分析表明,当俯卧时间持续 ≥ 12小时时,可以改善氧合和病死率。中-重度ARDS (P/F<150)患者一般在呼吸机治疗参数优化之后选择使用俯卧位。虽然肌松剂可能有助于俯卧位的安全实施,但这并非必需。在PROSEVA,患者继续俯卧直到仰卧位氧合改善到P/F ≥ 150,PEEP ≤ 10 cm H2O,FiO2 ≤ 0.6;因此,患者氧合的轻微改善不一定会停止使用俯卧位。如果氧合没有改善,则患者仍可能从改善的呼吸力学和减少的肺泡张力中受益,因为病死率收益与氧合的改善之间并无直接关系。这或许表明静态顺应性,而非P/F,是生理上更相关的俯卧终点。然而,目前仍然缺乏可靠的数据来支持依从性指导的俯卧位通气策略。
液体管理
ARDS期间的急性肺损伤可因体液超载而加重。由ARDS Network (FACTT)进行的一项具有里程碑意义的试验比较了ARDS的两种液体管理策略:“保守”策略(“conservative” strategy )和“自由”策略( “liberal” strategy)。这些治疗方案包括基于CVP或PAOP(肺动脉楔压)、伴或不伴有休克和少尿的心输出量(CO)、液体、利尿剂以及正性肌力药的组合。虽然对病死率没有影响,但采用保守液体治疗策略的患者(在有效循环存在的情况下,目标CVP < 4 mm Hg和PAOP < 8 mm Hg)液体积聚较少,无呼吸机天数和不住ICU天数增加。
非侵入性方法,即床旁超声检查(POCUS),也可用于监测血流动力学和血管内容量状态。静脉充血可表现为下腔静脉(IVC)扩张,IVC呼吸变异度差,肝静脉S波反转,而小的下腔静脉和小的高动力左室的静态充盈压力低。E/E′比> 15与左室充充盈压增加有关,而E/E′比< 8与左室充充盈压正常有关,特别是在结合肺部超声检查时。可以使用左心室流出道速度时间积分(LVOT VTI)和直径来评估每搏量和心输出量。IVC呼吸变异度不能很好地预测严重ARDS患者的容量反应性,因为该方法在使用>8ml/kg IBW潮气量的患者中得到了验证。LVOT VTI的呼吸变异度是预测液体反应性的较好指标,其中当LVOT VTI的呼吸变异度达到15 - 20%时提示有液体反应性。
糖皮质激素
经验性糖皮质激素治疗严重ARDS仍存在争议,临床试验结果差异很大。一项试验发现,中等剂量甲泼尼龙可显著降低机械通气时间、ICU住院时间和ICU病死率。然而,2006年由ARDS Network进行的一项更大规模的研究显示,在ARDS发病后7天内接受糖皮质激素治疗的患者没有临床获益,并且在ARDS发病后14天接受糖皮质激素治疗的患者病死率增加。最近,DEXA-ARDS试验研究了中重度ARDS患者,发现接受地塞米松治疗的患者无呼吸机天数更长,病死率也更低。地塞米松也被证明可以改善中-重度COVID-19肺炎所致低氧血症患者的总病死率。
不同的ARDS亚表型对糖皮质激素治疗的反应不同。ARMA和ALVEOLI试验的潜在分类分析显示存在两种不同的表型:(1)高炎性ARDS表型和(2)低炎性ARDS表型。高炎症表型表现出更高的总体病死率,在对COVID-19 ARDS的回顾性分析中,使用糖皮质激素可以改善病死率,而低炎症组使用糖皮质激素的病死率更低。尽管对所有严重ARDS患者常规性使用糖皮质激素仍有争议,但在某些ARDS亚组可能获益。
神经肌肉阻滞剂(肌松剂)
神经肌肉阻滞剂(NMB)通过以下几种机制改善氧合。肌松剂减少了氧耗,消除了人-机的不同步,并提高了胸壁和肺的顺应性。2010年的ACURASYS试验证明,中-重度ARDS (P/F < 150) 患者使用顺阿曲库铵进行48小时NMB治疗可降低病死率。2019年更大的多中心ROSE试验发现,在中-重度ARDS中使用NMB没有显著的病死率益处。然而,在招募时已经接受NMB的患者被排除在外,当临床医生判断认为有益时,有可能一部分患者仍然受益于NMB。此外,与ACURASYS相比,ROSE控制组比NMB组接受的镇静剂更少,这在以前与改善ICU结果相关。虽然NMB能显著改善氧合,但它是否能降低病死率还存在争议。
长期使用NMB会增加神经肌肉无力和肌肉丧失、压力损伤和深静脉血栓形成的风险,并需要深度镇静,这可能会增加谵妄和神经认知障碍,并减少无呼吸机天数。当使用NMB时,可使用四次训练(train-of-four,TOF,译者注:TOF操作,电极放置在患者的手腕上,并计算拇指抽动的次数。NMBA输注开始后,每30分钟测量一次拇指抽动,持续2小时,以确保达到适当的肌松水平。没有收缩表明NMBA过量;1-2次抽动表示肌松药合适,3-4次抽动表示需要增加肌松药剂量。一旦达到所需水平,每4小时测量一次对周围神经刺激的反应)监测来滴定至最低有效剂量。NMB期间也需要深度镇静,可使用脑电双频指数(BIS)滴定至目标值40-60。
吸入性肺血管扩张剂
几项试验研究了吸入性肺血管扩张剂在ARDS中的作用,特别是吸入性一氧化氮(iNO)和吸入性前列腺素(inhaled prostaglandins)。吸入性肺血管扩张剂通过改善通气-灌注比例来改善大多数患者的氧合和P/F比值,并可用于难治性低氧血症患者。然而,它们并不能改善病死率。
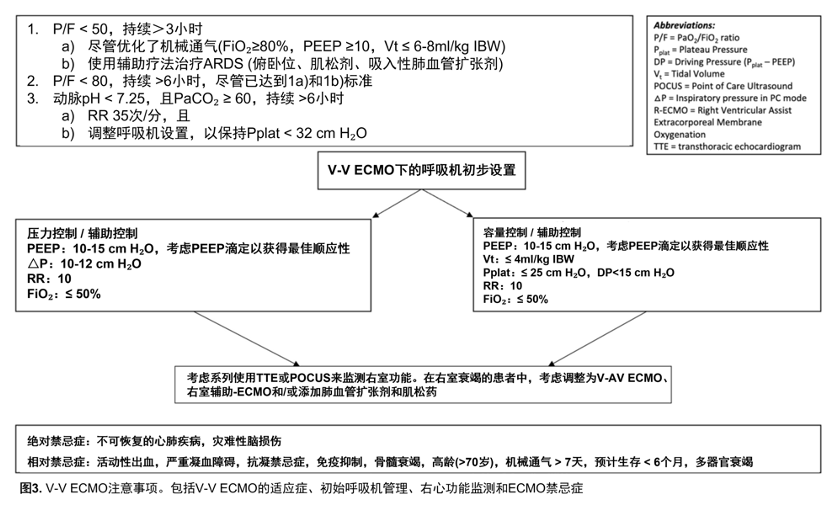
静脉-静脉体外膜肺氧合(V-V ECMO)
V-V ECMO为难治性呼吸衰竭患者提供体外气体交换,并在严重ARDS患者的护理中发挥关键作用,尽管其适应征和使用时机仍有争议。当比较ECMO和传统管理时,研究显示了一系列结果。V-V ECMO治疗ARDS的两个值得注意的前瞻性随机试验是CESAR试验和EOLIA试验。尽管有最佳呼吸机设置,CESAR仍招募了Murray评分≥ 3或pH < 7.2的受试者。CESAR将患者随机转移到ECMO中心,而不是自己使用ECMO治疗。在被转移的患者中,20%没有使用ECMO(只是用了优化的常规机械通气),其中82%存活。被转移到ECMO中的患者,总的生存受益(63%对47%,P = 0.03)。EOLIA招募了P/F < 50 持续 > 3小时、P/F < 80 持续 > 6小时(FiO2 > 80%)的患者,这些患者采用了最佳呼吸机设置和辅助措施(肌松剂、俯卧位、吸入性肺血管扩张剂),或pH < 7.25和pCO2 > 60,同时维持PPlat < 32和最大RR 35(图3)。尽管ECMO组的病死率没有明显的改善趋势(p = 0.09),但该研究采用了意向性治疗设计,对照组中有28%的患者接受挽救性ECMO治疗,其中43%的患者存活。从ECMO获益最多的亚组是气道压力过高和难治性呼吸性酸中毒患者。事后贝叶斯分析和荟萃分析表明,ECMO可能提供约10%的病死率获益。
虽然V-V ECMO患者的最佳呼吸机设置尚不明确,但ECMO的使用目的是让“肺休息”,显著降低了驱动压、PPlat和机械功,这可能会减少持续的VILI (图3.)。使用ECMO时,较高的PEEP和较低的驱动压与病死率的降低和细胞因子释放的减少相关。使用EIT在小型队列中评估了最佳PEEP,证明大多数患者需要10-15cm H2O的PEEP,以最大限度地减少肺泡的过度膨胀和肺不张,并提高肺的顺应性。PEEP也可以在床旁进行滴定,以实现最佳的顺应性。
急性肺源性心脏病(Acute cor pulmonale,ACP)
ACP在严重ARDS中很常见,发病率约为25%,但在COVID-19中可能更高(~38%)。ACP的病因通常是多因素的,包括肺血管功能障碍、伴有肺血管收缩的局部低氧血症和肺顺应性差时的高平均气道压。根据右心室与左心室(RV/LV)比值≥ 1并伴有右心室间隔部运动障碍的定义,重度ACP与更高的病死率相关。严重ARDS患者应通过超声心动图或POCUS连续监测右心室功能障碍的进展情况。如果出现右心室功能障碍,应密切注意血管内容量状况和心输出量。可使用吸入性肺血管扩张剂(如一氧化氮、依前列醇或全身性血管扩张剂(如西地那非)来降低肺压力。正性肌力药可用于增加心输出量。PEEP对肺血管阻力(PVR)和右心室功能的影响可能不同。PVR-肺容积曲线通常呈U形,在功能残气量时PVR最低。较高的PEEP可诱发更多的West’s 1区和2区的生理反应,导致PVR和RV功能障碍的增加。然而,肺循环中的缺氧性血管收缩也会增加PVR,这可以通过更高的PEEP来解决。临床医生应仔细滴定PEEP,了解这种细微差别。对于需要V-V ECMO治疗的ACP患者可考虑进行体外循环回路的调整,如使用右心室辅助ECMO (OxyRVAD),在经食管引导下将回流管放置在主肺动脉内,以绕过衰竭的右心室或V-AV ECMO(图4.)。

ARDS的生存质量问题
严重ARDS的幸存者可能患上持续多年的身体和神经认知后遗症的风险增加。常见的并发症包括由于气管导管压力相关的创伤引起的声带功能障碍和气管狭窄、皮肤压力性损伤、虚弱、神经肌病和认知功能障碍。一项对109名ARDS幸存者的研究发现,出院后一年仍有功能障碍,包括肺功能测试异常,6分钟步行距离缩短,以及与健康相关的生活质量下降。
此外,ARDS的严重程度可预测6个月的运动能力。ECMO幸存者的健康相关生活质量也较低。肌无力很常见,会影响长期功能。急性骨骼肌萎缩发生在一周内,在多器官衰竭患者中更为明显。接受糖皮质激素和/或NMB治疗的患者罹患危重肌病的风险更高,而且在出院后5年身体状况仍持续下降。
神经认知功能障碍在ARDS后也很常见,数据显示,>50%的幸存者在一年后有持续性认知障碍。精神疾病,包括抑郁症、创伤后应激障碍(PTSD)、焦虑和自杀,在ARDS之后也以更高的频率发生。
结论
严重的ARDS具有很高的发病率和病死率,难治性低氧血症的处理具有挑战性。低潮气量通气、俯卧位、保守的液体管理和个体化的PEEP滴定将驱动压降至最低,这些都是改善严重ARDS预后的措施,并且这些措施也都是严重ARDS治疗的主要支柱。优化呼吸机-肺力学(包括机械功和驱动压),可能会进一步降低继发性VILI。难治性低氧血症患者可以从吸入肺血管扩张剂和神经肌肉阻断剂中受益,尽管这些干预措施一直并未被证明能改善病死率。V-V ECMO可能在某些亚组患者中提供很小(~10%)的病死率收益,但可以在个案的基础上去考虑使用。


