NEJM:带来新的福音!基因编辑技术治疗镰状细胞病临床结果发布:症状改善
时间:2023-09-05 11:52:04 热度:37.1℃ 作者:网络
镰状细胞病是由成人血红蛋白β-珠蛋白亚基缺陷引起的。镰状血红蛋白在缺氧条件下聚合,产生变形的红细胞,导致溶血和血管阻塞,导致进行性器官损伤和早期死亡。红细胞中胎儿血红蛋白水平升高可预防镰状细胞病的并发症。
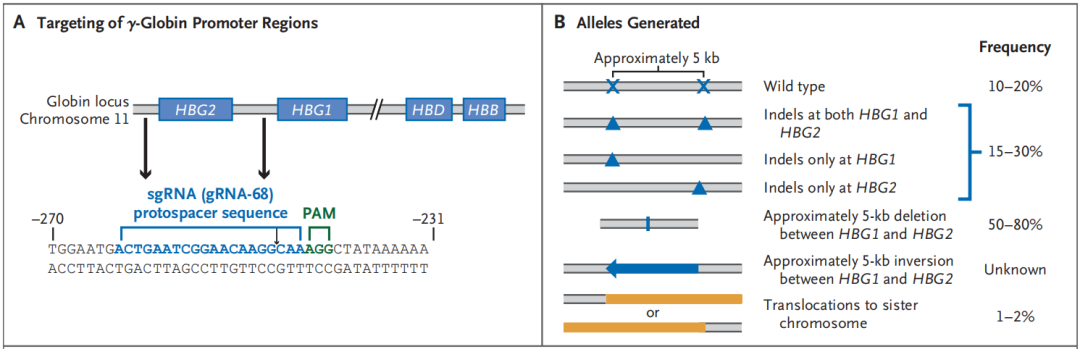
2023年8月31日,美国圣裘德儿童研究医院Akshay Sharma团队在国际知名医学期刊New England Journal of Medicine(IF=159)在线发表题为“CRISPR-Cas9 Editing of the HBG1 and HBG2 Promoters to Treat Sickle Cell Disease”的研究论文,该研究表明CRISPR-Cas9编辑HBG1和HBG2启动子能够治疗镰状细胞病。在临床前实验中,用CRISPR-Cas9和gRNA-68编辑的CD34+ HSPCs(来自健康供体和镰状细胞病患者)在体外分化或异种移植到免疫缺陷小鼠后,能够持续进行靶编辑,没有脱靶突变,并产生高水平的胎儿血红蛋白。
在这项研究中,三名参与者在清髓调节后接受了自体OTQ923,随访6至18个月。随访结束时,所有受试者均植入并稳定诱导了胎儿血红蛋白(胎儿血红蛋白占总血红蛋白的19.0 ~ 26.8%),胎儿血红蛋白广泛分布于红细胞中(F细胞占红细胞的69.7 ~ 87.8%)。在随访期间,镰状细胞病的表现有所减少。该研究表明,CRISPR-Cas9破坏HBG1和HBG2基因启动子是诱导胎儿血红蛋白的有效策略。对3名患有严重镰状细胞病的患者输注自体OTQ923,导致红细胞胎儿血红蛋白持续诱导,疾病严重程度的临床改善。

镰状细胞病是一种常染色体隐性遗传病,由编码成人血红蛋白β-珠蛋白亚基(α2β2)的HBB基因突变引起最常见的镰状细胞病突变导致纯合子p.Glul6val取代,导致镰状血红蛋白(α2β2)的产生镰状血红蛋白在低氧浓度下聚合,导致红细胞呈镰状、坚硬和脆弱,导致微血管闭塞、溶血和炎症。镰状细胞病患者有慢性贫血、复发性疼痛、进行性多器官损伤和早期死亡风险增加。镰状细胞病的症状出现在婴儿期,因为γ-珠蛋白基因(HBG1和HBG2)转录转换为β-珠蛋白(HBB),导致红细胞中从胎儿血红蛋白(α2γ2)转变为成人血红蛋白。
镰状细胞病的药物治疗,包括羟脲、输血和最近批准的药物(L-谷氨酰胺、克里赞单抗和voxelotor),只是部分有效。唯一潜在的治疗选择是异基因造血干细胞移植(HSCT),理想情况下,来自人类白细胞抗原(HLA)匹配的供体;只有不到20%的病人能接受这种手术。同种异体造血干细胞移植与免疫并发症相关,包括移植物排斥反应和移植物抗宿主病,在接受HLA不匹配供体移植的患者中,这种情况往往更严重。
诱导胎儿血红蛋白是治疗镰状细胞病的一种行之有效的策略。一种称为胎儿血红蛋白遗传持续性的自然发生的良性遗传状况,可导致出生后红细胞中胎儿血红蛋白水平的全细胞升高,从而改善共遗传镰状细胞病的症状。人类11p染色体上的β-珠蛋白基因簇中有5个同源的β样珠蛋白基因。编码ε-珠蛋白的HBE、编码γ-珠蛋白的HBG2 (Gγ)和HBG1 (Aγ)、编码δ-珠蛋白的HBD和编码β-珠蛋白的HBB依次位于染色体11p上,并在人类从胚胎到成年的个体发育过程中被先后激活。大约在出生时,红细胞的产生地点从胎儿肝脏转移到骨髓,这种转变与γ-珠蛋白(HBG1和HBG2)的产生转换到β-珠蛋白(HBB)的产生有关。因此,胎儿血红蛋白水平降低,成人血红蛋白(或镰状细胞病患者的镰状血红蛋白)水平升高。
CRISPR-Cas9可以提高胎儿血红蛋白水平,减轻镰状细胞病的症状。然而,破坏HBG1和HBG2启动子中的抑制因子比完全消除红细胞BCL11A表达更有针对性,因为后者可能损害红细胞生成。通过CRISPR-Cas9筛选,该研究在HBG1和HBG2启动子中发现了一个抑制元件。在临床前测试中,在破坏上,这种抑制元件引起F细胞诱导,其功效与破坏BCL11A红细胞特异性增强子相似。
向导RNA-68 (gRNA-68)编辑造血干细胞的分子方法和临床前表征(图源自New England Journal of Medicine )
三名接受单次输注OTQ923的严重镰状细胞病患者的总血红蛋白、胎儿血红蛋白和F细胞水平持续升高,血管闭塞危像的发生减少,未发现任何脱靶效应。在基因修饰CD34+选择移植物的预期时间框架内(18至26天),观察到转基因细胞的移植,编辑的HSCs向髓系或B细胞谱系的分化没有偏斜。T细胞在最初的几个月里进行了可变的编辑,这与未编辑的T细胞或来自编辑的造血干细胞的T细胞在输注后的扩增一致。在参与者1和2中,心脏、肺和肾功能在输注后12个月表现稳定或有所改善。这种器官功能的保存—至少在短期内—带来了希望,即这种疗法可以预防镰状细胞病引起的器官功能障碍。然而,骨坏死持续存在,甚至可能在治疗后恶化。虽然接触白消安可能导致骨骼健康恶化,但不能排除持续的镰状细胞病相关损伤。OTQ923治疗在清髓性磺胺和自体造血干细胞移植后的短期安全性与预期一致。
作者发现,Cas9对镰状细胞病患者的自体造血干细胞的HBG1和HBG2启动子负调控区的破坏,可诱导红细胞胎儿血红蛋白,并部分纠正镰状细胞病。在这项研究中,白消安被用作清髓剂,在大多数其他正在进行的研究中也是如此。然而,考虑到白消安的相关毒性,在未来的临床试验中应该评估替代药物,如降低强度的美法兰、替代降低毒性的烷基化剂。尽管这种转基因产品的长期疗效和安全性仍在评估中,但数据表明,这种方法为严重镰状细胞病患者提供了一种安全且有可能减轻疾病的选择。
原文链接:
https://www.nejm.org/doi/full/10.1056/NEJMoa2215643


