Nature:阐明人类mRNA解码机制,为癌症、感染新药研发打开新大门
时间:2023-04-15 14:15:37 热度:37.1℃ 作者:网络
核糖体是细胞中最基础的细胞器,即使是最原始的细菌也存在核糖体。在细胞中,核糖体是蛋白质的加工机器,负责将信使RNA(mRNA)编码的密码子信息一一解码为相应的蛋白质的氨基酸序列。
值得注意的是,核糖体除了影响蛋白质合成速率之外,还在细胞增殖、分化以及凋亡等过程中发挥重要作用。因此,一旦核糖体结构或功能发生异常将极大影响细胞命运,导致心血管系统疾病、神经退行性疾病、衰老以及癌症等等。
近日,美国圣裘德儿童研究医院的科学家们在 Nature 期刊发表题为:mRNA decoding in human is kinetically and structurally distinct from bacteria 的研究论文。
该研究表明,人类细胞中的mRNA解码在动力学和结构上与细菌不同,其速度仅为细菌核糖体的十分之一,但准确性更高。这些差异来自人类核糖体中的真核特异性结构和真核延伸因子1A(eEF1A),它们共同协调每个mRNA密码子上忠实的tRNA掺入,这解释了为什么真核生物的核糖体比细菌的核糖体在解码mRNA时更慢和更准确。这些发现将为癌症、细菌感染的治疗开辟新的道路。

在所有生物中,核糖体可以解码mRNA密码子信息,并将对应的氨酰-tRNA(氨基酸加载到tRNA上)掺入到肽链中。在人类中,解码保真度的变化与心血管疾病、衰老和癌症等疾病有关,代表着潜在的治疗干预靶点。
目前,关于核糖体解码机制的认知主要源自于对细菌系统的研究。值得注意的是,尽管某些关键特征在进化过程中是保守的,但整体而言,进化上更高等的真核生物比低等细菌实现了更高保真的mRNA解码。
在这项研究中,研究团队结合多视角单分子荧光共振能量转移(smFRET)成像和冷冻电镜(cryo-EM)技术,在体外重构了人类核糖体的蛋白质翻译过程,高时空分辨率地解析人类核糖体实现高保真解码的分子基础。
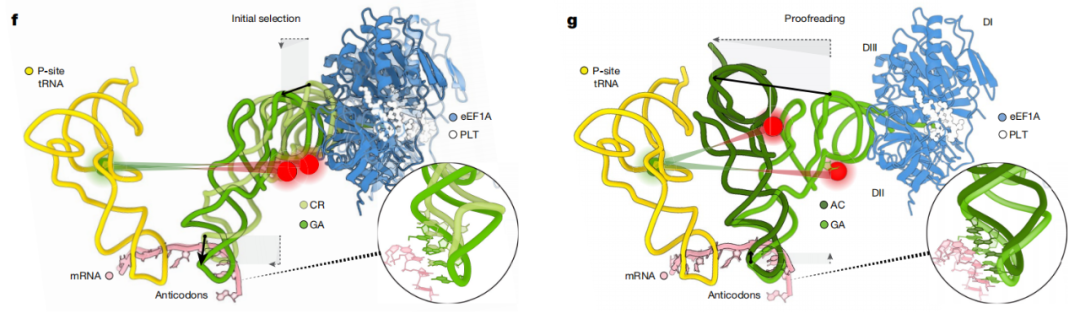
通过smFRET和cryo-EM解析人类核糖体mRNA解码过程中的结构动力学
首先,研究团队测定人类核糖体读取遗传密码子的速度,即多快能找到与mRNA互补的氨酰-tRNA。他们发现,与细菌核糖体相比,人类核糖体的这一过程要慢得多——大约有一个数量级(10倍)的差距。
具体来说,虽然人类和细菌的核糖体解码过程大体一致,但人类核糖体的高保真度是由快速可逆的SSU结构域闭合和滚动过程控制的,这与细菌核糖体不同。这些差异来自于人类核糖体和真核翻译延伸因子eEF1A中的结构元件的相互作用,其校对选择过程受到构象变化的限制,两者共同负责为每个mRNA密码子忠实地掺入、结合正确的氨酰-tRNA。
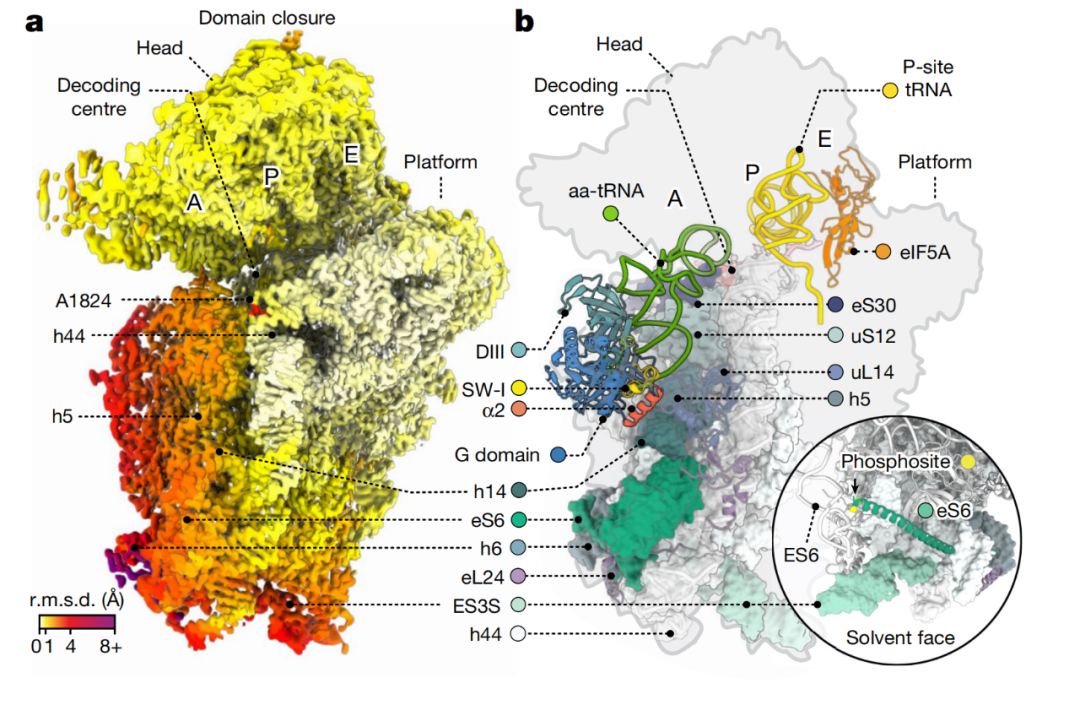
结构域闭合和初始三元复合物结合
研究团队表示,人类核糖体的解码机制在动力学和结构上都不同于细菌,人类核糖体和eEF1A内构象变化的独特性质和时间吻合解释了人类细胞是如何增加mRNA解码保真度的,并且该这一过程可能在所有真核生物中都是一致的。

在初始选择过程中的结构重塑
更重要的是,通过冷冻电镜结构研究,研究团队能够将人类核糖体结构解析到原子分辨率,揭示了人类核糖体中存在的rRNA和蛋白质修饰、离子和溶剂分子等前所未有的特征。这些特征可以很好地描述药物分子与人类核糖体相互作用的分子基础,对于基于人类核糖体的药物设计和新药发现是必不可少的。
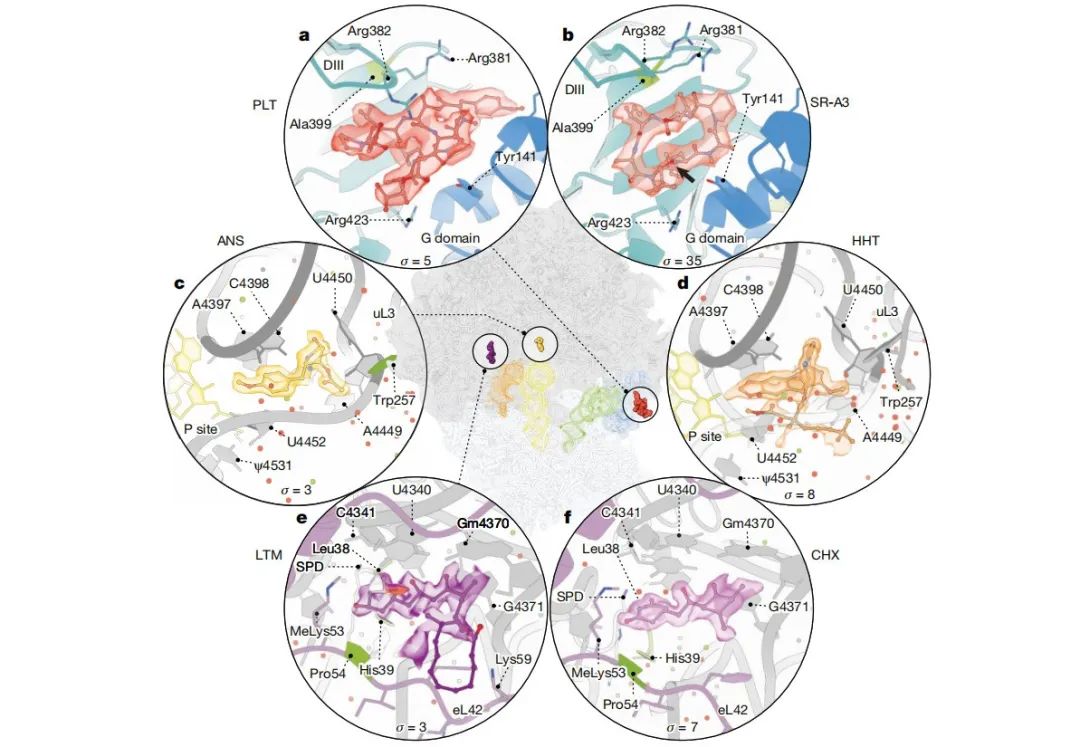
核糖体抑制剂的结合位点
总而言之,这项在 Nature 发表的研究表明,与细菌核糖体相比,人类核糖体的解码mRNA密码子的速度更慢,但准确性更高。这些发现揭示了核糖体解码所涉及的分子事件的时空协调,以及临床相关小分子药物靶向人类蛋白质合成的分子机制,为癌症、细菌感染的新药开发打开了大门。
原始出处:
Holm, M., Natchiar, S.K., Rundlet, E.J. et al. mRNA decoding in human is kinetically and structurally distinct from bacteria. Nature (2023). https://doi.org/10.1038/s41586-023-05908-w.


