胃超声在危重患者肠内营养指导中的作用
时间:2023-04-15 22:17:35 热度:37.1℃ 作者:网络
综述目的
早期开始肠内营养(EN)通常是不可行的,因为胃肠道功能障碍的患病率很高,这是危重症患者停止或延迟肠内喂养的主要原因之一。本文综述了胃超声作为危重患者肠内营养管理和监测工具的作用。
近期发现
用于诊断和治疗危重患者胃肠道功能障碍的超声膳食调节试验、胃肠道和尿路超声(GUTS)以及其他胃超声方案没有改变结果。然而,这种干预措施可以帮助临床医生做出准确的日常临床决策。横截面积(CSA)直径的动态变化有助于立即获得胃肠动力学结果,为启动EN、预测喂养不耐受(FI)提供有价值的指导,并有助于后续治疗反应。需要更多的研究来确定这些测试在危重患者中的完整范围和真正的临床附加值。
总结
使用胃护理点超声(POCUS)是一种无创、无辐射、廉价的方法。在ICU患者中实施超声膳食调节测试可能会成为确保危重患者早期肠内营养安全的一步。
背景
肠道营养(EN)对重症监护室(ICU)的患者至关重要,被认为是一种标准的管理。肠内营养的好处包括保护胃肠粘膜的结构和功能,减少对损伤的分解代谢反应,降低细菌移位的风险。由于胃肠道并发症的高发率和胃肠道功能障碍的高患病率,早期开始EN通常是不可行的,这是危重患者停止或延迟肠内喂养的主要不可避免的原因之一。
有几种方法可用于测量胃排空,大致分为直接或间接测试和替代评估。然而,这些方法具有侵入性、耗时、复杂,或者在床边不可行。胃残余容量(GRVs)用于鼻胃喂养期间的胃排空;然而,这些测量通常是不准确的,并且缺乏有力的证据表明GRV监测并不能避免并发症,至少在EN期间并发症的机械通气支持患者中是这样。GRV监测的最佳协议目前尚不清楚;因此,GRV监测的确切疗效和安全性仍有待确定。
胃超声是一种具有高灵敏度和特异性的非侵入性评估胃容量和内容物的有效工具。肠内喂养可导致高容量误吸,尤其是当与胃动力障碍、咳嗽不佳和精神状态改变有关时。它在术前急诊手术评估中的实施已被证明具有成本效益,降低了患者的发病率。目前,引起肺吸入风险所需的体积为0.8ml/kg,这已被公认为麻醉环境中胃吸入性肺炎或化学性肺炎风险的定义。然而,在一些随机临床试验中,研究不同的临界值或放弃GRV测量,尚未证实在重症监护环境中与不良结果的关联。此外,省略对GRV的监测导致ICU住院期间早期EN的提供显著增加,促动力药物的使用减少,胃肠道(GI)并发症减少。但有了这一说法,ICU环境中的肠内营养和喂养不耐受也有几个问题需要解决:监测、胃肠道功能与结果之间的关系、胃肠道机能与营养、胃肠道功能障碍的管理以及病理生理机制。目前关于胃肠道功能障碍的证据很少,部分原因是缺乏精确的定义。需要使用核心的监测和结果以提高未来研究的一致性。
本文综述了胃超声作为危重患者肠内营养决策和监测工具的作用。
胃超声
术前手术和危重患者的胃内容物和溶质的POCUS评估已被描述。胃超声的起源可以追溯到20世纪80年代,用于研究胃动力。其他研究人员利用胃超声来评估摄入液体后的胃排空情况。Van de Putte等人发表了应用床旁(POC)胃超声通过提供关于胃内容物类型和体积的床边信息来评估误吸风险评估。这种检查可以根据定性结果将空腹与含有清澈液体、粘稠液体或固体颗粒物的空腹区分开来。
根据Perla模型计算的胃容量由以下公式计算:
GV (ml) 1⁄4 27.0 þ 14.6 right-lateral CSA (cm2) 1.28age (years)
Perlas的方法可以预测0至500ml的体积,并适用于体重指数<40kg/m2的成年患者。胃超声定义的“危险胃”的概念是当胃体积超过1.5 ml/kg体重时,在胃窦水平测量。测量的误差范围为6ml。Kruisselbrink等人在40名健康志愿者禁食8小时后的胃超声模拟场景中,受试者被随机分配为保持禁食或摄入标准量的液体或固体。50%的预测试概率为100%的灵敏度和97.5%的特异性,阳性预测值为97.6%,阴性预测值为100%。Tan等人对117名胃容量>0.8 ml/kg的患者进行了研究,功能性消化不良和器质性消化不良的临界值分别为6.7 cm2和10.0 cm2。FD患者预测胃容量>0.8 ml/kg的临界值为6.7 cm2,敏感性为100%,特异性为48.7%。器质性消化不良患者预测胃容量>0.8 ml/kg的临界值为10.0 cm2,敏感性为92。特异性为82.4%。然而,它无法获得胃肠道动力学。
基于超声的胃动力学测量背景
1988年,一份出版物描述了通过在饭后定期测量胃窦横截面积(CSA)来评估胃排空的方法。在围手术期,研究表明,摄入碳水化合物饮料后的平均胃窦CSA并不低于接受选择性手术的禁食患者。这些研究表明,通过胃超声评估,与午夜禁食相比,在麻醉诱导前2小时摄入的碳水化合物饮料不会延迟胃排空。因此,当空腹时间最短时,胃超声对评估胃排空是有价值的。然而,在这些研究中,通过对Perla方法测量的胃容量含量的存在与否进行定性评估,而定量测量仅证明存在“危险胃”,也通过Perla的GV公式测量。
超声膳食调节测试是作为消化不良门诊患者评估方案的一部分而开发的。超声波膳食调节试验是一种临床膳食激发试验,用于评估胃调节、胃排空和内脏敏感性。在危重患者中,胃排空动力学是客观测量的。在患有FI和没有FI的受试者之间的超声膳食调节测试CSA测量中发现显著变化。
胃超声在重症监护中的应用
近年来,POCUS已被用于确认鼻胃管和胃肠道插管的位置。它还提供了对计算出的胃容量、胃肠动力和患者肌肉状态的无创评估,从而可以全面评估营养状况和EN疗效,并指导进一步的营养支持治疗计划的制定。
危重症肠内营养的胃肠超声方案
评估胃肠道完整性
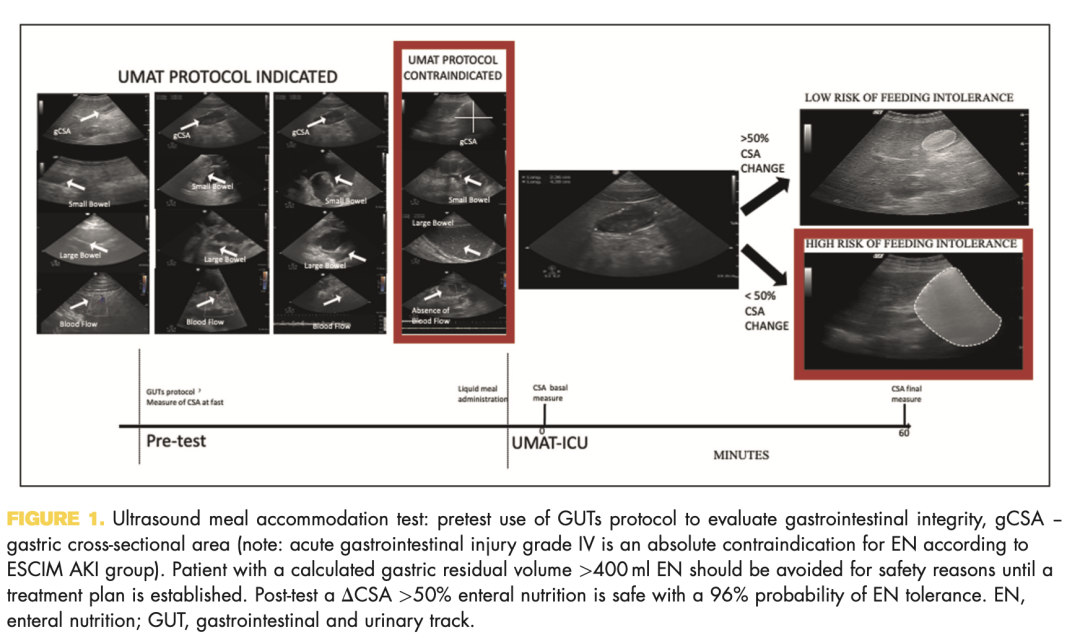
使用GUTS方案(胃肠道和泌尿道超声)(图1)与监测危重患者的胃肠道功能有关。GUTS方案侧重于四个胃肠道终点:胃肠道直径、粘膜厚度、蠕动,和血流(SMA超声有助于分析肠系膜上下血流,并提供几个可量化的参数,如搏动指数、阻力指数、收缩和舒张速度以及血流量,以评估来自内脏血管的信号)(图1)。这种POCUS成像技术提供了有关胃肠道的解剖和功能信息。最近的研究表明,GUTS与其他参数的效用,如胃肠道生物标志物、AGI分类和临床结果。
Lai等人通过CSA结肠直径、蠕动频率和其他指标对胃肠功能进行综合评估,以预测肠功能的恢复。他们发现,单独的CSA 9 cm2具有0.896的曲线下面积(AUC);结肠直径2.9cm,AUC为0.92;蠕动频率>3肠蠕动(BPM),AUC为0.845。此外,他们报告说,综合这三个指标可以反映胃肠功能的恢复。当CSA、结肠直径和蠕动频率相结合时,阳性预测值和AUC高于单一指标。此外,除了结肠直径-蠕动频率组合(P>0.05)外,差异具有统计学意义(P<0.001),表明只有直径和蠕动频率不能反映完整的胃肠功能。对于CSA 9 cm、结肠直径2.9 cm、蠕动频率>3 BPM的患者,开始肠内营养治疗,AUC为90.95,肠内营养疗法的耐受性为93.7%。作者得出结论,根据这些发现,在对胃肠功能进行全面评估后,可以更早开始肠内营养治疗,而不会出现并发症。胃肠道POCUS可以更好地评估胃肠道的损伤状态,可以更早地进行肠内营养治疗。
超声膳食调节检测
该方案有助于区分将发生FI的患者,并可提供适当治疗的指征(图1)。超声膳食调节测试是监测胃对膳食刺激反应的可行工具。超声膳食调节测试是在30度的头部高度对患者进行的。对于胃扫描,建议使用2–5 Hz的扇形探头。以肝脏左叶和腹主动脉为解剖参考点,获得上腹部的矢状面。在剑突下窗口进行超声测量,并确定基础CSA。采取这一措施是为了安全;如果发现胃有危险,应暂停测试。在给药500ml低蛋白液体餐(10g)用于2分钟内进行对比后,测量胃窦CSA的变化。第二项测量在60分钟后进行。在一项对61名患者、A组52名患者(85%)和B组9名患者(15%)进行的观察性研究中,我们发现52%的DCSA(餐后CSA测量和60分钟后CSA测量之间的差异)的敏感性为50%,特异度为88.9%,阳性似然比为4.50,阴性似然比为0.56。ICU患者进食耐受的前测概率为85%,后测概率为96%。
胃床旁超声在危重患者肠内营养指导中的价值
文献中对FI的定义描述不一致,但在危重成年人中很常见。FI最常被定义为存在胃肠道症状和GRV升高。FI的标准化定义对未来的研究和临床实践至关重要。然而,研究表明GRV与胃排空延迟的相关性很低,这项包括8项1585名患者的系统综述表明,GRV阈值与FI患病率之间没有相关性。其他在重症监护环境中预测GID和FI的尝试都未能预测FI,如腹内压值。尽管较高的腹内压(临界值>14mmHg)与EN不耐受有关,但在危重患者中,单独的腹内压力并不能很好地预测EN不耐受。到了广泛应用。最近的研究对危重患者常规监测GRV的合理性提出了质疑。随着超声波等无害监测技术在临床上的广泛应用,胃抽吸的使用可能越来越少。危重患者早期使用肠内营养对于维持胃肠功能是必要的。胃肠道功能障碍已经积累了对结果产生负面影响的证据。然而,尽管做出了几项努力将胃肠道功能整合到评分中,或者开发了用于这些设置的监测仪器,但似乎没有任何东西能够整合胃肠道的复杂性。在危重患者的肠内营养临床实践中,“一刀切”原则并不是一个最佳解决方案,因为ICU人群的异质性很大,胃肠道功能障碍的风险因素也很多。种监测GRV的方法都有优点和缺点。肠内营养的管理侧重于确定胃滞留的因素和触发因素。尝试从预防和消除误吸高危因素和分析病理生理机制的角度解决这一问题,消除所有负面阻碍因素,积极为肠内营养创造条件。需要注意肠内营养管理文化的持续改进,合理使用多样化的管理策略,这可能比监测GRV更重要。最近的研究引入了胃POCUS来评估和监测GRV以及麻醉和重症监护中的胃肠功能。POCUS可以帮助临床医生测量胃容纳液体食物的能力,观察胃排空和患者的症状反应。超声在重症监护环境中监测胃肠功能和功能障碍的潜在效用可能导致适当的治疗干预。总之,它们为胃肠道患者病情的动态成像提供了坚实的基础,并且可以获得比主观临床评估更有价值和更好的信息。
在EN期间,要实现的主要目标包括准确确认饲管位置、监测胃残余容量、评估胃肠动力和监测患者的营养状况。随着技术的快速发展,胃POCUS已成为监测接受EN的危重患者的一种更方便、更有效的技术工具。FI患者无呼吸机天数减少,ICU住院时间延长,一旦发生肠内喂养不耐受,每日死亡率增加1.5。胃肠道pocus可以为整合方案做出重大贡献,并帮助临床医生做出准确的日常临床决策。CSA直径的动态变化有助于立即获得胃肠动力学结果,为启动EN、预测FI提供有价值的指导,有助于跟踪危重患者的治疗反应,避免已知并发症。
在患者床边进行超声膳食调节检测可以降低支气管抽吸和营养不良的风险。通过超声膳食调节检测,胃评估的三大支柱,包括调节、排空和刺激敏感性,在一次测试中进行。临床医生可以测量胃容纳液体食物的能力,观察胃排空和患者的症状反应。最近的其他研究发现了胃POCUS和FI之间的相关性。Wang等人报道,胃窦回声密度的测量与AGI的更严重程度有关,并且通过鼻胃管开始肠内营养后胃窦回声浓度较高的患者更有可能发生FI。
局限性
到目前为止,使用超声膳食调节检测、GUTS和其他胃超声方案来诊断和治疗危重患者的胃肠道功能障碍并没有改变结果。胃POCUS依赖于用户。由于脂肪组织对超声声波的衰减,肥胖患者很难进行检查。腹部管腔内气体也会损害胃的可视性。
结论
使用POCUS胃超声是一种无创、无辐射、廉价的方法。在ICU患者中实施超声膳食调节测试可能是确保危重患者早期肠内营养安全的一步。需要进行更多的研究,以以患者为中心的角度确定该检测在危重患者中的完整范围和真正的临床价值。


