人类多能干细胞治疗:正在成长中的巨人
时间:2023-09-15 20:06:04 热度:37.1℃ 作者:网络
多能干细胞(Pluripotent Stem Cells, PSC),以胚胎干细胞(Embryonic Stem Cells, ESC)和诱导性多能干细胞(induced Pluripotent Stem Cells, iPSC)为代表。1998年首次报道人类ESC从囊胚期胚胎中分离出来,2007年首次报道人类iPSC获得成功。
多能干细胞的发现,已经彻底改变了干细胞研究和基于细胞的治疗,开辟了再生医学的新时代,特别是细胞治疗来替代丢失或受损的组织。多能干细胞逐渐被探索用于各种疾病和损伤的细胞治疗(如帕金森,脊髓损伤、年龄相关黄斑变性等)。关于临床应用,但ESC的伦理问题和免疫排斥反应问题凸显,使得iPSCs在疾病的治疗方面拥有更大的应用前景。
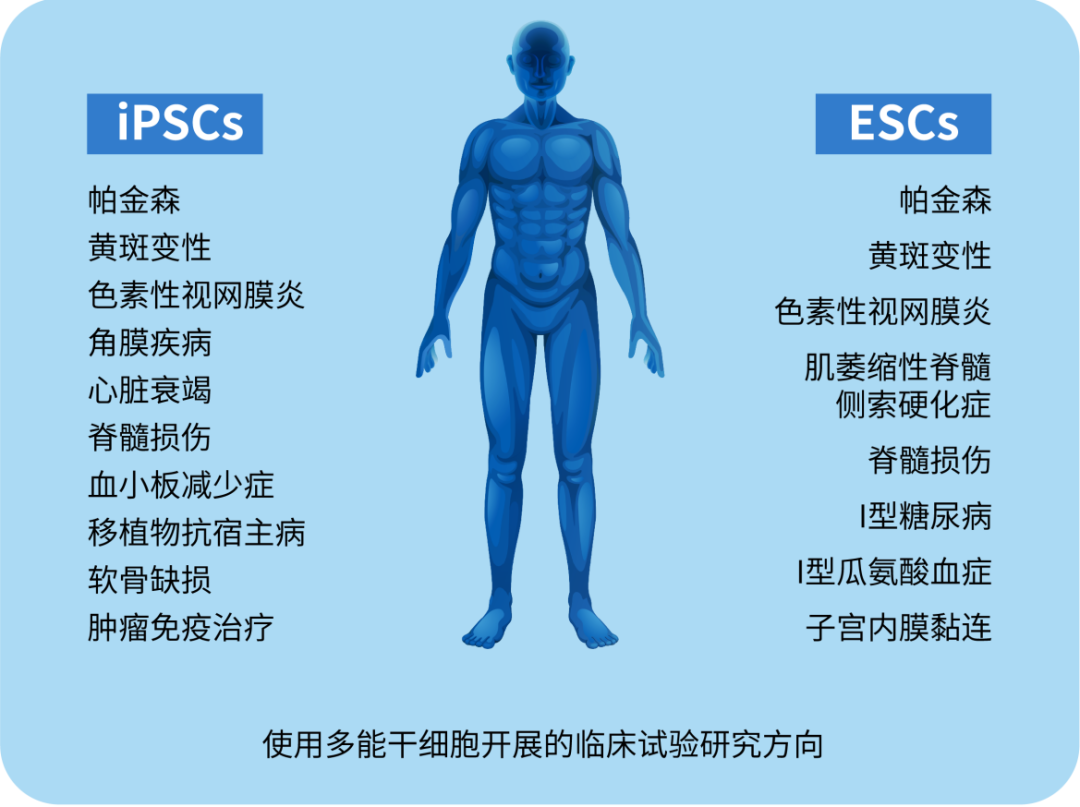
注:使用PSC进行细胞治疗的临床试验(来源于参考资料1)
-01-
多能干细胞的历史
多能干细胞属于可自我再生的细胞类型,具有分化为三个胚层各种细胞的能力。从历史上看,第一个多能细胞系是由人类生殖细胞肿瘤和小鼠未分化隔室建立的胚胎癌(embryonic carcinoma,EC)细胞系。尽管,EC细胞在体外是一种强大的工具,但由于其癌症来源和非整倍体基因型,这些细胞不适合临床应用。
1981年,科学家们建立了第一批小鼠胚胎干细胞。小鼠ESCs来源于胚胎着床前囊胚的内细胞团(ICM)。囊胚具有独特的生物结构,含有滋养层和ICM, 最终ICM发育成胎儿各个组织,滋养层细胞发育成胎盘和胎膜。在胚胎发育过程中,ESCs只存在很短的一段时间,而在体外,ESCs则可以未分化状态无限扩增。在过去的40年里,小鼠ESCs的发现极大地改变了生物医学研究和再生医学领域。
1998年,威斯康星大学麦迪逊分校的大佬詹姆斯-汤姆森(James Thomson)教授从囊胚期胚胎中分离出世界上第一株人类胚胎干细胞系,引发了全球媒体和伦理研究委员会的巨大争议,因为反对人类胚胎用于研究目的。使用hESCs的研究已经证明了它们在临床环境中的治疗潜力。关于临床应用,但hESC的伦理问题和免疫排斥反应问题凸显。
2006年,日本京都大学山中伸弥(Shinya Yamanaka)教授和他的学生兼助手高桥和利(Kazutoshi Takahashi)采用四种转录因子(Oct-3/4, Sox2, Klf4和c-Myc,称为OSKM),从小鼠体细胞中制备出第一批小鼠诱导多能干细胞。
2007年,Takahashi等人使用相同的OSKM因子成功制备出第一株人类诱导多能干细胞,具有与hESCs相似的分子和生物学特征。
从那时起,hiPSC被广泛研究,扩大了我们对许多疾病发病机制的认识,有助于我们开发新的细胞疗法和进行个性化医疗。
-02-
多能干细胞的临床应用
自从1998年第一株人类胚胎干细胞建系以来,多能干细胞的研究在再生医学、疾病建模、药物筛选和干细胞治疗方面取得了重大进展。在临床试验中,hESCs的使用依然受到伦理问题和严格监管的限制,有限的临床前数据支持其治疗潜力。不可否认的是,hESC在疾病的治疗方面取得一定的成功。
2012年,Steven Schwartz研究团队报告了第一个使用hESC来源的视网膜色素上皮(RPE)治疗Stargardt黄斑营养不良症的临床证据,这是一个干性年龄相关性黄斑变性患者。在RPE分化率大于99%的情况下,每例患者单眼视网膜下腔内注射5×10*4个RPE。由于分化RPE的hESC源暴露于小鼠胚胎干细胞,因此被认为是异种移植产物,需要较低剂量的免疫抑制处理。本研究表明,hESCs通过分化为功能性RPE而改善了患者的视力,没有任何严重的不良事件。
随后,开展两项I/II期临床试验,并于2015年发表了研究结果。在临床试验中,患者被分为三组,接受三种不同剂量的hESC-RPE,单眼10×10*4、15× 10*4和50×10*4个RPE细胞。随访22个月,19例患者视力改善,7例患者无改善,1例患者视力进一步下降。技术挑战在于给药后RPE的不平衡增殖,这个现象在72%的患者治疗后观察到。
在两名年龄性黄斑变性的韩国患者和两名患有Stargardt黄斑营养不良的患者中也进行了类似的方法。研究结果:证实了hESC-RPE细胞的安全性,有3例患者的视力有所改善。
最近,中国研究人员在无异种培养条件下也开发了临床级的hESC-RPE细胞,用于治疗湿性年龄相关性变性患者。
由于hESC的伦理问题和免疫排斥反应问题凸显,使得hiPSC-RPE细胞成为治疗黄斑变性的潜在细胞来源。虽然RPE分化方案已经得到优化,用以提高hiPSC-RPE细胞的疗效,但依然不足,耗时且费力。
为了临床应用,利用对FGF/MAPK信号通路的短暂抑制,利用无饲养层培养条件,开发了一种将“启动”到“naïve”状态的hiPSCs向RPE有效分化的方法。在整个分化过程中,hiPSC中特异性转录因子的过表达也是一种产生大量临床使用的RPE细胞的有趣方法。在最近研究中,三种转录因子(OTX2、PAX6和MITF)的过表达刺激了hiPSC向RPE的分化,产生了适合移植的功能性RPE细胞。迄今为止,尽管来自I/II期临床试验的报告数据已经足以支持hESC-RPE细胞的安全性,但仍处于不成熟阶段。
因此,未来的研究应着眼于RPE的细胞制造过程和视网膜下给药途径的发展,以进一步改善RPE制造和植入患者视网膜的效果。
大量研究表明,hESC衍生的心肌细胞表现出心脏转录因子,并表现出心肌细胞表型和未成熟的电表型。此外,使用hPSC来源的心肌细胞可以提供真正的再肌化和移植所需的大量细胞。因此,这些细胞可能是治疗人类心血管疾病的一种有希望的新治疗方法。
在一份病例报告中,hESC来源的心肌细胞在严重心力衰竭患者中显示出潜在的治疗效果,并没有出现任何后续并发症。这项是一项hESC-心肌祖细胞治疗重度心力衰竭中的1期试验,评估从hESCs-心肌祖细胞在纤维蛋白凝胶支架中的安全性,用于治疗10例重度心力衰竭患者(NCT02057900)。研究结果令人鼓舞;不仅证明hESC-心肌祖细胞达到临床级标准,并将其与组织工程支架结合可治疗严重心脏病(第一位患者已于2021年10月达到7年随访期)。
目前,两项使用hESC来源心肌祖细胞的临床试验正在进行中。值得关注的是,研究结果将为批准商业化铺平道路。第一项试验由HEARTSHEET® 的发明者之一,大阪大学的心脏外科医生 Yoshiki Sawa教授通过 iPSC制成心肌细胞薄片,用于治疗心力衰竭。目前,研究小组正在进行一项临床试验,以验证心肌细胞薄片治疗心力衰竭的安全性和有效性(jRCT2053190081)。临床适应症是缺血性心脏病,招募10个病人。
另一项临床试验使用基于胶原蛋白的构建物BioVAT-HF来包含hiPSC-心肌细胞。试验分为两部分来评估细胞剂量:(A部分)招募18名患者,(B部分)招募35名患者,以测试大范围的工程人心肌(EHM)剂量。这项临床试验预期结果将为EHM在刺激人类心脏再血管化方面的应用提供“概念证明”。迄今为止,尚未报告不良事件或严重不良事件,支持其安全性。遗憾的是,治疗患者数量相对较少,在有效性方面还不够充分。
2010年,Geron公司开展了首批基于多能干细胞治疗的临床试验之一,使用人类胚胎干细胞来源的少突胶质细胞祖细胞(OPC1)治疗脊髓损伤。临床结果:5名参与者在给药一年后安全性得到证实。磁共振成像显示:4名参与者的脊髓退化得到改善。Asterias biotheraptic(AST)通过开展SCi Star I/IIa期研究来继续Geron公司的研究,以评估AST- OPC1 (NCT02302157)的治疗效果。该试验的结果发表在clinicaltrials.gov上,结果显示跑步速度、前肢跨步长度、前肢纵向偏差和后肢跨步频率有显著改善。有趣的是,最近公布的一项多中心、非随机、单组、介入性的一期试验数据显示,没有证据表明神经功能衰退,患者在使用OPC1产品10年后出现肿物增大、脊髓进一步损伤或鼻咽形成。该数据集提供了可靠的证据,支持OPC1的安全性,无事件期长达10年,这加强了SCi Star试验的安全性。
对使用基于hPSC的治疗的临床试验的全球趋势的分析表明,77.1%的研究是观察性的(即没有给病人注射细胞),只有22.9%的研究使用hPSC来源的细胞作为介入性治疗。
使用hiPSC的研究数量相对高于使用hESCs的研究数量,分别为74.8%和25.2%。大多数观察性研究在欧美国家进行,包括美国(41.6%)和法国(16.8%),而大多数干预性研究在亚洲国家进行,包括中国(36.7%)、日本(13.3%)和韩国(10%)。就目标疾病而言,也很明确。研究最多的三种疾病是眼科疾病、循环系统疾病和神经系统疾病。
令人惊讶的是,自全球首次发现hESC以来,多能干细胞的临床应用几乎没有取得进展。专注于使用iPSCs作为治疗药物的临床试验数量相对较少,这可能归因于iPSCs基因组不稳定、免疫排斥和肿瘤形成的可能性。
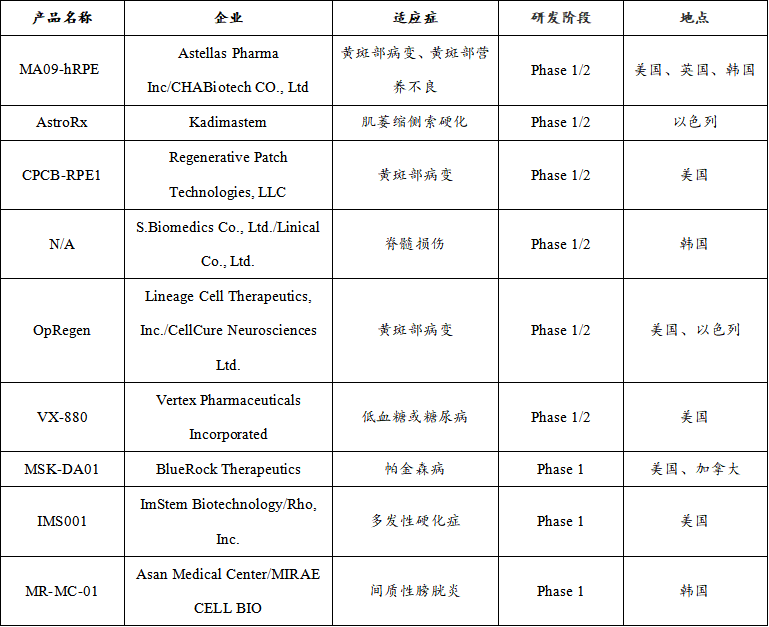
治疗性ESC注册临床产品
治疗性iPSC注册临床产品
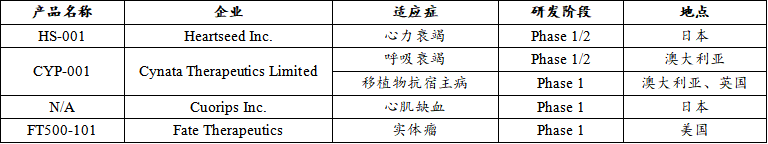
从治疗的疾病种类来看,iPSC与ESC的注册临床试验涉及多种适应症,包括I型糖尿病、黄斑变性、帕金森病、脊髓损伤等。9款治疗性ESC注册性临床产品中,眼科疾病(33%)以及神经系统疾病(45%)为主要的研究领域,另外也有针对内分泌系统(11%)以及泌尿系统(11%)的治疗性研究。4款治疗性iPSC注册性临床产品中,心血管疾病(40%)占较大的比例
小结和展望
我们概述了日本使用基于iPSC进行的临床试验。虽然iPSC仍然面临诸多挑战,但仍不能阻挡其在细胞治疗和其他应用方面的巨大潜力。大量的科学家仍然持续在这一领域进行努力耕耘,不断克服剩余的障碍。
近年来,国内基于iPSC治疗的企业也如雨后春笋般兴起,如呈诺再生医学科技、霍德生物、睿健医药等纷纷申请开展IND或IIT,开始各种尝试,探索中国的iPSC治疗。在不久的将来,基于iPSC的细胞治疗技术将成为一项真正的临床选择,在全球范围内为病人带来福音。
参考资料:
[1] Current status and future directions of clinical applications using iPS cells—focus on Japan[J]. The FEBS Journal.
[2]Mandai M, Watanabe A, Kurimoto Y, Hirami Y,Morinaga C, Daimon T, Fujihara M, Akimaru H,Sakai N, Shibata Y et al. (2017) Autologous inducedstem-cell–derived retinal cells for maculardegeneration. N Engl J Med 376, 1038–1046.
[3]Japan Agency For Medical Research and Development(2019) Team performs the world’s fifirst transplant usingcorneal epithelial cell sheets from iPS cells, 20190829.
[4]Doi D, Magotani H, Kikuchi T, Ikeda M, HiramatsuS, Yoshida K, Amano N, Nomura M, Umekage M,Morizane A et al. (2020) Pre-clinical study of inducedpluripotent stem cell-derived dopaminergic progenitorcells for Parkinson’s disease. Nat Commun 11, 3369.
[5]Osada H, Ho WJ, Yamashita H, Yamazaki K, IkedaT, Minatoya K & Masumoto H (2020) Novel deviceprototyping for endoscopic cell sheet transplantationusing a three-dimensional printed simulator. RegenTher 15, 258–264
[6]Nakamura S, Sugimoto N & Eto K (2020) Ex vivogeneration of platelet products from human iPS cells.Inflflamm Regen 40, 30.
[7]Yamada D, Iyoda T, Vizcardo R, Shimizu K, Sato Y,Endo TA, Kitahara G, Okoshi M, Kobayashi M,Sakurai M et al. (2016) Effificient regeneration ofhuman Va24+ invariant natural killer T cells and theiranti-tumor activity in vivo. Stem Cells 34, 2852–2860.
[8]Japan Agency For Medical Research and Development(2020) Clinical trial with human ES cells for congenitalurea cycle disorder, 20200521
Pluripotent Stem Cell-Based Cell Therapy—Promise and Challenges. Shinya Yamanaka. Cell Stem Cell 27, October 1, 2020


