Nature子刊:浙江大学陈鸣宇/蔡秀军/顾臻等开发新的纳米颗粒,用于胆囊癌的深层肿瘤光动力治疗
时间:2023-09-20 17:10:30 热度:37.1℃ 作者:网络
深部肿瘤的光疗仍然存在许多障碍,例如近红外(NIR)组织穿透深度有限和靶点内积累效率低。
2023年9月14日,浙江大学陈鸣宇、蔡秀军、顾臻及Win Topatana共同通讯在Nature Communications 发表题为“Pre-activated nanoparticles with persistent luminescence for deep tumor photodynamic therapy in gallbladder cancer”的研究论文,该研究报道了具有持续发光的刺激敏感肿瘤靶向光动力纳米颗粒(STPNs)用于治疗深部肿瘤。
紫红素18(Pu18)是一种卟啉衍生物,可作为光敏剂在stpn中产生持久发光,而镧系掺杂上转换纳米粒子(UCNPs)具有生物成像特性和高光稳定性,可增强光敏剂的效果。
STPN在静脉给药前最初受到NIR照射的刺激,并在肿瘤部位积聚,通过HER2受体进入细胞。由于Pu18余辉发光特性,STPNs可以连续产生ROS来抑制NFκB核易位,导致肿瘤细胞凋亡。
此外,STPNs可以通过MRI和术中NIR导航用于诊断目的。STPNs优异的抗肿瘤特性结合了UCNPs和持续发光的优点,代表了深部肿瘤的光疗策略。

胆囊癌(GBC)是一种根深蒂固的恶性肿瘤,早期症状不明显。大多数GBC患者被诊断为晚期,5年生存率为<5%。虽然手术切除是GBC最有效的治疗方法之一,但超过60%的患者在5年内复发。常规化疗和放疗无法延长复发或晚期GBC患者的生存期。因此,必须为GBC制定有效的诊断和治疗策略。
光动力疗法(PDT)因其卓越的治疗效果而作为癌症的非侵入性治疗选择引起了越来越多的关注。它经常用于治疗浅表疾病或癌,然而,由于NIR的组织穿透深度有限,无法到达肿瘤部位激活光疗剂,因此对深部肿瘤的抗肿瘤治疗效果不足。尽管已经有几项研究报道通过将波长从NIR-I扩展到NIR-II来提高穿透深度,GBC等深部肿瘤的治疗需要超过4厘米的难以穿透的深度,这对于NIR介导的治疗仍然具有挑战性。
持续发光是一种无光激发模式,由材料内能量陷阱中逐渐释放光子引起的,这可能是一种有前途的非侵入性抗肿瘤光疗方法,超越了上述NIR渗透的限制。据报道,几种有机复合材料、无机金属化合物、金属有机骨架和聚合物具有持续发光。卟啉衍生物,如紫红素18(Pu18),在先前的研究中经常被用作光敏剂,而最近的研究表明,卟啉衍生物在激发光停止后也表现出固有的持续发光。激发后,Pu18将吸收的能量转化为氧气以获得单线态氧(1O2)生成,然后氧化乙烯键(C=C)以产生Pu18-二氧烷中间体。Pu18-二氧杂环丁烷的自发分解可以传递足够的能量激发Pu18,Pu18通过余辉发光的发射进一步返回到其基态。有趣的是,当掺杂了Pu18的镧系离子的上转换纳米粒子(UCNPs)掺入后,研究发现在980 nm激光照射停止后,有持续的近红外发光。这结合了UCNPs和持续发光的优点,为生物成像(MRI、CT等)和诊疗科的生物医学应用提供了一种新的策略。
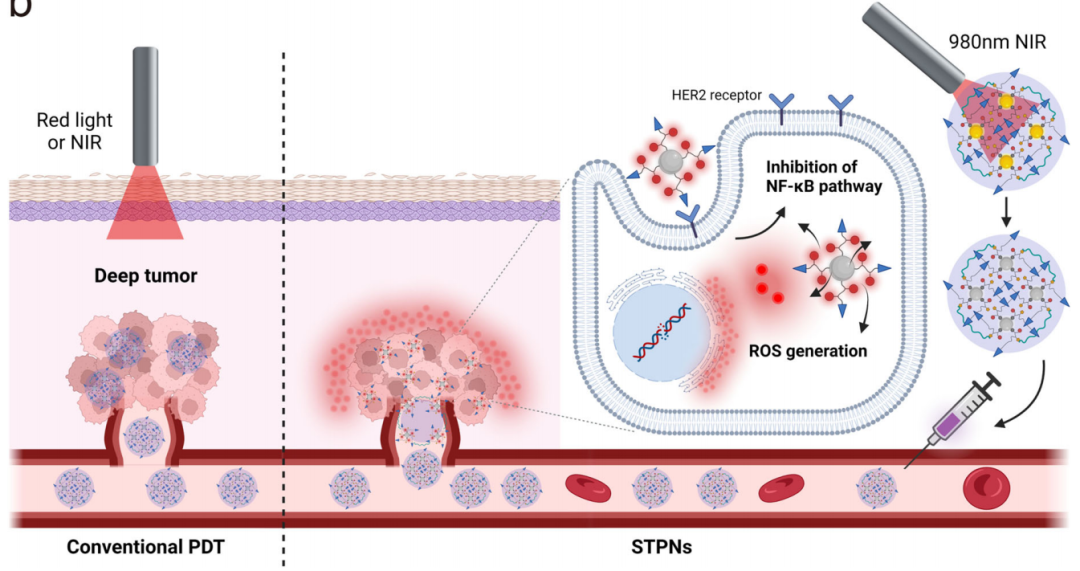
深部肿瘤光疗中STPNs激活示意图(图源自Nature Communications)
该研究开发了刺激敏感的肿瘤靶向光动力纳米粒子(STPN),用于HER2靶向胆囊癌的治疗,STPN由UCNPs、刺激响应性聚合物配体(SPLs)和曲妥珠单抗(TZB)组成。STPN可以聚集在GBC细胞膜上并通过HER2受体内化。由于UCNPs产生的二次激发能量和卟啉衍生物的持续发光,STPN可以在静脉内给药前通过980nm激光照射激发。在生理条件下(pH 7.4),聚集在STPN中的光敏剂是自猝灭的,缺乏可检测的光活性。
进入酸性肿瘤微环境(TME)后,STPNs分解成分离的UCNP,然后UCNPs的上转换发射光可以诱导Pu18的光活性产生活性氧(ROS)用于抗肿瘤治疗。此外,由于UCNP中掺杂了顺磁性钆(Gd),STPN具有作为MRI造影剂的潜力。综上所述,该研究表明STPNs具有优异的抗肿瘤特性,在体外和体内均具有高治疗选择性和出色的深部组织渗透性。
参考消息:
https://doi.org/10.1038/s41467-023-41389-1


