Hepatology:ADAR1-GLI1编辑驱动的增强线粒体吞噬在HCC中的价值
时间:2023-09-22 11:13:02 热度:37.1℃ 作者:网络
肝细胞癌(HCC)是原发性肝癌的主要组织学亚型,全球发病率高、预后差。细胞多样性,特别是肿瘤内异质性是决定HCC治疗失败的重要因素。有证据表明,癌症干细胞(CSCs)在异质性肿瘤细胞的分层组织中起着关键作用。CSCs是肿瘤块中的一小部分细胞,具有干细胞特征,如自我更新和分化能力以及对各种疗法的抗性。这一概念也得到了众多研究的支持,这些研究描述了肝脏CSCs(LCSCs)在治疗抵抗和肿瘤复发中的作用。研究表明,LCSCs内在地表达干细胞样标志物和转录调控因子(如CD133、CD44、CK19、NANOG和SOX9),而分化因子(如ALB、CK8、CK18、G6PC、CYP1A2和HNF4A)表达较低。LCSC标志物的富集与HCC的恶性进展和不良预后密切相关。尽管LCSCs非常重要,但阐明其在肿瘤微环境(TME)中维持和生存的关键特征和机制以及开发针对这些细胞的潜在临床应用方案仍然是一个重大挑战。
最近的数据表明,RNA编辑通过微调的转录后机制,使干细胞保持平衡和对环境压力作出反应。将腺苷脱氨为肌苷(A-to-I)是哺乳动物中最常见的RNA编辑事件类型。当编辑发生在重新编码的外显子中时,产生的肌苷随后被读作鸟苷,引起A-G的转录后变化和转录组的多样性。这种RNA修饰主要是由作用于双链RNA(ADARs)的腺苷脱氨酶催化的。其中,ADAR1的异常活性与多能性的发展和细胞命运的决定、造血祖细胞的存活、肠道的平衡和干细胞的维护有关系。到目前为止,只有少数编辑事件在实体瘤中被发现。以前的研究已经证明,由ADAR1激活赋予AZIN1的重编码RNA编辑是HCC复发和进展的关键。然而,ADAR1在调节LCSCs中的RNA编辑方面的作用,作为一种管理自我更新的表观转录机制仍然没有得到探索。

近日,发表在Hepatology杂志的一项研究使用生物信息学和功能策略探讨了ADAR1-协调HCC干性的分子机制,为进一步明确疾病进展的机制及病理生理提供参考依据。
RNA-seq分析确定了HCC中ADAR1响应的重编码编辑事件,并显示GLI1的编辑频率而不是转录本丰度在临床上是相关的。阐明了野生型(GLI1 wt)和编辑型GLI1(GLI1 R701G)在LCSC自我更新和肿瘤侵略性方面的功能差异。我们表明,过度编辑的GLI1诱发了精氨酸到甘氨酸(R701G)的替换,增强了肿瘤的启动潜力,并表现出更多的侵略性表型。GLI1 R701G与SUFU的亲和力较弱;这反过来又促进了其细胞质到核的转移,通过增加多能基因的表达来支持LCSC的自我更新。此外,编辑容易通过废除β-TrCP-GLI1的相互作用而使GLI1稳定下来。单细胞转录组的整合分析进一步揭示了在ADAR1富集的LCSCs中过度激活的有丝分裂。GLI1编辑促进了代谢转换到氧化磷酸化(OXPHOS),通过PINK1-Parkin介导的有丝分裂吞噬来控制HCC的压力和干性状态,从而赋予了HCC独有的转移和抗索拉非尼能力。
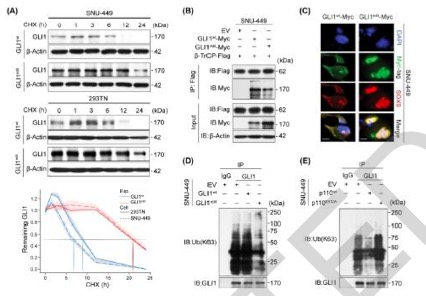
图 RNA编辑导致了对β-TrCP依赖性降解的抑制。(A)在GLI1wt-和GLI1edit-SNU-449细胞中,用环己酮(CHX,10μM)处理阻断蛋白质翻译,在指定的时间内用免疫印迹法监测GLI1水平。GLI1的半衰期为小时,通过密度测量法计算细胞的半衰期(n = 3)。(B)SNU-449细胞根据面板上的标签进行转染。用抗Flag免疫沉淀裂解物,并按指示进行免疫印迹(n = 2)。(C)用指定的抗体对GLI1wt-和GLI1edit-SNU-449细胞的GLI1和SOX9细胞定位变化进行免疫荧光分析(n = 2)。(D和E)用慢病毒EV、GLI1wt或GLI1edit(D)和EV、ADAR1p110wt或ADAR1p110E912A(E)转导的SNU-449细胞,用MG132(10μM)处理6小时。对指定品系的裂解液进行K63特异性GLI1结合并通过免疫印迹进行分析(n = 2)
本项研究结果表明,在高度异质性的HCC中,ADAR1通过编辑GLI1作为LCSCs特性的积极调节器,并发挥了新的作用。
原始出处:
Jie Luo,Lanqi Gong,Yuma Yang,et al.Enhanced mitophagy driven by ADAR1-GLI1 editing supports the self-renewal of cancer stem cells in hepatocellular carcinoma.DOI:10.1097/HEP.0000000000000299


