【佳作分享】斯坦福大学Sai G.等人Nature论文:重启癌细胞凋亡新技术,开启治疗癌症新思路
时间:2023-09-27 14:15:12 热度:37.1℃ 作者:网络
癌症是一种生物疾病,其特征是协调致癌作用的遗传因素与环境因素之间的复杂相互作用。现有的靶向癌症化疗方法依赖于抑制或降解蛋白质,或阻止RNAi或CRISPR(或CRISPRi)合成蛋白质,但这些方法通常会引起基于机制的毒性。斯坦福大学Sai Gourisankar等人针对这一问题,发现了一种癌症化疗的新方法,即通过利用癌细胞的内在驱动途径并重新连接它们来激活细胞死亡途径,这种方法类似于遗传学上的显性功能获得突变。他们描述了一类名为转录/表观遗传邻近化学诱导剂(transcriptional/epigenetic CIP, TCIP)的新分子,这类分子可以借助癌细胞内癌症生长基因的表达激活细胞凋亡,且毒性低微、靶向性强。该项研究工作果近日发表在Nature期刊上(Nature 620, 417–425 (2023))[1]。
癌细胞能够不停增殖,其原因就在于它屏蔽了诱导其凋亡的信号。但这种细胞凋亡途径仍然存在,只是在某些类型的癌症中被主动阻断:转录因子BCL6与凋亡基因的启动子结合,并通过表观遗传机制抑制它们的表达。在这项研究中,来自斯坦福大学的研究人员使用化学诱导临近(CIP)的概念来改变BCL6的转录作用。CIP核心原理即细胞调节通常涉及两种不同蛋白质相互靠近的诱导机制。
近年来,这一过程也被改造、开发应用于基础研究和临床治疗,已成功运用CIP原理设计出了诸如PROTAC(蛋白降解靶向嵌合体)等临近诱导分子。从这一点来看,利用CIP重新激活细胞凋亡以杀死癌细胞也是切实可行的。
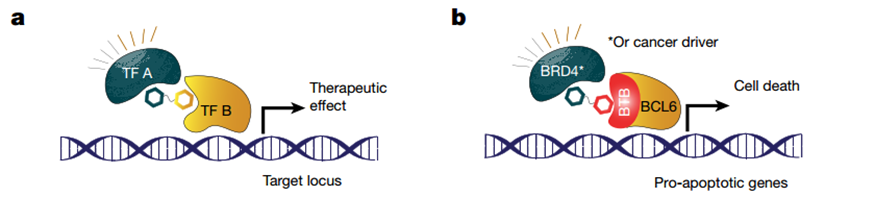
图1 TCIP1生成模式图
来自斯坦福大学的研究人员根据CIP原理设计了第一个TCIPs:TCIP1。他是一种二聚体小分子化合物,其一端为BCL结合分子,另一端为BRD4结合分子。TCIP1可以结合BRD4、BCL6形成了功能增益三元复合体。BRD4是一种转录调节因子,它在癌细胞中的正常活性是促进癌细胞的快速生长和增殖。当与 BCL6 连接在一起时,BRD4 将激活癌细胞试图用 BCL6 抑制的凋亡基因,使癌细胞能正常凋亡。实验表明,该复合体在多个弥漫性大B细胞淋巴瘤(DLBCL)细胞系中均能在72 小时内杀死50-95%的细胞,包括耐化疗的DLBCL细胞系KARPAS422,并表现出细胞特异性和组织特异性效应。
此外,TCIP1使用“功能增益”机制,只需要招募少量的BRD4就能产生对所观察到的BCL6靶标的强大激活。TCIP1借用总BRD4的一小部分,将其招募到BCL6结合位点和BCL6调节的基因,并迅速激活转录延长和这些靶基因的表达。
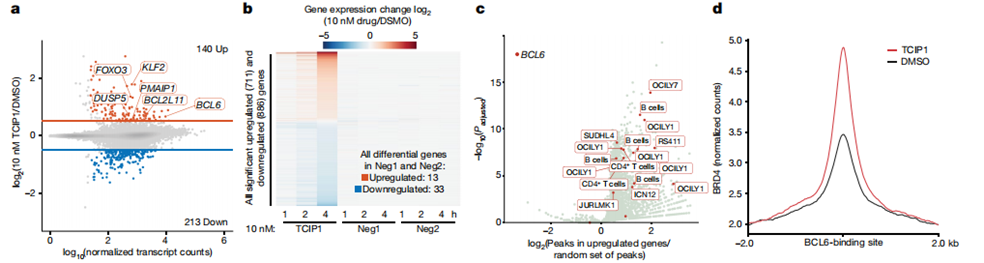
图2 TCIP1通过招募BRD4快速激活BCL6靶基因
除上调肿瘤抑制基因的表达外,研究团队还发现TCIP1降低了MYC及其靶点的表达水平。实验发现,单独加入TCIP1后MYC表达水平下降的不明显,化学对照Neg1和Neg2在可比浓度下不影响MYC水平。而BET/BRD4抑制剂如JQ1可以减少MYC25的表达,但药物水平(500 NM)比TCIP1高得多。这表明促凋亡靶点的激活和MYC的抑制都是由BRD4、TCIP1和BCL6之间形成的三元复合体介导的。另外,研究团队对TCIP1的潜在毒性也进行了实验探索,评价了TCIP1在野生型C57BL/6小鼠体内的耐受性、药代动力学特性和靶向结合,发现TCIP1耐受性良好,没有发现不良反应。
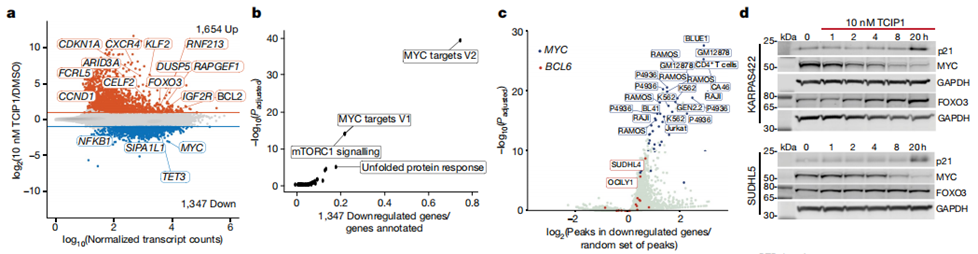
图3 TCIP1在激活促凋亡基因的同时抑制MYC及其靶点
小结:TCIPs只依赖于内源转录因子和表观遗传修饰物,具有内在的生物特异性,并捕捉到转录调控因子的组合使用。小分子TCIP对内源基因的激活可能会在生物学和医学的许多其他领域得到应用。例如,TCIPs可用于激活衰老细胞中的死亡途径,激活治疗性或单倍体缺陷基因的表达,激活人类免疫治疗中新抗原的表达,或用于合成生物学应用中调节细胞或生物体中的基因表达。这项研究展示了二聚体小分子化合物TCIP1作为弥漫性大B细胞淋巴瘤(DLBCL)乃至更广泛癌症类型的治疗潜力。
参考文献
[1] Gourisankar, S., Krokhotin, A., Ji, W. et al. Rewiring cancer drivers to activate apoptosis. Nature 620, 417–425 (2023).


