Cancer Biol Med:邱录贵教授:多发性骨髓瘤免疫治疗的新机会和新希望
时间:2023-10-05 14:18:34 热度:37.1℃ 作者:网络
多发性骨髓瘤免疫治疗
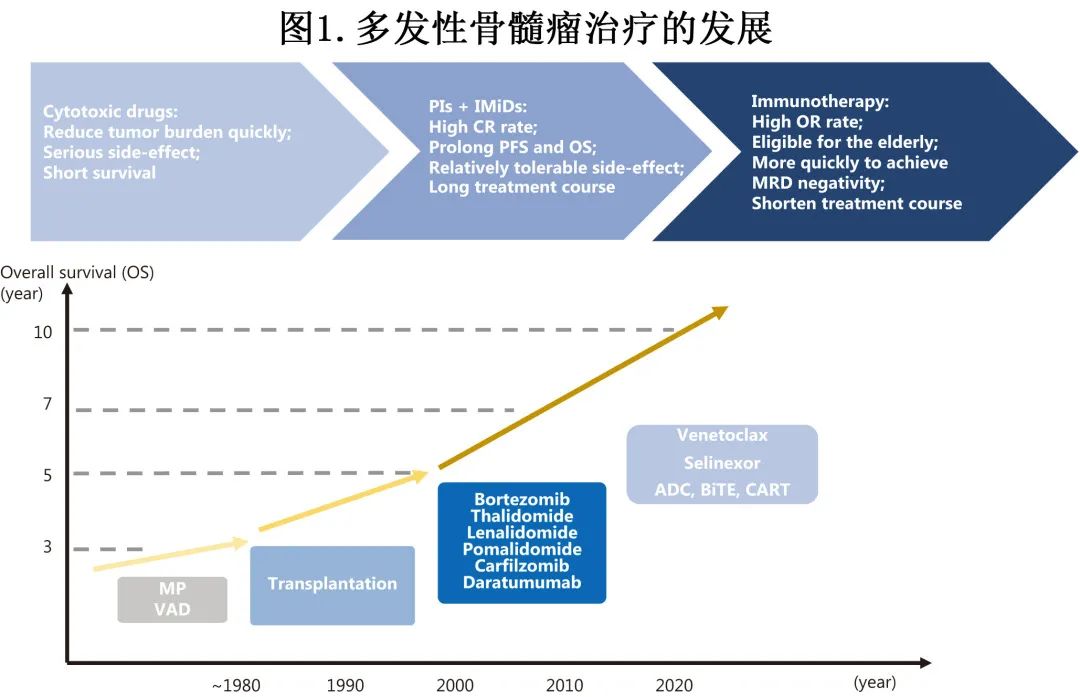
多发性骨髓瘤 (MM) 仍无法治愈,其治疗主要目的是获得微小残留病 (MRD) 阴性和实现持续疾病控制,这两者是延长 MM 患者生存期和改善预后的重要策略。含蛋白酶体抑制剂(PI)和免疫调节剂(IMiD)的三药诱导后行自体造血干细胞移植(ASCT)及维持治疗是MM的标准治疗。硼替佐米/来那度胺/地塞米松 (VRD)方案可获得高达89.9%的≥非常好的部分缓解(VGPR)率,中位总生存期(OS)超过10年。其他新一代PI和IMiD同样可获得优异疗效。
然而,大多数患者最终会发生疾病进展,以免疫逃逸和对标准治疗抵抗为特征,而肿瘤环境 (TME) 在这一过程中起重要作用。近年来开发了多种靶向肿瘤细胞和 TME 的新型免疫治疗方法,从而为 MM 患者提供了新的机会和希望,尤其是既往接受过多线治疗的患者。
《Cancer Biology & Medicine》近日发表一篇综述,描述了免疫治疗的最新进展及其在旨在实现持续性 MM 控制的治疗策略中的临床应用(治疗发展见图1)。第一作者为中国医学科学院血液病医院许婧钰博士,通讯作者为邱录贵教授。

免疫治疗
多种免疫治疗方法已在MM的临床试验中取得了显著的效果,包括单克隆抗体 (mAb)、嵌合抗原受体 (CAR)T 细胞疗法、双特异性 T 细胞衔接器 (BiTEs) 和抗体药物偶联物 (ADC)。还有一些新型非细胞免疫治疗,如CELMoD、免疫细胞因子、免疫毒素和 NK 细胞激活剂/衔接器。本文就细胞免疫治疗进行综述。
mAb
mAb 治疗主要靶向恶性浆细胞 (PC) 表面表达的抗原。CD38 不仅在 PC 表面高表达,还在免疫抑制细胞(如Bregs、Tregs和髓源性抑制细胞)表面高表达,因此靶向 CD38 可缓解免疫抑制微环境。达雷妥尤单抗是一种全人源免疫球蛋白G1-κ (IgG1-κ) 抗体,是 MM 治疗中给予的首个 CD38 抗体,达雷妥尤单抗为基础的治疗方案可增加新诊断多发性骨髓瘤 (NDMM) 和复发难治 MM(RRMM) 的缓解深度和无进展生存期 (PFS)。重要的是,GRIFFIN研究已证实,在 VRD 基础上加用达雷妥尤单抗作为适合移植的 MM 患者的一线诱导治疗方案可增强获益。达雷妥尤单抗已被纳入 NDMM 的一线治疗。Isatuximab 是另一种IgG1-κ嵌合单克隆抗体,作用机制与达雷妥尤单抗相似,治疗 RRMM 也显示出良好的疗效。
Elotuzumab 是另一种靶向信号淋巴细胞活化分子 F7(SLAMF7) 的人源化 IgG 免疫刺激单克隆抗体,SLAMF7是一种在 MM 细胞和自然杀伤细胞表面高表达的糖蛋白。在临床研究中,未发现含Elotuzumab的联合治疗方案可增加 NDMM 治疗的疗效或生存期。然而,II期 ELOQUENT-3 研究显示,在 RRMM 患者中EPd较Pd可改善 PFS 和 OS。
CAR-T细胞治疗
B 细胞成熟抗原 (BCMA) 在恶性 PC 中比正常 PC 中更丰富。BCMA 被增殖诱导配体 (APRIL) 激活,其过表达通过诱导 MAPK 和NF-κB信号级联来增强 MM 细胞生长和存活。因此,BCMA在细胞增殖和耐药性中发挥重要作用,是 MM 免疫治疗的理想靶点。
目前有2种靶向 CAR-T 细胞的 BCMA 疗法 idecabtagene vicleucel (ide-cel) 和 ciltacabtagene autoleucel (cilta-cel) 已获得 FDA 批准,其在 RRMM 中取得了令人印象深刻的临床结果。KarMMa 研究揭示了 ide-cel 在多线治疗 RRMM 患者中的意外成功。而cilta-cel 2023年的最新更新显示82.5%的患者达到严格意义的完全缓解 (sCR),中位随访27.7个月时尚未达到中位 PFS 和OS。
GPRC5D 是一种在恶性 PC 和毛囊上表达的孤儿受体,是另一个候选靶点。在中国进行的 II 期研究中,GPRC5D CAR-T在 RRMM 患者(包括抗 BCMA CAR-T 细胞治疗后进展的患者)中显示出令人鼓舞的临床疗效,66%的患者获得≥CR,并且具有可控的安全性特征。
BiTE
双特异性抗体是双靶向抗体,可结合恶性肿瘤细胞和效应细胞表面的靶抗原,随后通过将 T 细胞重定向到肿瘤细胞而发挥抗肿瘤作用。目前,几乎所有 BiTE 中效应细胞上的靶抗原均为 T 细胞上的CD3,而肿瘤 PC 上其他常用的靶点包括BCMA、GPRC5D和CD38。目前正在进行临床试验的 BiTE 包括BCMA/CD3 BiTE,如 teclistamab 和elranatamab,以及 GPRC5D/CD3 BiTE talquetamab。
Teclistamab 在 RRMM 中显示出较高的深度和持久缓解率,在 MajesTEC-1 研究中 ORR 为63.0%,≥CR缓解率为39.4%。Elranatamab 的初步结果表明,在 RRMM 患者中具有可控的安全性特征和深度临床缓解,即使在既往 BCMA 靶向治疗后也是如此;该治疗正在 Magnetismm-1 研究中进行I期临床研究。在 MonumenTAL-1 临床研究中,已发现 talquetamab 在多治疗 RRMM 患者中可诱导显著缓解,且不良事件可控。
ADC
ADC 为 MM 患者提供了一种新的免疫治疗选择,其由3个主要成分组成:选择性识别癌细胞表面抗原的抗体、被称为有效载荷的小细胞毒性分子及连接抗体和有效载荷的化学连接体。多种 BCMA ADC 正在临床开发中,其中最有吸引力的为belantamab mafodotin,DREAMM-2研究表明其具有抗骨髓瘤活性且安全性特征可管理。然而,比较 belantamab mafodotin 单药治疗与泊马度胺+低剂量地塞米松的 DREAMM-3 研究失败,导致 belantamab mafodotin撤回 (NCT04162210)。
序贯治疗
对于 RRMM 患者,免疫治疗正日益成为首选治疗,即使患者在免疫治疗后疾病进展,改变靶抗原和免疫治疗方式仍可能是一种可行有效的选择。CARTITUDE-2(队列C)研究已在既往暴露于抗 BCMA ADC 和抗 BCMA BiTE 的 RRMM 患者中成功实现了cilta-cel序贯治疗,从而为优化结局和使多线治疗患者的获益最大化提供了新的希望和选择。BiTE 也是序贯免疫治疗的有效选择,在2022年 ASCO 年会上报告了 RRMM 患者暴露于其他 BCMA 靶向药物后接受 teclistamab 治疗的更新结果。然而,一项真实世界多中心数据分析显示,与既往无BCMA 靶向治疗 (BCMA-TT)的患者相比,在 ide-cel 前接受过BCMA-TT的患者的 PFS 和缓解较差;该效应在 BCMA-TT 和 ide-cel 治疗之间间隔<6个月的患者中尤其明显。
因此在序贯治疗中,临床医生需要了解相关因素,包括末线靶向治疗的持续时间较短和免疫治疗的间隔时间较长。总体而言,序贯治疗有利于延长患者生存期和结局,但关于免疫治疗疗程之间的间隔和免疫治疗方式的选择仍需要更多数据。
联合免疫治疗
尽管 CAR-T 在 RRMM 治疗中显示出显著疗效,但并非所有患者都获得应答,CAR-T治疗后缓解时间短和复发率高限制了患者的长期生存。因此临床研究越来越多地将免疫治疗整合到整体治疗系统(overall treatment systems)中,例如通过将其与常规治疗联合作为一线治疗。CAR-T的试验正在探索的主要领域包括:(1) 作为不适合移植的患者的选择;(2) 作为治疗后疗效不佳患者的补充挽救治疗;(3) 联合常规治疗和移植以改善预后。CARTITUE、KarMMa和 MagnetisMM 研究是最佳示例,如表1所示。CARTITUDE-2研究针对不同的目标患者设计,已在早期复发患者中表明了极好的结果,CR率超过90%。此外,在2022年 ASH 年会上报告了 KarMMa-2 队列 2a 和队列 2c 的有前景的结果,表明具有深度缓解和极佳的 MRD 阴性率。
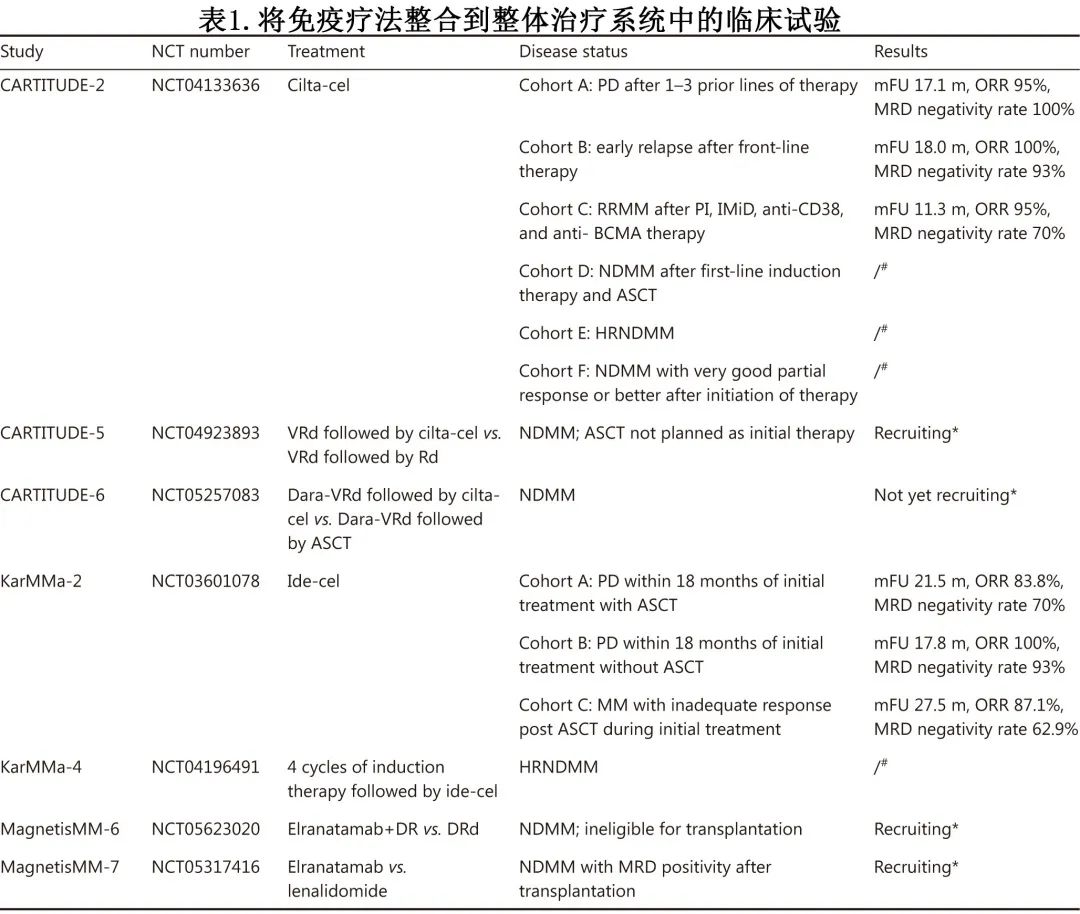
将免疫治疗与常规治疗相结合以达到大于组成治疗的累加效应仍存在挑战。在将免疫治疗纳入整体治疗系统时,必须考虑应用免疫治疗的时间和目标患者。MRD 阴性是最有力的预后指标之一,但仅有部分患者在 ASCT 或一线治疗后达到 MRD 阴性,且残留浆细胞对既往治疗方案易产生耐药性;因此整合多种治疗方案以帮助高危患者达到 MRD 阴性是延长其生存期的关键。因此,选择免疫治疗作为一线治疗或当患者未获得 MRD 阴性时给予免疫治疗,可能是增强治疗反应的合理选择。另一个目标群体是不适合移植或因年老体弱而无法耐受常规化疗不良反应的老年人;在这种情况下,免疫疗法是安全有效的,还可以缩短常规治疗的疗程,提高患者的生活质量。此外,其他高危浆细胞疾病,如浆细胞白血病和系统性轻链淀粉样变性也需要关注。
此外,在免疫治疗时代,ASCT的作用以及 ASCT 与免疫治疗的结合必须重新评估。多项研究表明,ASCT可增强 CAR-T 疗效。CAR-T 前应用 ASCT 可以降低骨髓中的肿瘤细胞,调节TME,清除阻碍 CAR-T 功能的免疫抑制因子。此外,ASCT后输注 CAR-T 细胞可以进一步清除残留的肿瘤细胞,从而延长PFS。ASCT 联合 CAR-T 的方案在几项临床研究中均产生了有利的结果。
临床试验越来越多地表明免疫疗法的重要性,并试图在免疫疗法中发现更多的可能性。未来的数据可能提供有力的证据,证实疾病早期阶段的患者是否可能从这些策略中获益。
总结
免疫治疗时代已经到来,免疫治疗的疗效已经在临床得到验证。正在进行的领域正在将免疫治疗设置为一线治疗全景,以实现深度缓解和延长生存期。此外,破译对免疫治疗策略的耐药机制、调节 TME 和逆转微环境的免疫抑制对于实现临床获益至关重要。
参考文献
Xu J, An G, Qiu L. Immunotherapy for multiple myeloma:new chances and hope. Cancer Biol Med. 2023; x: xx-xx. doi: 10.20892/j.issn.2095-3941.2023.0258

