Cell Discov:中国科学技术大学许超团队揭示METTL9介导的N1-组氨酸甲基化的分子基础
时间:2023-04-18 11:17:26 热度:37.1℃ 作者:网络
甲基化是最丰富和最常见的翻译后修饰(PTMs)之一,在广泛的细胞事件中起着重要作用。
2023年4月4日,中国科学技术大学许超团队在Cell Discovery在线发表题为“Molecular basis for METTL9-mediated N1-histidine methylation”的研究论文,该研究揭示了METTL9介导的N1-组氨酸甲基化的分子基础。

组氨酸甲基化发生在咪唑环的N1或N3位置,约占蛋白质甲基化事件的13%。尽管几十年前就在肌动蛋白和肌球蛋白中发现了甲基组氨酸,但直到最近才鉴定出很少有哺乳动物组氨酸特异性甲基转移酶。几个小组分别将SETD3和METTL18鉴定为肌动蛋白和RPL3组氨酸-N3甲基转移酶,METTL9鉴定为组氨酸-N1甲基转移酶。不同于SETD3或METTL18,甲基化唯一的底物,METTL9特异性识别一个xHxH基序(H是组氨酸,x表示小残基),并催化第二个组氨酸的甲基化。xHxH作为一种已知的金属结合基元,在广泛的金属结合蛋白中被发现,这表明METTL9依赖的组氨酸甲基化在介导这些蛋白的金属结合能力方面具有潜在的作用。尽管METTL9具有重要作用,但其识别底物和甲基化的分子机制尚不清楚。
两种组氨酸甲基转移酶CARNMT114和SETD3的结构已经被破解,这促使作者将其与METLL9的结构进行比较。在三种组氨酸甲基转移酶结构中,底物组氨酸的咪唑环与酶的酸性残基之间均存在组氨酸特异性氢键相互作用,在定位底物组氨酸催化和促进组氨酸脱质子化进行甲基转移方面发挥结构作用。
在与SLC39A5肽结合的METTL9M6结构中,底物组氨酸(His375)紧贴在催化口袋中。组氨酸特异性相互作用,包括氢键和堆积相互作用,使His375的N1原子靠近SAM辅因子,从而实现N1特异性甲基转移。与SETD3宽敞的催化口袋一致,His-to-Ala突变只是轻微削弱了底物的结合亲和力,并且在催化过程中底物组氨酸将其咪唑环旋转了~90°。相比之下,H375A取消了METTL9的底物结合亲和力,在METTL9介导的甲基转移过程中,底物组氨酸侧链没有改变方向,说明它们的底物性质不同。
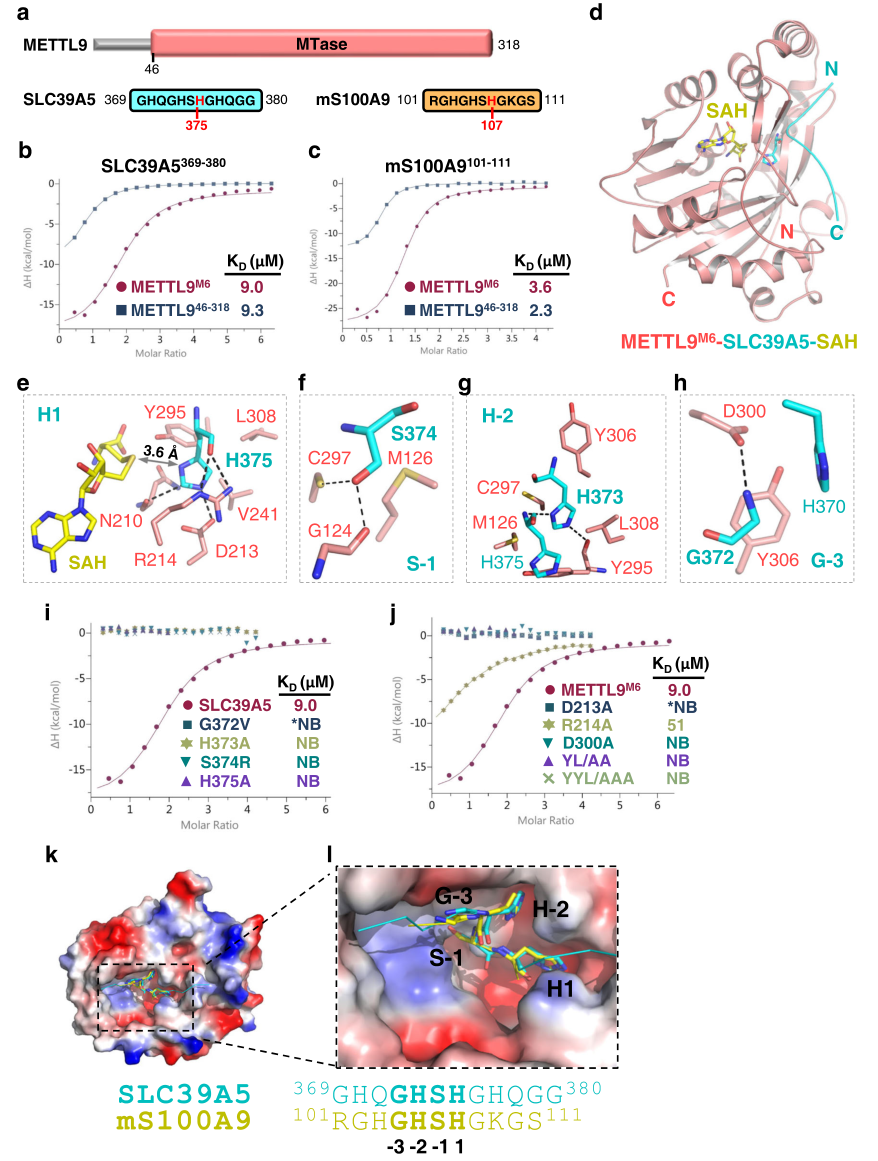
METTL9介导的底物识别和催化(图源自Cell Discovery )
总之,该研究揭示了人类METTL9对xHxH基序进行N1特异性组氨酸甲基化的机制,加深了人们对METTL9化学和酶学特性的理解,这为未来设计广泛特异性组氨酸-N1甲基转移酶的有效抑制剂提供了思路。
原文链接:
https://www.nature.com/articles/s41421-023-00548-w


