抗菌肽LL37在皮肤病的研究进展
时间:2023-10-12 14:26:24 热度:37.1℃ 作者:网络
抗菌肽LL37是目前临床发现的唯一一种人类Cathelidin家族抗菌肽,其可抵御病原体的侵袭,也能够发挥免疫调节、免疫趋化等作用,从而触发或加剧机体炎症反应进程。
玫瑰痤疮和银屑病患者体内高表达的LL37可诱导肥大细胞等炎症细胞分泌多种促炎性细胞因子和趋化因子参与皮损的形成。而特应性皮炎患者的LL37表达减少,使机体皮肤屏障功能受损,更易患细菌感染,因此将LL37作为靶点有望成为玫瑰痤疮等炎症性皮肤病治疗的新思路和新手段。
抗菌肽LL37的产生
人Cathelidin抗菌肽(Cathelidin antimicrobial pep-tide,CAMP)主要在中性粒细胞、上皮细胞中表达,分布在肠道、气道、生殖器和皮肤等多种组织中。编码人CAMP的基因定位于3号染色体,经转录翻译可生成含有一个N端的信号肽,一个Cathelin结构域和一个C端功能肽的前体蛋白,该蛋白经内质网加工去除N端信号肽生成无活性的前体肽hCAP18。人表皮中的激肽释放酶5可以将hCAP18裂解为具有生物活性的LL37参与炎症反应。
抗菌肽LL37的产生机制仍待探索,目前临床认为维生素D受体(vitamin D receptor,VDR)及核因子κB(nuclear factor-κB,NF-κB)核转位参与其中。人CAMP基因转录起始位点附近存在维生素D反应元件,而对基因正向序列进行分析表明该区域包含NF-κB等转录因子的假定结合位点,提示这些因子可以对炎症信号做出反应从而调控CAMP的表达。
Shannon等提出,维生素D3经过羟基化后产生的1,25-二羟维生素D与VDR结合后可以上调LL37的表达。LL37的产生有VDR途径及非VDR途径,如内质网应激途径。VDR途径主要在非氧化应激状态下发挥作用,NF-κB并不参与其中,而在内质网应激途径中,紫外线照射、氧化应激和创伤等外界应激源可以导致细胞内质网应激,并通过诱导NF-κB核转位调控LL37的表达,期间无需VDR的参与。
抗菌肽LL37在炎症性皮肤病中的作用
抗菌肽LL37不仅可以抵御多种病原体的侵袭,还具有免疫调节、免疫趋化和促进血管生成等作用,LL37可以触发各种组织反应,参与玫瑰痤疮、银屑病、AD等皮肤病的发病或加重其临床症状。
玫瑰痤疮
玫瑰痤疮是一种好发于面中部的慢性炎症性皮肤病,典型的临床表现为面部阵发性潮红,持续性红斑,毛细血管扩张和炎症性的丘疹、脓疱。玫瑰痤疮的发病机制尚不清楚,目前认为与遗传因素、先天和适应免疫系统的失调、血管神经功能紊乱及包括毛囊蠕形螨虫在内的微生物等因素相关。此外,冷热刺激、压力、紫外线照射、辛辣食物、吸烟和饮酒等诱发因素也可以加重玫瑰痤疮患者临床症状。

与正常皮肤比较,玫瑰痤疮患者皮损部位角质层激肽释放酶5表达及活性增强,其将hCAP18裂解后生成的LL37也异常升高。将LL37注射至小鼠背部可以导致皮肤出现红斑红血管扩张,可用于建立小鼠玫瑰痤疮样皮炎模型,提示LL37是玫瑰痤疮的炎症发生过程中的关键靶点之一。LL37通过G蛋白偶联受体MRGX2上调肥大细胞瞬时受体电位香草醛家族(transient receptor potential vanilloid,TRPV)中TRPV4的表达,使阳离子内流增加,诱导肥大细胞持续脱颗粒并释放炎症介质。LL37还可以借助嘌呤能受体P2X7进入巨噬细胞并激活NOD样受体3炎症小体,促进半胱氨酸蛋白酶1和白细胞介素(inter-leukin,IL)-1β活化,将大量中性粒细胞、单核细胞等炎症细胞募集至皮肤。
此外,角质形成细胞中的Toll样受体2与LL37结合后激活哺乳动物雷帕霉素靶蛋白复合物1信号,该信号的过度激活反之上调LL37的表达,诱导玫瑰痤疮相关的趋化因子和细胞因子的产生,最终促进并加剧炎症进展。一项研究显示,玫瑰痤疮患者皮肤有益共生菌的表达失调诱导LL37过表达,过表达的LL37招募并刺激浆细胞样树突状细胞(plasmacytoid dendritic cell,pDC)表达Ⅰ型干扰素 (interferon,IFN),促进血管生成。
银屑病
银屑病是免疫介导的慢性、复发性、炎症性皮肤病,典型特征为局限或广泛分布的鳞屑性红斑或斑块。银屑病的发病机制尚未确切阐明,遗传、环境诱因和免疫应答异常等因素均参与其中。树突细胞、T细胞、巨噬细胞、中性粒细胞和角质形成细胞等多种细胞之间存在着复杂的相互作用,活化的树突细胞及其他抗原呈递细胞产生肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)和IL-23,后者可以诱导辅助性T细胞17(T helper cell 17,Th17)增殖分化,其分泌的IL-17和IL-22等细胞因子刺激角质形成细胞增殖。
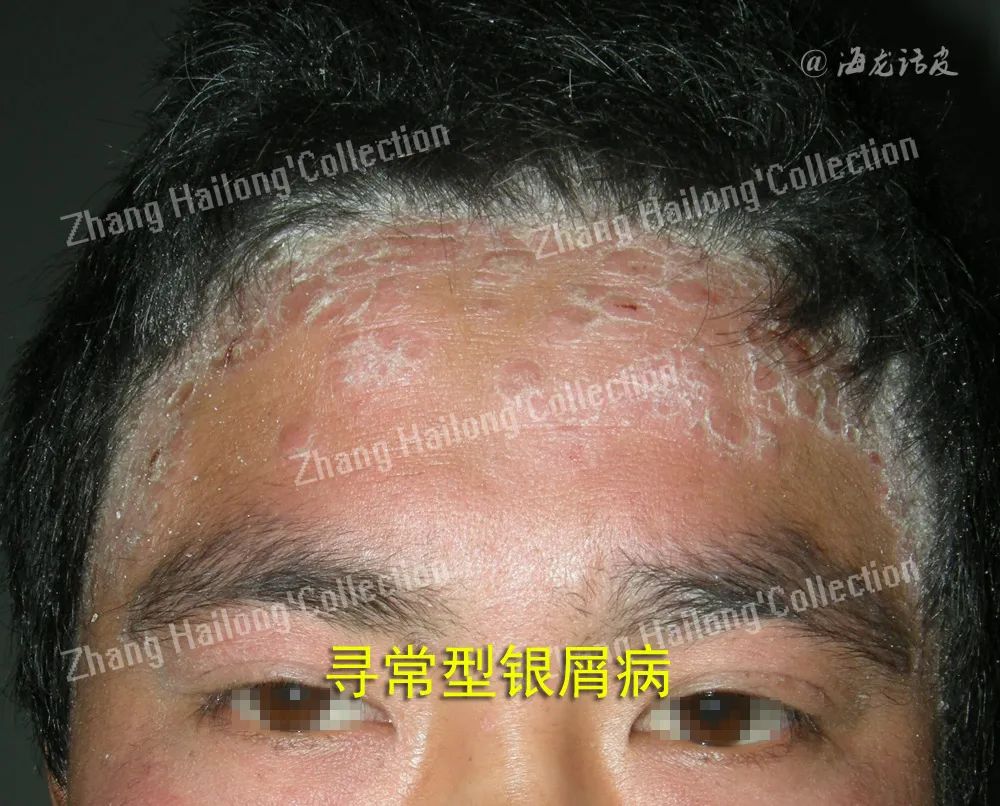
银屑病患者表皮中高表达的LL37通过TLR9使 pDC识别自身DNA,LL37与DNA组成复合物后诱导pDC产生IFN-α,RNA与LL37的复合物则分别通过TLR7和TLR8激活pDC和髓样树突状细胞产生TNF-α和IL-23等细胞因子,加速银屑病皮肤炎症的发生。上述两种复合物来源于多形核中性粒细胞,其中RNA-LL37复合物又可以触发由中性粒细胞胞外陷阱介导多形核中性粒细胞的自我激活循环,使其释放更多的复合物,最终将更多的免疫细胞牵涉其中,加剧炎症进展。LL37自身也可以通过TLR8诱导角质形成细胞IL-36γ的表达从而上调IL-17C。
此外,LL37可以发挥抗凋亡作用并引发角质形成细胞过度增殖,促进银屑病皮损的形成。LL37亦是一种银屑病自身抗原,患者体内特异性CD4+或CD8+T细胞识别LL37后归巢至皮肤并产生细胞因子IFN-γ和Th17细胞因子,参与皮损形成。
AD
AD是一种以反复发作的慢性湿疹样皮疹为主要表现的慢性炎症性皮肤病,伴有明显的皮肤干燥及瘙痒。AD的确切发病机制尚不完全清楚,遗传、环境和心理因素与AD的发病密切相关,免疫异常、皮肤屏障功能障碍、皮肤菌群紊乱等因素也是发病的重要环节。
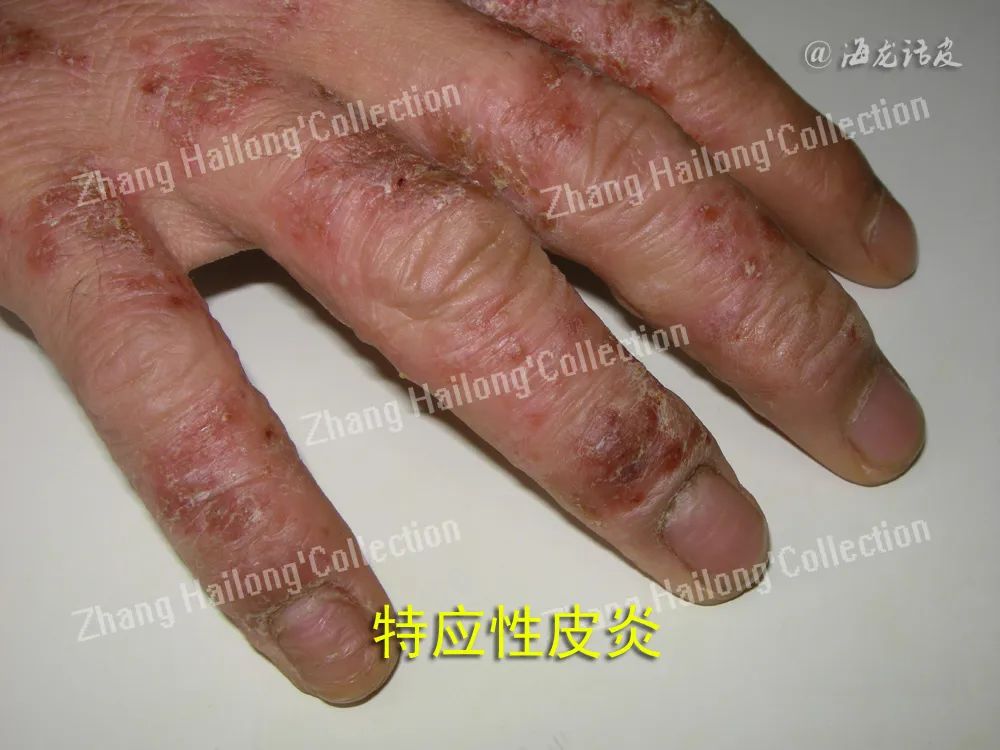
成人AD患者皮损部位的LL37表达明显低于银屑病患者,这种缺乏导致了AD患者皮肤对细菌定植和感染更加敏感,也为AD患者近1/3的皮肤感染率提供了一种解释。尽管有研究表明,儿童AD患者皮肤中LL37水平甚至高于银屑病患者,且这些LL37可以发挥部分类似在银屑病中的作用,但由于健康儿童皮肤中LL37水平原本就显著高于成人,该结论仍有待验证。
AD患者皮肤存在过表达的IL-4和IL-13等Th2细胞因子,这些细胞因子通过STAT-6、NF-κB通路抑制角质形成细胞LL37的表达。AD患者维生素D3的缺乏也可能与LL37减少有关,不过这种观点还存有争议。AD患者皮肤富含表皮葡萄球菌,其分泌的蛋白酶EcpA亦增多,EcpA降解 LL37并损害其抑制金黄色葡萄球菌生长的能力。此外,AD患者皮肤中含有大量的胞外DNA,LL37与这些自身DNA组成的复合物也会损伤LL37的抗菌能力。
LL37可以通过上调紧密连接成分的表达及其在细胞膜的分布来改善皮肤屏障,也诱导臂板蛋白3A的产生以减轻瘙痒症状。但LL37还会诱导肥大细胞分泌IL-31来诱发瘙痒,促进T细胞表达Th2相关细胞因子以建立炎症环境。这些相互矛盾的作用提示AD患者中LL37的缺乏可能会导致皮肤屏障受损和皮肤感染的易发,但是过度表达LL37对AD患者也并无益处。
有研究表明,LL37可借助清道夫受体发挥其广泛的作用,抑制清道夫受体以拮抗LL37的功能或许 可以为玫瑰痤疮等炎症性皮肤病的治疗提供新的思路。目前对LL37疾病治疗的研究更多的是将LL37作为药物本身或效果标志,而将LL37作用机制作为靶点开展疾病治疗的研究也值得关注。
小结
LL37作为目前发现的人类中唯一的Cathelidin家族抗菌肽,发挥了抗感染、免疫调节、免疫趋化和促进血管生成的作用。LL37表达失调可以导致皮肤炎症的产生,从而对玫瑰痤疮、银屑病和AD等皮肤病的发病和进展产生影响,但LL37在其中的具体作用机制尚未得到确切的阐述,如何针对LL37靶点对玫瑰痤疮等皮肤病展开治疗也值得继续研究。
参考文献:
[1]Bin HA,Jiang X,Bergen PJ,et al. Antimicrobial Peptides:An Update on Classifications and Databases[J]. Int J Mol Sci,2021,22(21):11691.
[2]Wang G,Zietz CM,Mudgapalli A,et al.The evolution of the antimicrobial peptide database over 18 years:Milestones and new features[J].Protein Sci,2022,31(1):92-106.
[3]Zhu Y,Lu F,Zhang G,et al.Overview of signal transductionbetween LL37 and bone marrow-derived MSCs[J].J Mol Histol,2022,53(2):149-157.
[4]Lu F,Zhu Y,Zhang G,et al. Renovation as innovation:Re-purposing human antibacterial peptide LL-37 for cancer therapy[J].Front Pharmacol,2022,13:944147.
[5]其他文献略。


