Cancer Cell:李志刚/刘芝华/龙凌云/苏建忠揭示食管鳞癌新辅助免疫疗法应答机制,助力食管癌免疫精准治疗
时间:2023-10-15 14:28:26 热度:37.1℃ 作者:网络
新辅助免疫检查点阻断(ICB)在可手术的食管鳞状细胞癌(ESCC)中显示出希望,但缺乏可用的疗效生物标志物。
2023年10月12日,上海交通大学李志刚、中国医学科学院刘芝华、中国科学院上海营养与健康研究所龙凌云、温州医科大学苏建忠共同通讯在Cancer Cell(IF=50)在线发表题为“Progenitor-like exhausted SPRY1+ CD8+ T cells potentiate responsiveness to neoadjuvant PD-1 blockade in esophageal squamous cell carcinoma”的研究论文,该研究对接受新辅助ICB的ESCC患者的肿瘤进行单细胞RNA测序,揭示了表达SPRY1的耗尽CD8+ T细胞亚群(CD8+ Tex-SPRY1),其显示祖耗尽T细胞(Tpex)表型,并与对ICB的完全反应相关。
该研究通过独立的ICB-/非ICB队列验证了CD8+ Tex-SPRY1细胞作为ICB特异性预测因子改善的反应和生存,并证明了SPRY1在CD8+ T细胞中的表达增强了Tpex表型并增强了ICB疗效。此外,CD8+ Tex-SPRY1细胞参与巨噬细胞的促炎表型和B细胞的功能状态,从而通过增强CD8+ T细胞效应功能促进抗肿瘤免疫。总的来说,该发现揭示了祖细胞样CD8+ Tex-SPRY1细胞在ESCC对ICB有效应答中的作用,并为未来的个体化免疫治疗提供了机制生物标志物。

食管癌是全球第七大癌症相关死亡原因,食管鳞状细胞癌(ESCC)约占所有病例的90%。大约60%的食管癌表现为局部晚期,在诊断时可以接受潜在的治愈治疗。对于可手术的局部晚期 ESCC,新辅助放化疗后手术是当前的标准治疗。然而,这种方法的临床效益仍然不理想,大约30-40%的患者达到完全消退/缓解(CR),并且高度远处复发。因此,需要更有效的ESCC治疗来改善临床结果,免疫治疗是最有希望的途径之一。
基于免疫检查点阻断(ICB)作为晚期转移性食管癌一线治疗的成功,最近的I/II期试验研究了在食管切除术前结合ICB,即新辅助ICB治疗(NICB),显示出对局部晚期ESCC有希望的益处。之前的II期研究表明,NICB具有显著的抗肿瘤疗效和可耐受的安全性;然而,CR率仅为39.2%,而其他病例对NICB反应不佳或部分反应。这些发现在评估NICB在中国疗效的全国现实世界研究中得到了进一步证实,强调了提高NICB在ESCC疗效的必要性。此外,均未发现ESCC中PD-L1表达与NICB应答之间存在显著相关性。因此,为了更好地指导免疫治疗的应用,阐明治疗反应的潜在机制和识别预测NICB有效反应的生物标志物至关重要。
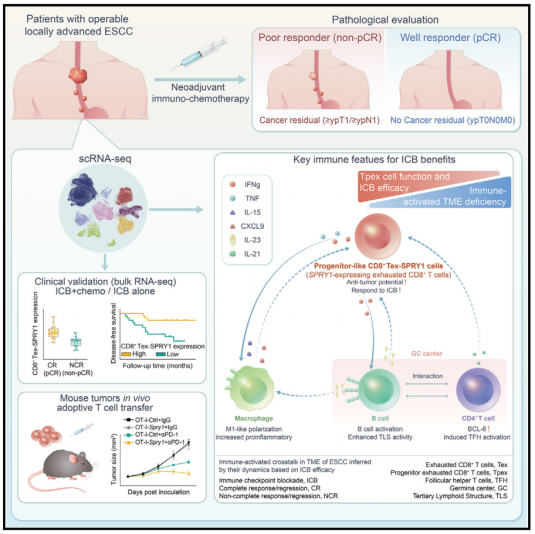
机理模式图(图源自Cancer Cell)
肿瘤微环境(tumor microenvironment, TME)中的免疫细胞在肿瘤生物学和抗肿瘤药物的敏感性中起着重要作用。其中,CD8+ T细胞通过分化为细胞毒性T细胞对抗癌细胞,在抗肿瘤免疫中起关键作用。然而,T细胞耗竭是癌症的一个标志,CD8+ T细胞经常失去其效应功能并分化为耗竭状态,从而限制了其抗肿瘤反应。为了解决这个问题,阻断PD-1/PD-L1信号通路等共抑制途径,旨在恢复T细胞功能。然而,最近的研究发现了耗竭的CD8+ T细胞谱系的异质亚群,包括ICB允许亚群和难治亚群,导致不同的治疗反应。此外,抗肿瘤T细胞反应也受TME内细胞间相互作用的调节,尽管其潜在机制在ESCC中尚不完全清楚。目前,有越来越多的研究调查NICB在食管癌中的作用,然而,潜在的反应机制和生物标志物仍未得到充分研究。单细胞RNA测序(scRNA-seq)代表了一种强大的方法来解剖细胞异质性,并已确定了在其他癌症中调节抗肿瘤免疫的广泛免疫簇。然而,这些发现对ESCC的适用性仍不清楚。
该研究对接受NICB治疗的局部晚期ESCC患者的肿瘤进行了scRNA测序,以表征与反应性相关的免疫环境。该研究揭示了对NICB敏感性的基础,并鉴定了一个表达SPRY1的耗尽CD8+ T细胞亚群,该亚群具有祖表型,表现出对NICB的反应性增强,揭示了一个有希望的生物标志物,可以指导患者选择ESCC免疫治疗。该研究结果为ESCC中NICB反应的预测性生物标志物提供了见解,并将为最佳免疫治疗方案的开发提供了信息。
原文链接:
https://www.cell.com/cancer-cell/fulltext/S1535-6108(23)00327-6


