读书报告 | 肿瘤肺转移的机制
时间:2023-10-19 18:52:39 热度:37.1℃ 作者:网络
导读
癌症像是一个复杂的生态系统,肿瘤微环境(TME)包含了被各种非恶性细胞类型包围的癌细胞,共同嵌入在一个改变了的、血管化的细胞外基质中。TME细胞及其分泌的分子在癌症的发病机制中发挥关键作用,并且是非常有潜力的治疗靶点。
在肿瘤进展的早期,肿瘤细胞所在的微环境中存在一个从免疫攻击到免疫逃避的过程。随着病变进展,肿瘤微环境肿瘤的T细胞、自然杀伤(NK)细胞、CD8+T细胞功能障碍,与肿瘤相关髓细胞,尤其是巨噬细胞和中性粒细胞,共同形成了一个支持肿瘤生存的、免疫抑制的微环境。慢性活化的巨噬细胞和中性粒细胞可以通过多种机制导致上皮细胞恶性转化,并支持肿瘤发生免疫逃逸。肿瘤相关成纤维细胞也可通过丰富的作用机制,影响免疫细胞的招募和激活、影响癌细胞的信号传导和行为,甚至降低肿瘤治疗的效果。微环境中的细胞在肿瘤血管生成的过程中也起到了非常关键的协调作用,为肿瘤侵袭和转移奠定基础。
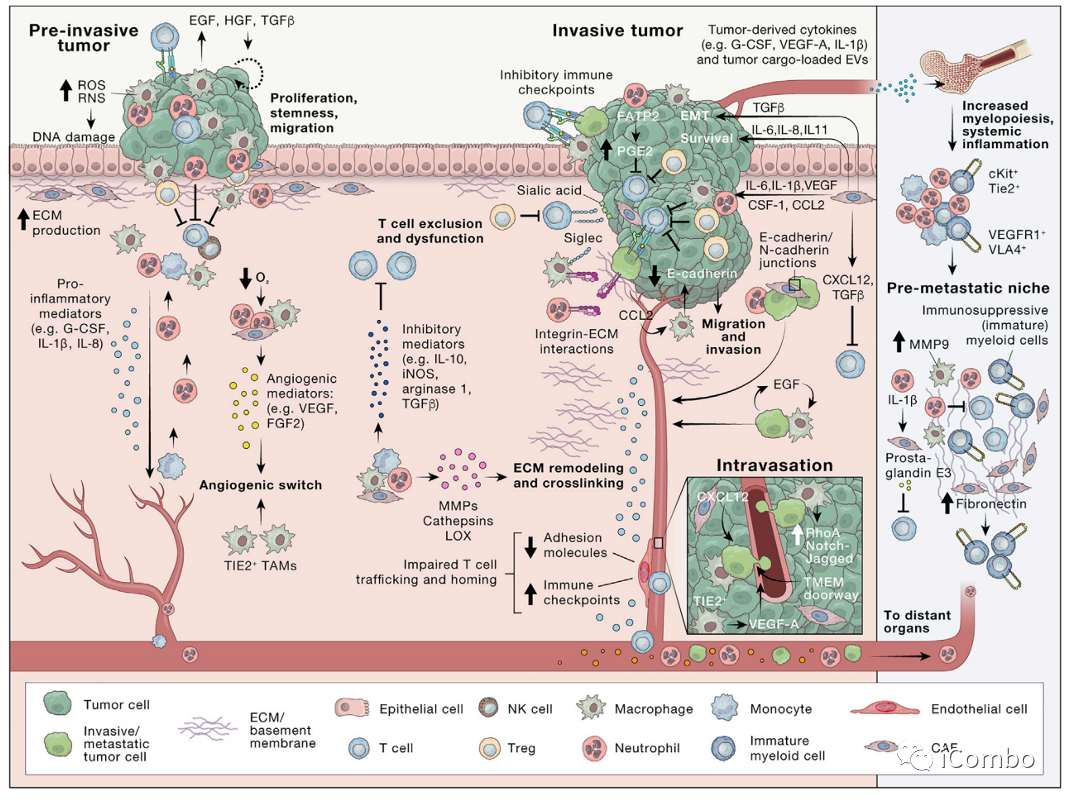
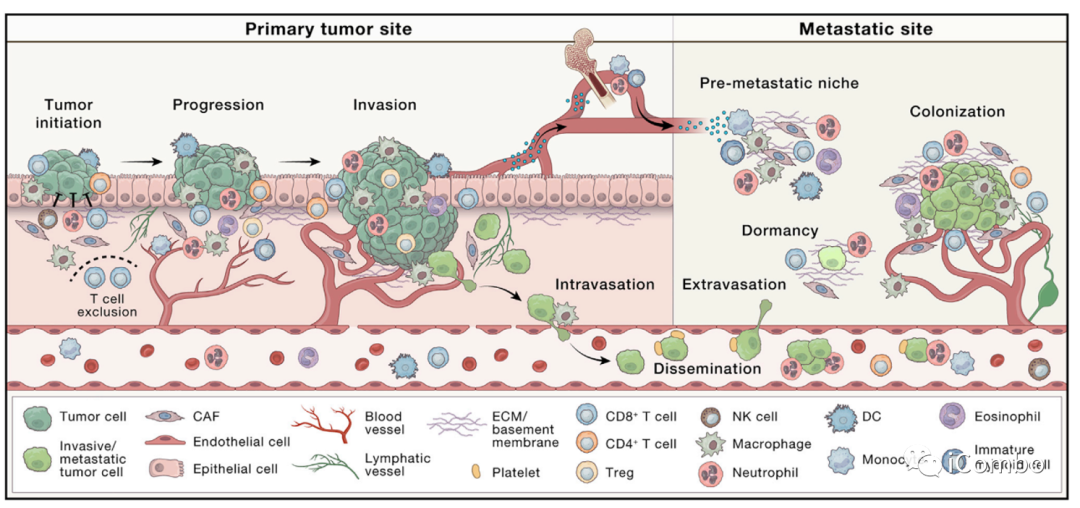
在综述“The evolving tumor microenvironment: From cancer initiation to metastatic outgrowth”中,作者详细复习了肿瘤肺转移的机制。在癌细胞向肺部转移的过程中,原发肿瘤细胞向血管内渗阶段,巨噬细胞定位于血管周围生态位,与局部癌细胞、内皮细胞共同组成转移性肿瘤通道(TMEM),帮助癌细胞穿过血管屏障。迁移的肿瘤细胞接近TMEM门时,可与巨噬细胞结合,启动休眠程序,激活侵袭程序,并拥有肿瘤干细胞的特征,内渗入脉管系统并成为循环肿瘤细胞(CTC)。微环境中的III型胶原蛋白可是弥散性肿瘤细胞(DTCs)处于休眠状态,保护它们不被免疫系统识别和杀死。而一旦肿瘤从休眠中“觉醒”,就会导致转移瘤的形成。研究表明,休眠唤醒的重要机制之一就是衰老。衰老的肺部微环境可以诱导休眠的黑色素瘤细胞转变为增殖活跃状态,从而形成肺部转移瘤。肺血管附近的巨噬细胞,可被癌细胞产生的胞外基质蛋白tenascin激活,并诱导血管内皮细胞产生多种促进肺部转移灶产生的促癌蛋白。
对肿瘤发展的全过程中与TME众多成分的crosstalk的深入了解,使研究者能够更有针对性地制定对抗肺转移的新策略(Cancer Cell. 2023 Mar 13;41(3):374-403.doi:10.1016/j.ccell.2023.02.01)。
肿瘤进展各阶段中肿瘤微环境(TME)及关键细胞

肿瘤起始:从免疫攻击到免疫逃避
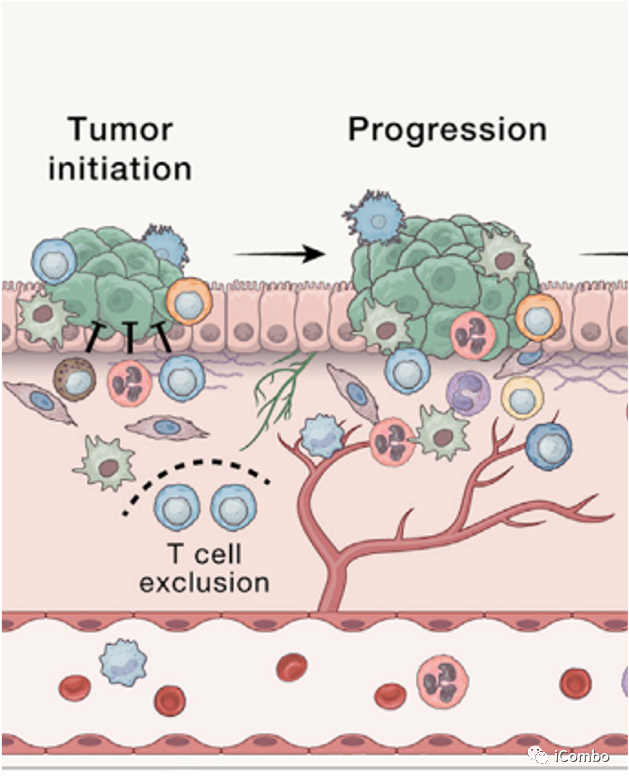
癌前进展的早期步骤:
-
幼稚T细胞的流入,表明免疫系统在其早期阶段就能感知到转化。
-
幼稚T细胞向活化的T细胞和髓系细胞的积累过渡,以及免疫抑制相关基因的上调。
-
形成支持肿瘤生存的炎症环境,T细胞、自然杀伤(NK)细胞、CD8+T细胞功能障碍。肿瘤刺激髓细胞,特别是巨噬细胞和中性粒细胞的募集和激活,共同形成了肿瘤部分炎症环境。
免疫抑制TME逐渐形成
肿瘤进展:炎症为催化剂
发展中的肿瘤,炎症的特点是破坏适应性-先天免疫细胞串扰,且这种破坏作用无法消除。
肿瘤进展中的炎症事件:
-
CD4+ T细胞倾向于促炎Th2表型
-
髓系细胞越来越多地被动员到TME
-
肿瘤相关巨噬细胞(TAMs)和中性粒细胞(TANs)是TMEs中最丰富的髓系细胞。
肿瘤相关巨噬细胞(TAMs)和中性粒细胞(TANs)

TAM和TAN导致上皮细胞恶性转化的机制:
1. 产生活性氧和氮,直接诱导上皮细胞DNA损伤。
2. 分泌丰富的生长因子和细胞因子,直接诱导转化。
3. 通过协调TME中的肿瘤支持过程间接促进肿瘤的发生。
髓系细胞支持肿瘤免疫逃逸的机制:
1. 分泌T细胞和NK细胞的抑制性介质,表达免疫检查点分子,并产生炎症介质,放大炎症反应。
2. 通过其在TME中的代谢适应,引起营养物质和必需氨基酸的消耗。
肿瘤进展:肿瘤相关成纤维细胞(CAFs)
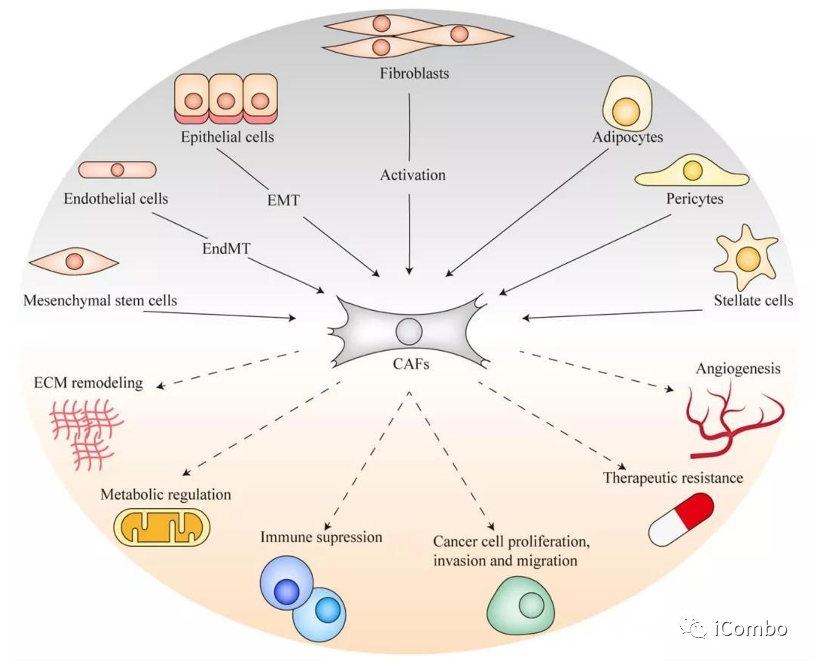
CAFs在TME中发挥多效性和相反的功能:
-
临床前研究中内源性CAFs强大的致瘤作用。
-
下调特定的CAF亚群,会加速某些小鼠模型中的肿瘤生长
-
CAFs主要负责TME内细胞外机制(ECM)的沉积和重塑。
-
ECM的力学特性直接影响癌细胞的信号传导和行为,进而影响免疫细胞的招募和激活
-
形成药物或治疗性免疫细胞渗透屏障,阻止药物与免疫细胞向肿瘤组织的深层渗透,从而降低肿瘤治疗效果。
-
CAFs和免疫细胞共同工作。纤维化肿瘤具有炎症表型,炎症进一步促进纤维化。
-
通过多种机制帮助肿瘤逃避免疫控制。
肿瘤进展:血管生成
肿瘤相关骨髓细胞
-
促血管生成介质促进肿瘤血管生成
-
增加血管通透性,
-
产生蛋白酶,分解ECM并释放隔离的促血管生成分子。
CAFs
-
CAFs产生促血管生成介质,包括VEGF-A、FGF2和CXCL12等;
-
在TME中招募和激活具有促血管生成能力的EC祖细胞和髓样细胞
-
间接促进肿瘤血管生成;
-
介导结缔组织增生影响肿瘤的血管化
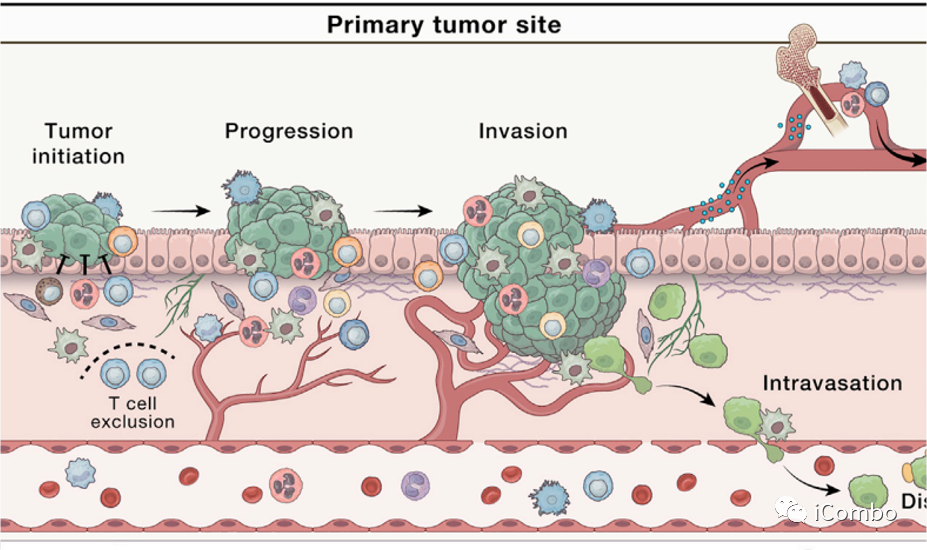
癌症转移前的准备工作:侵袭和迁移
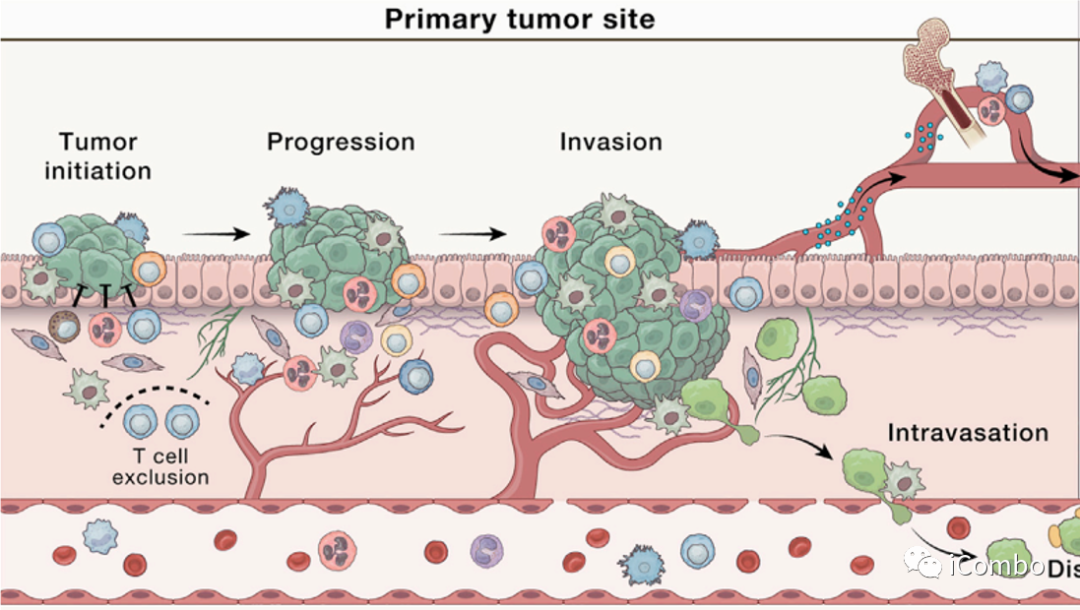
侵袭是的步骤:
-
癌细胞彼此分离
-
从原发肿瘤块移开
-
侵入周围的基质
上皮细胞间粘附蛋白E-钙粘蛋白的缺失是与邻近的癌细胞分离这一过程的核心,通常伴随着上皮到间充质转化样的过渡状态(EMT)。
CAFs:通过分泌蛋白酶,也通过施加收缩力在基底膜上产生间隙,使癌细胞可以利用这些间隙穿过基底膜。
癌症转移前的准备工作:进入血管(内渗)
癌细胞穿越内皮层进入循环取决于环境,并受到癌细胞内在特征、ECM的物理特性和脉管系统类型、微环境线索和缺氧程度的影响。
-
肿瘤中血管基底膜和内皮屏障可能被破坏,从而增加血管渗漏。
-
位于血管近端的CAFs分泌CXCL12,将TAM和癌细胞吸引到血管周围区域发生内渗;
-
血管周围TIE2+的TAM诱导VEGF-A信号,导致血管连接处缺失,血管通透性的短暂增加,促进内渗;
-
TAM可直接对癌细胞进行重编程,通过Notch-Jagged信号传导促进癌细胞的癌症干细胞编程,诱导缓慢迁移、入侵的癌细胞表型;
在内渗过程中,巨噬细胞定位于血管周围生态位,在那里与癌细胞、内皮细胞共同组成转移性肿瘤通道(TMEM),帮助癌细胞穿过血管屏障。
肺转移的内渗过程
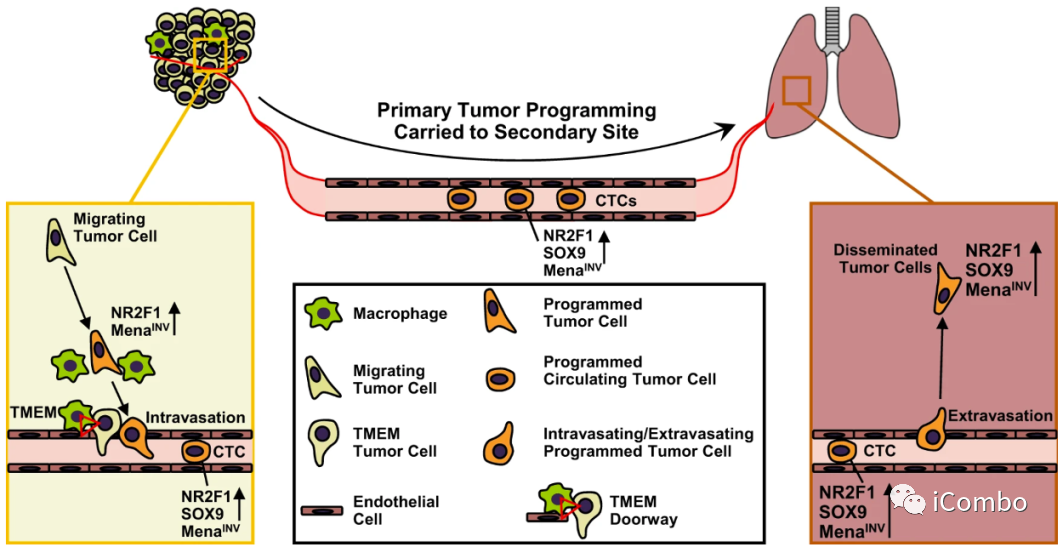
Nature Communications volume 13, Article number: 626 (2022)
小鼠肺转移模型:肿瘤细胞在原发部位获得了由转录调控因子NR2F1控制的前传播和休眠表型,并在巨噬细胞附近进一步富集。
转移前微环境(PREMETASTATIC NICHE)
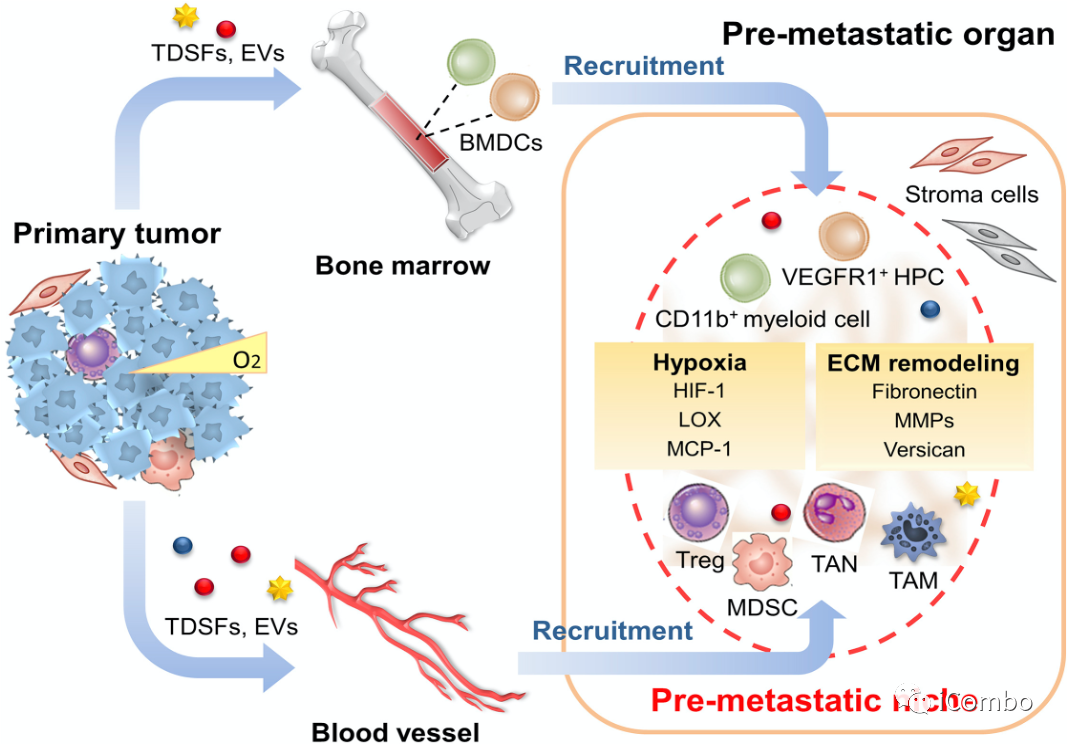
Cancer Cell 2016 30668-681DOI: (10.1016/j.ccell.2016.09.011)
肿瘤来源分泌因子(tumor-derived secreted factors, TDSFs)、细胞外囊泡(extracellular vesicles, EVs),骨髓来源细胞(bone-marrow-derived cells, BMDCs),粒细胞髓源性抑制细胞(MDSC),肿瘤相关中性粒细胞(TAN),肿瘤相关巨噬细胞(TAM)
定义:原发性肿瘤在继发器官和组织部位为随后的转移创造的有利的微环境,称为转移前微环境,或转移前微生态。
肿瘤转移前微环境的特征

Cancer Cell 2016 30668-681DOI: (10.1016/j.ccell.2016.09.011)
肺转移休眠调控
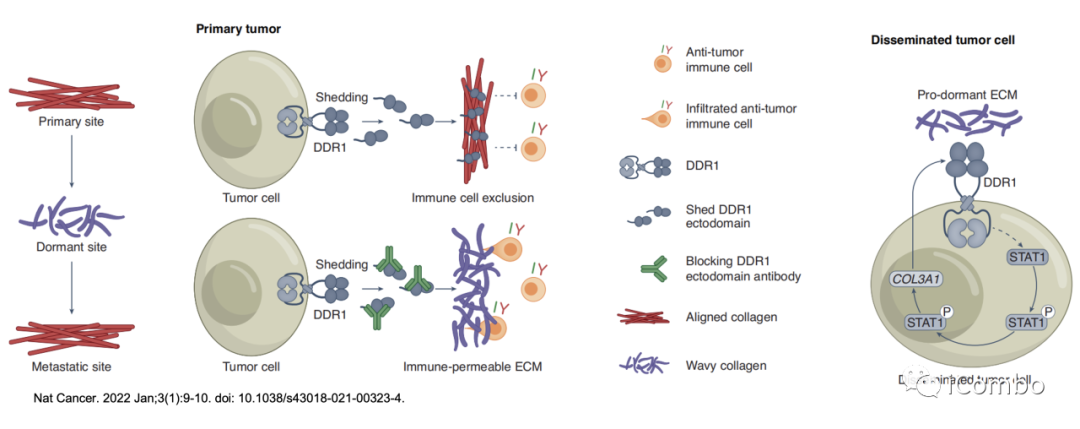
Nat Cancer. 2022 Jan;3(1):9-10. doi: 10.1038/s43018-021-00323-4.
PVN(血管周围微生态)对决定DTC的命运至关重要,包括III型胶原和tenascin C在内的ECM分子发挥着重要作用。
唤醒休眠的机制:衰老肺组织

Nature. 2022 Jun;606(7913):396-405.
-
衰老的肺部微环境可以诱导休眠的黑色素瘤细胞转变为增殖活跃状态,从而形成肺部转移瘤。
-
机制上,WNT5A是促进转移黑色素瘤细胞进入休眠的关键分子
-
衰老的肺部成纤维细胞可以分泌WNT5A拮抗剂sFRP1
唤醒休眠的机制:炎症
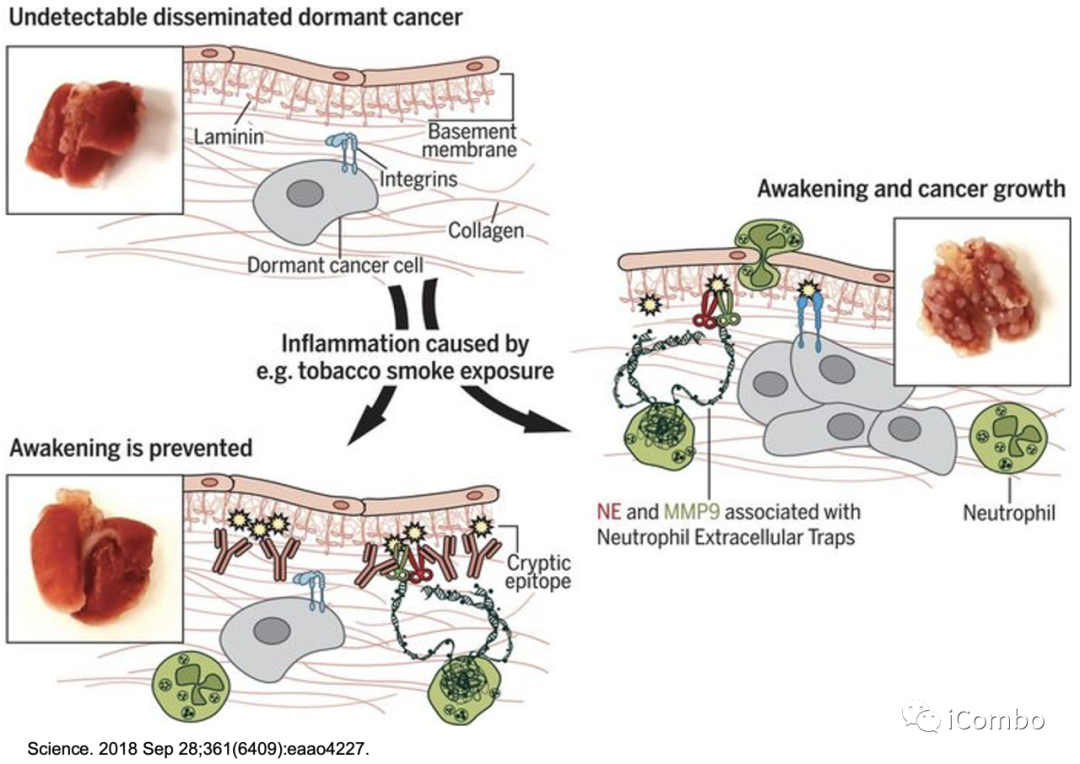
中性粒细胞可以在细胞外基质中通过释放中性粒细胞胞外陷阱(NETs)来杀死有害微生物。NET是一种具有相关细胞毒性蛋白和蛋白酶的DNA支架。
肺转移微环境:内皮细胞(EC)的分子重编程
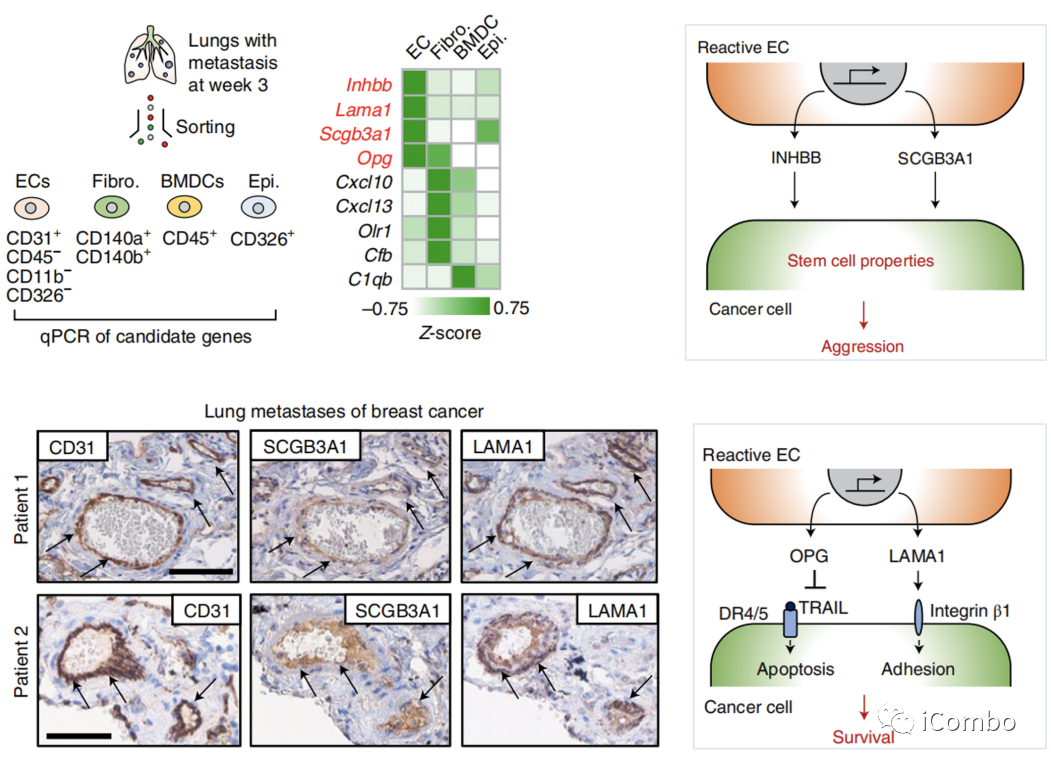
Nature Cancer volume 3, pages486–504 (2022)
转录组学分析识别肺转移定植过程中反应性EC的特征变化:
lEC分泌的促转移分子在转移开始三周后表现出特别强烈的活性增加。
编码的四种蛋白(Inhbb、Lama1、Scgb3a1和Opg)并分泌到转移微环境中。
-
Inhbb和Scgb3a1赋予癌细胞干细胞特性
-
Opg防止细胞凋亡
-
Lama1支持粘附介导的细胞生存
巨噬细胞诱导肺EC产生促癌蛋白
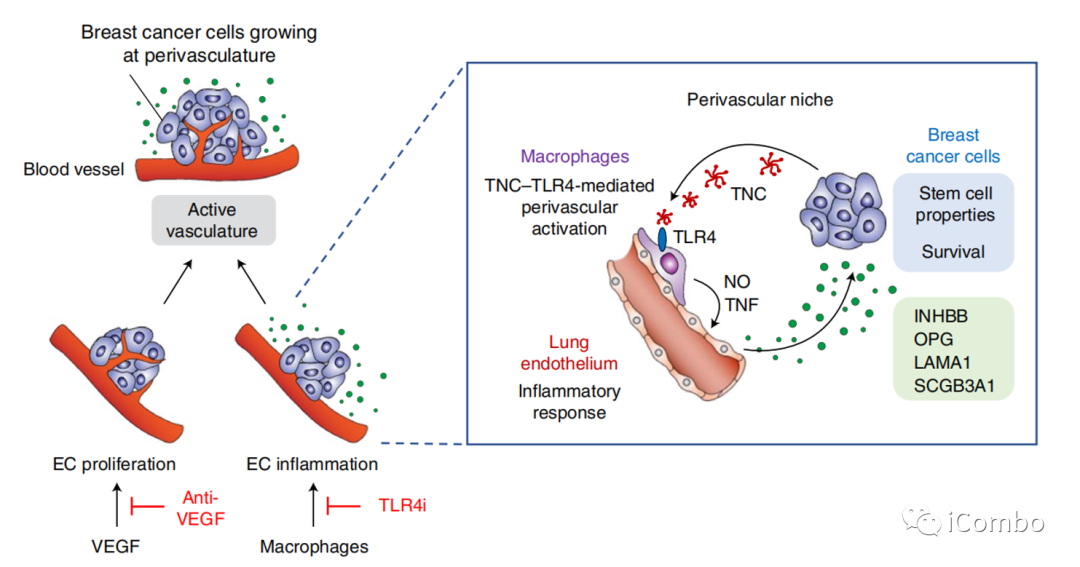
Nature Cancer volume 3, pages486–504 (2022)
小结
靶向肿瘤微环境中的细胞、crosstalk和信号通路的治疗是一种有前途的抗肿瘤治疗策略。
靶向TME的治疗的探索方向包括:
-
耗尽或“重编程”TME中促癌的宿主细胞
-
干预和修改ECM、基质成分和细胞外囊泡(EVs)
-
基于细胞的疗法和疫苗
-
免疫检查点抑制剂
靶向TME治疗的挑战:
-
适应性和内在的耐药性可能是TME定向治疗的一个障碍。
-
标准治疗可能引起TME的变化,以癌细胞外部的方式调节其治疗效果,干扰疗效。
-
许多标准治疗可以引发炎症反应,通过TAMs干扰治疗反应,甚至可能驱动转移。
-
如何对TME治疗的患者进行最佳分层,特别是对于那些无法为此目的进行活检的癌症。是否可以以CTC或ev的相对丰度和/或表型分析作为分层的替代。
-
如何靶向已经扩散并进入休眠状态的癌细胞。
小结:展望未来
通过利用多模态数据、使用高级计算分析和人工智能,采用全面的系统级方法,分析和整合TME的所有复杂性,以识别和治疗靶向关键节点。而不是一次研究一种细胞类型的TME,未来几年将充分实现针对TME的研究,将取得关键进展。
预计生物工程的重大进展,将使大规模测试平台,如体外类器官和组织切片,准确地再现器官TME。
除了肿瘤本身之外,还有众多系统性的问题亟待探索。
-
微生物群、饮食、运动和代谢如何影响TME和治疗反应?
-
来自个体患者的潜在生理学的贡献是什么,如肥胖、恶病质、昼夜周期、炎症和衰老?
-
外部环境(如污染和致癌物暴露)对炎症和TME的影响有新的?


