好文推荐 | P2Y1受体介导星形胶质细胞的激活在急性一氧化碳中毒迟发性脑病中的作用
时间:2023-11-08 11:50:59 热度:37.1℃ 作者:网络
摘要
目的 探讨P2Y1受体和星形胶质细胞在急性一氧化碳(CO)中毒迟发性脑病(DEACMP)中的作用以及DEACMP可能的发病机制。方法 经水迷宫实验筛选认知功能合格的雄性SD大鼠,随机分为两组:对照组、CO中毒组,CO中毒组制作DEACMP模型,分别于造模后第7天、第14天、第21天、第28天对比两组行为学改变,神经元变化以及海马组织中P2Y1受体和星型胶质细胞的表达。
结果 通过水迷宫发现与对照组相比,造模后第21天、第28天CO中毒组大鼠逃避潜伏期均明显延长(P<0.05);HE染色发现造模后第14天、第21天、第28天模型组大鼠海马锥体细胞及神经元坏死明显,结合水迷宫可表明大鼠在21 d时出现DEACMP;与对照组相比,Western blot法检测提示各时间点CO中毒组海马区P2Y1及GFAP蛋白表达均增多(P<0.05),呈先升高后降低的趋势;免疫荧光表明海马区P2Y1和GFAP存在共表达,相对于对照组,中毒后各时间点海马CA1区P2Y1和GFAP都有表达上调(P<0.05)。
结论 P2Y1受体对星形胶质细胞的激活可能是DEACMP的发病机制之一,星形胶质细胞可能通过介导免疫炎症反应使CO中毒的大鼠学习记忆能力损害导致DEACMP发生。
急性一氧化碳(carbon monoxide,CO)中毒在我国发病率非常高,10%~50%患者CO中毒后经过治疗会经历2~60 d的症状恢复期,这段时间称作“假愈期”,之后逐渐出现急性一氧化碳中毒迟发性脑病(delayed encephalopathy after acute carbon monoxide poisoning,DEACMP),这是CO中毒后最严重的并发症之一,DEACMP以认知功能障碍、大脑皮质局灶性功能障碍、脑神经损害、锥体系等神经精神症状为主要特征。DEACMP的发病机制复杂多样,因此治疗存在困难。目前国内外学者对其发病机制大致归纳为以下几种学说:缺血缺氧学说、兴奋性氨基酸学说、自由基学说、免疫反应学说、细胞凋亡学说、线粒体功能受损等,几种机制相互作用引起脑功能损伤,最终导致DEACMP,虽然已有众多相关研究,但结果仍不明确。我们之前研究发现ATP通过P2Y12受体途径调控的小胶质细胞激活可能导致DEACMP的发生,并认为根据DEACMP发病过程的特点从免疫炎症角度去解释更加适合,因此本研究将继续从免疫炎症角度出发,进一步探索DEACMP的发病机制。
星形胶质细胞是中枢神经系统中数量最多的胶质细胞,是参与神经炎症反应的关键细胞。星形胶质细胞能够帮助离子和神经递质处于稳态,维持血脑屏障,同时为神经元提供营养和代谢支持,除此之外在星形胶质细胞上表达有众多神经递质转运蛋白和受体,可以感知和响应突触传递,在大脑中神经元之间信号交换起到至关重要的作用。当中枢神经系统到损伤时,星形胶质细胞被激活使促炎和抗炎因子上调,起到了双重作用,一方面促进炎症反应的进展,加重神经组织损伤;另一方面可以释放神经营养因子,帮助神经组织修复。众多研究已证实星形胶质细胞是通过P2Y受体的激活来调控的,P2Y受体可以对神经系统病变进行调节。有研究表明P2Y1受体激动剂对星形胶质细胞的刺激显著减少了创伤性脑损伤模型中的脑水肿和反应性神经胶质增生。与此同时,也有研究发现在阿尔茨海默病(AD)的小鼠模型中通过慢性侧脑室注射P2Y1受体拮抗剂可以增强突触结构的完整性,使星形胶质细胞和神经元网络功能障碍正常化,改善空间和记忆能力,因此P2Y1受体对星形胶质细胞的激活也有着保护和损害的两面性。目前国内外在DEACMP中尚未有人研究P2Y1受体调控星形胶质细胞能够产生何种变化,在此,本文将探究P2Y1受体介导的星形胶质细胞激活在DEACMP发病过程的作用与功能。
1 材料与方法
1.1 材 料
1.1.1 实验动物及分组 购置150只SD大鼠,雄性,约6周龄,200~250 g[斯贝福北京生物技术有限公司,实验动物许可证SCXK(京)2019-0010],无特殊病原体级(specific pathogen free,SPF),分笼饲养于恒温干净的动物房,提供充足水分和食物,室温下12 h明暗交替,适应性饲养1周。
1.1.2 主要仪器和试剂 CO气体(纯度99.9%,购于佛山市科的气体化工有限公司);Morris水迷宫分析系统(购于北京众实迪创科技发展有限公司);石蜡包埋机、冰冻切片机、普通光学显微镜均购于Leica公司;荧光显微镜购于OLYMPUS公司。HE染色试剂盒(G1120)、牛血清白蛋白(A8020)、BCA蛋白浓度测定试剂盒(PC0020)、5xTris甘氨酸电泳缓冲液、10x转膜液、10xTBST缓冲液、TritonX-100(T8200)均购于北京Solarbio公司;小鼠抗大鼠GFAP抗体(货号G3893,购于德国Sigma);兔抗大鼠P2Y1抗体(货号PA5-77678,购于美国Invitrogen);山羊抗小鼠H&L Alexa Fluor 594(货号ab150116)、山羊抗兔IgG H&L Alexa Fluor 488(货号ab150077)均购于英国Abcam;小鼠抗大鼠P2Y1抗体(货号67654-1-lg)、山羊抗小鼠lgG(H+L)(货号SA00001-1)、GAPDH抗体(货号60004-1-lg)、灵敏ECL化学发光检测试剂盒(PL10002)均购于Proteintech武汉三鹰生物技术有限公司。
1.2 方 法
1.2.1 实验动物筛选及分组 160只大鼠饲养1周后进行连续6 d的Morris水迷宫训练,将大鼠置于水迷宫实验的平台上适应数秒,然后将大鼠依次置入水池的4个象限中,直到大鼠成功爬到平台上,计算机录入大鼠巡游轨迹和时间,在第7天筛选出合格的大鼠,将逃避潜伏期小于120 s的大鼠视为认知功能正常,进行后续模型制备。按照随机数字表法将合格大鼠随机分成空白对照组30只,CO中毒组120只,根据造模后的不同时间节点(7 d、14 d、21 d、28 d)分为4个中毒亚组,每亚组30只大鼠。
1.2.2 模型制备 参照Ochi等的方法采取静态吸入法创建DEACMP模型,将大鼠置于充满CO气体的透明密闭玻璃箱中,CO中毒组先吸入1000 ppm CO气体40 min,后上调到3000 ppm继续吸入20 min,如大鼠死亡,立即补入大鼠按相应方法重新操作,确保每组数量相等,对照组置于充满空气的箱中60 min。造模成功标准:大鼠呼吸急促沉重,耳朵、爪子和尾巴呈樱桃红色,肢体瘫痪及昏迷等,将存活中毒大鼠每个亚组随机抽取5只进行水迷宫实验检测学习和记忆能力和HE染色观察海马区锥体细胞损伤情况,两者同时具备则模型制备成功。
1.2.3 取材及相关指标检测 将CO中毒组及空白组分别在不同时间节点(7 d、14 d、21 d、28 d)进行标本留取。腹腔注射10%水合氯醛(3 ml/kg),一部分大鼠用生理盐水心脏灌注,冲洗体循环血液,待肝脏转为陶土色时,用4%多聚甲醛进行脑组织固定,直至肢体僵硬,完整剥离脑组织,后续进行石蜡切片及冰冻切片;其余大鼠麻醉后,断头去骨在5 min以内在冰面上快速分离出海马组织,用预冷生理盐水涮净血渍,保存于-80 ℃冰箱中,用于Western blot。(1)HE染色:多聚甲醛固定好的脑组织用石蜡包埋后,切成6 μm厚贴于载玻片上,用试剂盒进行HE染色,中性树胶封片后在200倍光学显微镜下分别观察各组大鼠海马CA1区锥体细胞的形态变化。(2)Western blot检测P2Y1受体和星形胶质细胞特异性标志物GFAP和内参GAPDH蛋白表达情况:海马组织用超声波细胞破碎机制备脑组织匀浆,4 ℃离心机离心后取上清液参照BSA法对蛋白含量进行测定,计算出每个样本上样体积,配置分离胶、浓缩胶、上样、电泳、转膜、封闭,将膜纸用1xTBST进行冲洗,加入稀释好的一抗P2Y1(1∶2000),GFAP(1∶1000),内参GAPDH (1∶25000),放入4 ℃冰箱摇床上孵育过夜;第22天,再次用1xTBST洗膜3次,10 min/次,分别加入二抗(1∶2000)室温孵育1 h,再次用1xTBST洗膜3次 ,后置于ECL发光中(1∶1),充分接触60~120 s,用Image Lab凝胶成像系统进行曝光采集,存储实验数据,后期用Image J软件测定蛋白表达条带灰度值。(3)免疫荧光检测P2Y1受体和GFAP表达:将多聚甲醛固定的脑组织,经蔗糖梯度脱水后用冰冻切片机切成18 μm切片,浸泡在PBS溶液中,用0.3%Triton-PBS室温摇床上漂洗3次,10 min/次;10%山羊血清封闭常温摇床60 min,孵育一抗GFAP (1∶500)、P2Y1(1∶100),放入4 ℃冰箱摇床上孵育过夜,第2天再用0.3%Triton-PBS室温摇床上漂洗3次,10 min/次,避光孵育二抗GFAP(1∶400)、P2Y1(1∶100)室温摇床60 min,后继续避光用0.3%Triton-PBS漂洗3次,将切片捞出平铺在载玻片上,用DAPI染色固定细胞核后封片,4 ℃避光保存后续在荧光显微镜200倍视野下留取荧光图片,后期用Image J软件测定平均光密度。
1.3 统计学分析 采用SPSS 25.0软件进行分析。计量资料均符合正态分布,用均数±标准差(x±s)表示,多组间比较采用单因素方差分析(one-way ANOVA),组间两两比较用最小显著差异法(LSD-t)。以P<0.05表示差异有统计学意义。
2 结果
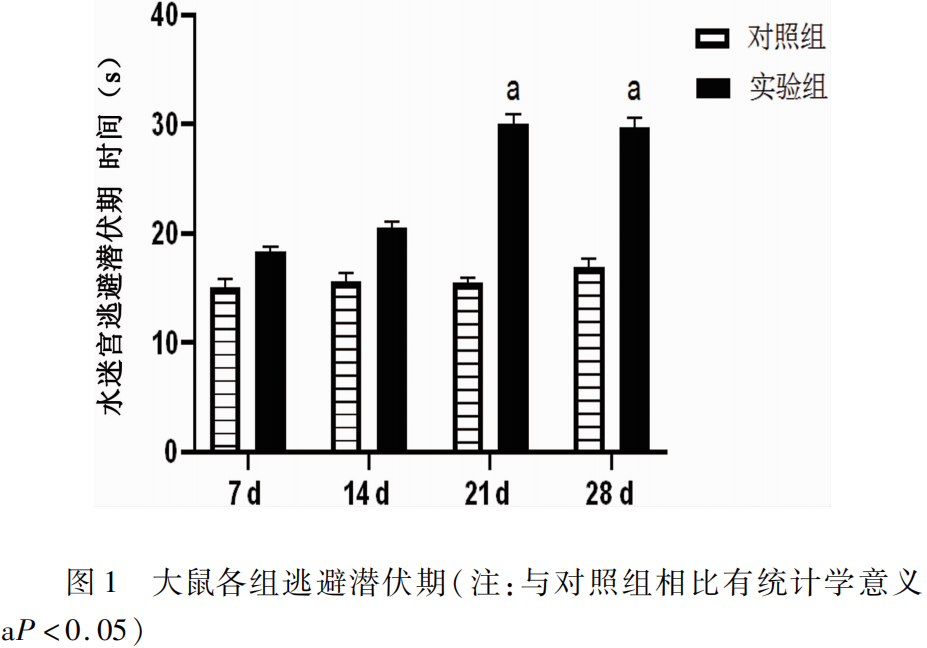
2.1 Morris逃避潜伏期比较 中毒后各组大鼠水迷宫逃避潜伏期均延长(见图1),相比对照组,7 d、14 d没有统计学意义(P>0.05),但中毒21 d、28 d逃避潜伏期明显延长(P<0.05),空白组组间无统计学差异,以上结果说明在21 d时大鼠发生了行为学上的改变,其记忆力下降显著,认知功能出现障碍。
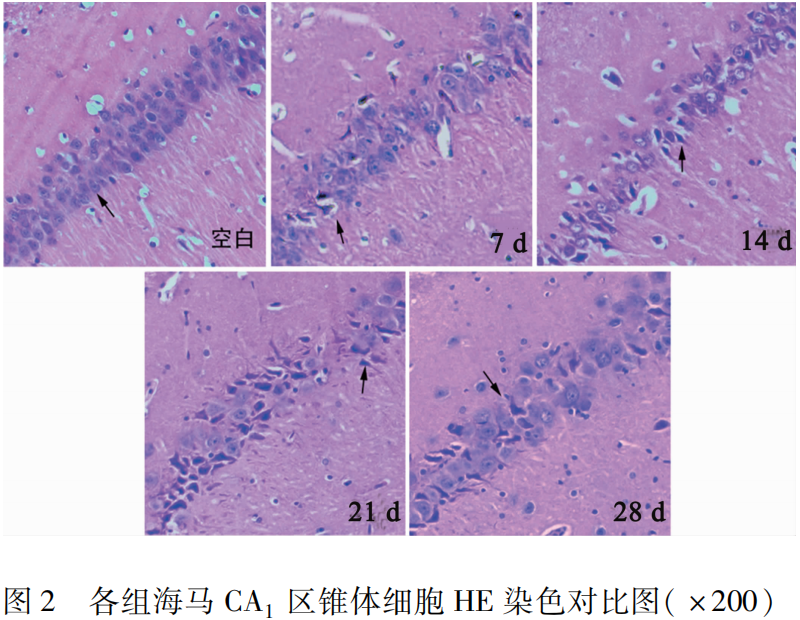
2.2 各组大鼠海马CA1区锥体细胞形态比较 在普通光学显微镜高倍镜下对照组海马CA1区锥体细胞呈多层整齐排列,可观察到细胞膜结构清晰完整,呈椭圆形,胞质均一染色,胞核明显呈深蓝色,中毒后7 d海马锥体细胞肿胀,且排列紊乱,细胞数目及层数减少,14 d、21 d、28 d细胞结构不清,细胞皱缩明显,胞浆浓缩呈深蓝色,核固缩、碎裂,甚至发生神经元变性坏死,结合水迷宫结果,可以表明大鼠在21 d时出现DEACMP(见图2)。
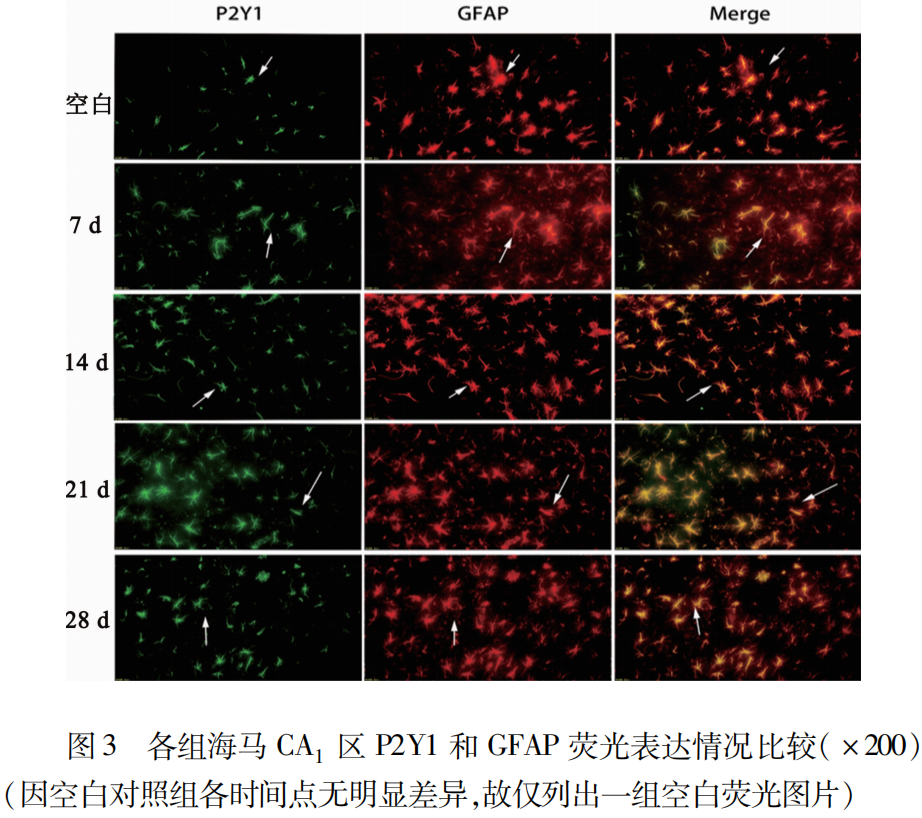
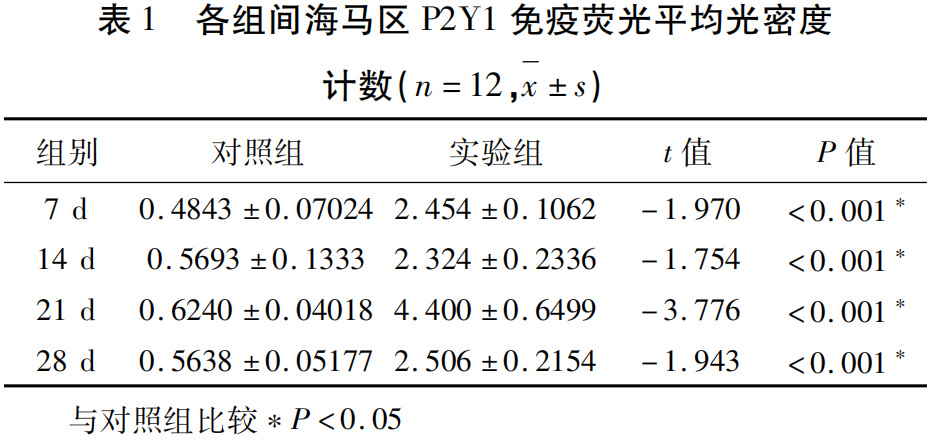
2.3 免疫荧光检测各组大鼠P2Y1和GFAP表达量比较 免疫荧光P2Y1(绿色)、GFAP(红色)及P2Y1+GFAP(黄色)双标结果(见图3)。免疫荧光结果显示,相对于空白对照组,中毒后的7 d、14 d、21 d、28 d海马CA1区P2Y1和GFAP都有表达上调,显著增多,且有统计学意义(P<0.05),各组间免疫荧光平均光密度计数对比(见表1~表3)。
2.4 Western blot检测各组大鼠P2Y1和GFAP蛋白表达量比较 P2Y1和GFAP在CO中毒各亚组的海马组织中的蛋白表达量均高于空白对照组(P<0.05),有统计学意义,在CO中毒组中P2Y1和GFAP的蛋白表达趋势为先逐渐升高后逐渐降低,但CO中毒各亚组间比较无明显统计学意义。实验截取的蛋白印记图(见图4、图5)。




3 讨论
DEACMP是急性CO中毒最为常见的并发症之一,该并发症包括学习和记忆等认知功能障碍,所以本实验在大鼠中毒前后进行水迷宫实验,去评估大鼠的认知功能是否发生改变,实验结果显示:大鼠的逃避期延长,说明在行为学上发生了DEACMP。有研究表明海马病变会导致认知功能障碍,同时发现CA1区的神经元病理改变最明显。所以我们通过HE分别观察中毒各亚组大鼠海马组织神经元的形态,发现与对照组相比,CO中毒组海马CA1区的锥体细胞发生病理改变(14 d、21 d最显著),结合病理学和行为学两方面从而去判断大鼠发生了DEACMP。大鼠海马区的神经元随着中毒天数的增加,其变形坏死程度也逐渐加重,这与水迷宫实验结果大致吻合,和临床上DEACMP的发病时间也相似。在成功造模的基础上,我们探究了P2Y1受体对星形胶质细胞的激活是否在DEACMP发病过程中产生了作用,分别通过细胞学层面、蛋白层面去检测大鼠海马区P2Y1和GFAP在急性CO中毒后的不同天数是如何变化的。结果表明与对照组相比,中毒各亚组的P2Y1和GFAP的各个层面的表达都有上调,从蛋白表达上看大致趋势为先逐渐升高后逐渐降低,在7 d~28 d之间有高峰出现,这些数据提示我们P2Y1受体介导的星形胶质细胞的激活可能与DAECMP的发生发展密切相关。
通过免疫荧光我们观察到星形胶质细胞从胞体分出许多细长突触,呈星形,它是神经元之间进行信号交换的积极参与者,具有重要的管家功能,如缓冲细胞外空间多余的钾和神经递质,维持血脑屏障,为神经元提供必要的营养,并在突触周围提供结构支持。当中枢神经系统受损时,炎症因子可以诱导反应性星形胶质细胞之间形成紧密连接的屏障,限制疾病严重程度的进展。近年来星形胶质细胞的激活与认知障碍的关系已成为研究热点。缺血性卒中可导致长期运动和认知功能缺陷,有研究表明星形胶质细胞在缺血性卒中中具有双重作用,活化的星形胶质细胞提供神经保护并有助于神经恢复,但也分泌炎症调节剂,导致缺血性病变加重。阿尔茨海默病(AD)进展期间,在转基因AD小鼠模型中反复皮下施用NLY01可阻断小胶质细胞介导的反应性星形胶质细胞转化并保留神经元活力,从而改善空间学习和记忆。Liddelow等人提出星形胶质细胞分为两种亚型(A1、A2),A1型诱导神经元和少突胶质细胞凋亡;A2型则具有促进神经元存活、生长、突触形成和吞噬的能力,并表明A1星形胶质细胞在各种人类神经退行性疾病中含量丰富,包括阿尔茨海默病、亨廷顿病和帕金森病、肌萎缩侧索硬化症和多发性硬化症。
本研究中,我们发现在DEACMP大鼠模型中,CO中毒组大鼠海马区星形胶质细胞上调,这种现象可以至少持续到中毒后的第28天,同时随着时间进展发生了认知功能障碍,这些结果表明在海马区大量积累了星形胶质细胞,活化的星形胶质细胞可能在DEACMP的发展过程中起到了一定作用。
星形胶质细胞膜表面表达多种神经递质转运蛋白和受体,使其感知和响应突触活动,其中就包括P2Y受体,P2Y受体是三磷酸腺苷(ATP)等核苷酸的生理性受体,而ATP介导短期钙信号事件和胶质细胞的长期增殖、分化和死亡。当中枢神经系统(central nervous systenm,CNS)受到缺血应激时,诱导ATP上调使P2受体/蛋白激酶级联被激活,导致胶质细胞的晚期反应,包括星形胶质细胞的增殖(胶质瘢痕)和少突胶质细胞的白质脱髓鞘。神经系统疾病多会导致认知缺陷,有研究通过使用P2Y1基因敲除的小鼠进行局灶性缺血造模,其结果表明神经胶质细胞上的P2Y1受体参与海马炎症反应。已有众多研究表明,P2Y1R可以介导星形胶质细胞对CNS产生有利或有害的作用。Wellmann等人在癫痫大鼠模型中通过使用MRS2179 阻断P2Y1R通过降低慢速Ca2+瞬变的频率来减少星形胶质细胞Ca2+振荡的平均持续时间,使癫痫症状得到改善。紧随其后,Martorell等人也通过使用特异性拮抗剂MRS2179抑制嘌呤能P2Y1受体,逆转了癫痫导致的损伤,得出结论:P2Y1R抑制挽救了星形胶质细胞Ca2+的模式以及癫痫患者海马中CA3~CA1突触的活性和可塑性,提示星形胶质细胞可能参与了导致突触可塑性恶化,从而导致癫痫患者认知能力下降的机制。Guo等人通过体外培养大鼠皮质星形胶质细胞,使用P2Y1R拮抗剂显著减轻钙信号通路对氧和葡萄糖剥夺诱导的星形胶质细胞损伤。与此同时在同样为认知障碍性疾病的阿尔兹海默病中也发现了阻滞P2Y1受体可以使星形胶质细胞正常化和学习记忆功能得到改善。Shi等人发现在AD的后期阶段,P2Y1嘌呤受体在AppNL-F/NL-F 小鼠的CR细胞和星形胶质细胞中“上调”并强烈表达,并认为通过调节上调的嘌呤受体系统来纠正抑制性内稳态的破坏,可能作为一种AD的新的治疗策略。以上众多研究得到的结论提示我们P2Y1对星形胶质细胞的激活对机体的作用成双刃剑,在一定程度上起到保护作用,如果超过限度可能就会产生损害。
本研究采用静态吸入法进行DEACMP造模,此造模方法符合现实生活中CO中毒过程,与腹腔注射法相比更具代表性,奠定了本实验成功的基础,通过实验我们发现大鼠急性CO中毒后不同天数(7 d、14 d、21 d、28 d)其海马区P2Y1R和星型胶质细胞与空白组相比表达均增高,Western blot结果提示,CO中毒组P2Y1受体与星型胶质细胞蛋白表达均上调,且与对照组相比均有统计学意义;免疫荧光结果同样证实GFAP与P2Y1受体与空白组相比显著增加,也具有统计学意义,所有实验方法的CO中毒组间均无统计学意义,这些结果提示我们CO中毒后启动P2Y1受体途径去激活星型胶质细胞活化,可能参与了DEACMP的发生发展。我们前期研究证实CO中毒后星型胶质细胞及其下游的炎症因子(TNF-α、IL-b、IL-6)的浓度显著升高,且与对照组相比有统计学差异。
有研究提出星型胶质细胞参与的免疫炎症反应是多种退行性疾病的认知障碍病理过程的重要环节,表现为星型胶质细胞活化和其分泌的炎症因子水平增高。在一定的程度上CNS受到损伤时会启动免疫炎症反应激活星型胶质细胞产生炎症因子去修复神经元,但如果持续作用就会反应过度加剧神经元坏死,导致脱髓鞘、神经炎症因子累积及细胞坏凋亡。之前,尚未有人研究P2Y1受体介导星型胶质细胞在DEACMP中如何发挥作用,在此根据实验结论我们猜想在中毒后P2Y1受体与星型胶质细胞持续表达(直到28 d),其下游炎症因子不断累积作用于神经元,可能会加剧神经元的损伤甚至凋亡使认知功能受损最终导致DEACMP的发生,但本实验未检测中毒7 d之前P2Y1和GFAP是如何表达的,其前期是否起到了保护作用有待我们接下来进一步验证。
4 结论与展望
我们得出的结论是P2Y1受体及星型胶质细胞与DEACMP的发生发展具有相关性。本研究初步探索了P2Y1受体介导星型胶质细胞在DEACMP中的表达变化,旨在为DEACMP病理机制提供一些新思路。因本实验时间有限仍存在许多不足,我们后续将会深入探索该通路的具体作用机制。本研究未检测CO中毒后7 d内各蛋白表达水平,后续将会把时间细分研究其各时间点的变化及产生何种作用;同时,我们计划使用P2Y1受体拮抗剂去进一步验证P2Y1受体介导星型胶质细胞能否导致DEACMP的发生;我们希望在该实验的基础上,进行星型胶质细胞体外培养,有针对性地观察其下游因子的浓度变化;最后我们希望通过研究进一步阐明DEACMP的病理机制,为临床DEACMP的治疗提供新的理论依据,以更好地防止DEACMP的发生。
参考文献
[1]Huang YQ,Peng ZR,Huang FL,et al.Mechanism of delayed encephalopathy after acute carbon monoxide poisoning[J].Neural Regen Res,2020,15(12):2286-2295.
[2]Zhang P,Dai Y,Xiong J,et al.iTRAQ-based differential proteomic analysis of the brains in a rat model of delayedcarbon monoxide encephalopathy[J].Brain Res Bull,2018,137:329-337.
[3]Rose JJ,Wang L,Xu Q,et al.Carbon monoxide poisoning:pathogenesis,management,and future directions of therapy[J].Am J Respir Crit Care Med,2017,195(5):596-606.
[4]Xiang W,Yang Z,Xue H,et al.P2Y12 receptor-mediated microglia activation involved in delayed encephalopathy after acute carbon monoxide poisoning[J].Aging (Albany NY),2021,13(4):6134-6143.
[5]Juric DM,Suput D,Brvar M.Hyperbaric oxygen preserves neurotrophic activity of carbon monoxide-exposed astrocytes[J].Toxicol Lett,2016,253:1-6.
[6]Zhao N,Liang P,Zhuo X,et al.After treatment with methylene blue is effective against delayed encephalopathy after acute carbon monoxide poisoning[J].Basic Clin Pharmacol Toxicol,2018,122(5):470-480.
[7]Lananna BV,McKee CA,King MW,et al.Chi3l1/YKL-40 is controlled by the astrocyte circadian clock and regulates neuroinflammation and Alzheimer’s disease pathogenesis[J].Sci Transl Med,2020,12(574):eaax3519.
[8]Kofuji P,Araque A.G-protein-coupled receptors in astrocyte-neuron communication[J].Neuroscience,2021,456:71-84.
[9]Xie L,Zhang N,Zhang Q,et al.Inflammatory factors and amyloid β-induced microglial polarization promote inflammatory crosstalk with astrocytes[J].Aging (Albany NY),2020,12(22):22538-22549.
[10]Bozdemir E,Vigil FA,Chun SH,et al.Neuroprotective roles of the adenosine A3 receptor agonist AST-004 in mouse model of traumatic brain injury[J].Neurotherapeutics,2021,18(4):2707-2721.
[11]Reichenbach N,Delekate A,Breithausen B,et al.P2Y1 receptor blockade normalizes network dysfunction and cognition in an Alzheimer’s disease model[J].J Exp Med,2018,215(6):1649-1663.
[12]Ochi S,Abe M,Li C,et al.The nicotinic cholinergic system is affected in rats with delayed carbon monoxide encephalopathy[J].Neurosci Lett,2014,569:33-37.
[13]Kiljan S,Prins M,Baselmans BM,et al.Enhanced GABAergic immunoreactivity in hippocampal neurons and astroglia of multiple sclerosis patients[J].J Neuropathol Exp Neurol,2019,78(6):480-491.
[14]Mora P,Hollier PL,Guimbal S,et al.Blood-brain barrier genetic disruption leads to protective barrier formation at the Glia Limitans[J].PLoS Biol,2020,18(11):e3000946.
[15]Lananna BV,McKee CA,King MW,et al.Chi3l1/YKL-40 is controlled by the astrocyte circadian clock and regulates neuroinflammation and Alzheimer’s disease pathogenesis[J].Sci Transl Med,2020,12(574):eaax3519.
[16]Kiljan S,Prins M,Baselmans BM,et al.Enhanced GABAergic immunoreactivity in hippocampal neurons and astroglia of multiple sclerosis patients[J].J Neuropathol Exp Neurol,2019,78(6):480-491.
[17]Xue M,Yong VW.Neuroinflammation in intracerebral haemorrhage:immunotherapies with potential for translation[J].Lancet Neurol,2020,19(12):1023-1032.
[18]Patabendige A,Singh A,Jenkins S,et al.Astrocyte activation in neurovascular damage and repair following ischaemic stroke[J].Int J Mol Sci,2021,22(8):4280.
[19]Park JS,Kam TI,Lee S,et al.Blocking microglial activation of reactive astrocytes is neuroprotective in models of Alzheimer’s disease[J].Acta Neuropathol Commun,2021,9(1):78.
[20]Liddelow SA,Guttenplan KA,Clarke LE,et al.Neurotoxic reactive astrocytes are induced by activated microglia[J].Nature,2017,541(7638):481-487.
[21]Maller CE,Baqi Y,Namasivayam V.Agonists and antagonists for purinergic receptors[J].Methods Mol Biol,2020,2041:45-64.
[22]Burnstock G.An introduction to the roles of purinergic signalling in neurodegeneration,neuroprotection and neuroregeneration[J].Neuropharmacology,2016,104:4-17.
[23]Chin Y,Kishi M,Sekino M,et al.Involvement of glial P2Y receptors in cognitive deficit after focal cerebral stroke in a rodent model[J].J Neuroinflammation,2013,10:95.
[24]Wellmann M,alvarez-Ferradas C,Maturana CJ,et al.Astroglial Ca2+dependent hyperexcitability requires P2Y1 purinergic receptors and pannexin-1 channel activation in a chronic model of epilepsy[J].Front Cell Neurosci,2018,12:446.
[25]Martorell A,Wellmann M,Guiffa F,et al.P2Y1 receptor inhibition rescues impaired synaptic plasticity and astroglial Ca2+-dependent activity in the epileptic hippocampus[J].Neurobiol Dis,2020,146:105132.
[26]Guo H,Liu ZQ,Zhou H,et al.P2Y1 receptor antagonists mitigate oxygen and glucose deprivation-induced astrocyte injury[J].Mol Med Rep,2018,17(1):1819-1824.
[27]Shi A,Petrache AL,Shi J,et al.Preserved calretinin interneurons in an app model of Alzheimer’s disease disrupt hippocampal inhibition via upregulated P2Y1 purinoreceptors[J].Cereb Cortex,2020,30(3):1272-1290.
[28]Liu Y,Zhang Y,Zheng X,et al.Galantamine improves cognition,hippocampal inflammation,and synaptic plasticity impairments induced by lipopolysaccharide in mice[J].J Neuroinflammation,2018,15(1):112.
[29]董 渊,李晓恒,侯 琳,等.先天免疫受体介导的神经炎症在神经系统疾病中的作用[J].中国药理学与毒理学杂志,2017,31(11):1075-1083.


