Circulation 兰峰和王永明团队采用碱基编辑技术治疗遗传性心律失常
时间:2023-11-18 21:19:26 热度:37.1℃ 作者:网络
心源性猝死(Sudden cardiac death, SCD)是目前导致死亡的重要原因之一。据国家心血管中心统计,我国每年心源性猝死者高达55万,而我国心脏骤停的抢救成功率却不到1%。其中,约12-20%的心源性猝死是由遗传性心律失常导致的1。遗传性心律失常是指由于编码心脏离子通道蛋白的基因发生了致病性突变,导致离子通道蛋白的功能发生异常而引发的一系列心脏病理改变,包括长QT综合征、Brugada综合征等常见疾病2。近年来研究提示,治疗遗传性心律失常最有希望的策略是利用基因编辑工具直接消除致病性突变,从而达到治愈疾病的目的3。
碱基编辑器(BEs)是当前最安全、有效的基因编辑工具。阜外医院兰峰团队是国内心脏病基因治疗技术的主要推动者,在国际上率先采用了BE对肥厚性心肌病的致病基因进行修正,实现了胚胎阶段的有效治疗,并发育出心脏完全正常的小鼠(Circulation Research 2021 兰峰教授团队采用碱基编辑技术治疗心肌病取得突破)4,这一成果得到了Nature Review Cardiology专文评述的高度评价5。随后,同样的策略被美国西南医学中心的Eric Olson和哈佛大学的Christine Seidman团队用于成体阶段肥厚性心肌病治疗6,7,两项研究引用了该成果并发表在同期的Nature Medicine。
此外,为了更好的实现心脏疾病的基因编辑治疗,兰峰团队还开发了基因编辑效率预测系统(Nature Communication 2019)、小型化的高特异性基因编辑器Cas12j (Science Advances 2023)和工程化外泌体mRNA递送方法(Nature Biomedical Engineering 2023)。但到目前为止,还没人利用碱基编辑器进行遗传性心律失常治疗的探索。
2023年11月15日,中国医学科学院阜外医院兰峰教授和复旦大学王永明教授团队,在Circulation在线发表了题为“In vivo base editing of Scn5a rescues type 3 long QT syndrome in mice”的文章。该研究以编码心脏钠通道α亚基(Nav1.5)的Scn5a基因作为靶点,提出了一种全面的靶点可编辑性筛选策略。针对被筛选出的Scn5a致病性突变(Scn5ap.T1307M),利用碱基编辑器ABE可在体实现Scn5a突变转录本的完全阻断。结果显示,Scn5a mRNA的在体修正率高达99.20%,并可完全纠正小鼠心律失常的表型。

体细胞基因编辑的效率受到编辑工具、编辑位点以及递送工具等的影响,为了筛选可高效修正的致病位点,不同于以往研究针对现成的突变动物模型,本研究建立了一套基于靶点修正效率的筛选策略。研究以Scn5a基因和ABEmax为对象,首先对野生型Scn5a基因位点的可编辑性进行了探究。结果显示,位点的在体可编辑性与体外细胞可编辑性高度一致,即高编辑效率的位点在体内外均能被高效编辑。基于此,研究者首先尝试探究哪些SCN5A致病突变可实现有效的在体修正。作者从240个SCN5A致病变异(ClinVar)中选择了16个符合ABE编辑条件的突变,同时将这些人源突变对应转换为鼠源性突变,并建立携带该鼠源性突变的细胞系。细胞筛选结果显示,所有16个鼠源性突变都能被ABE修正,但DNA修正效率从5.00 ± 1.72%到39.33 ± 6.66%不等。
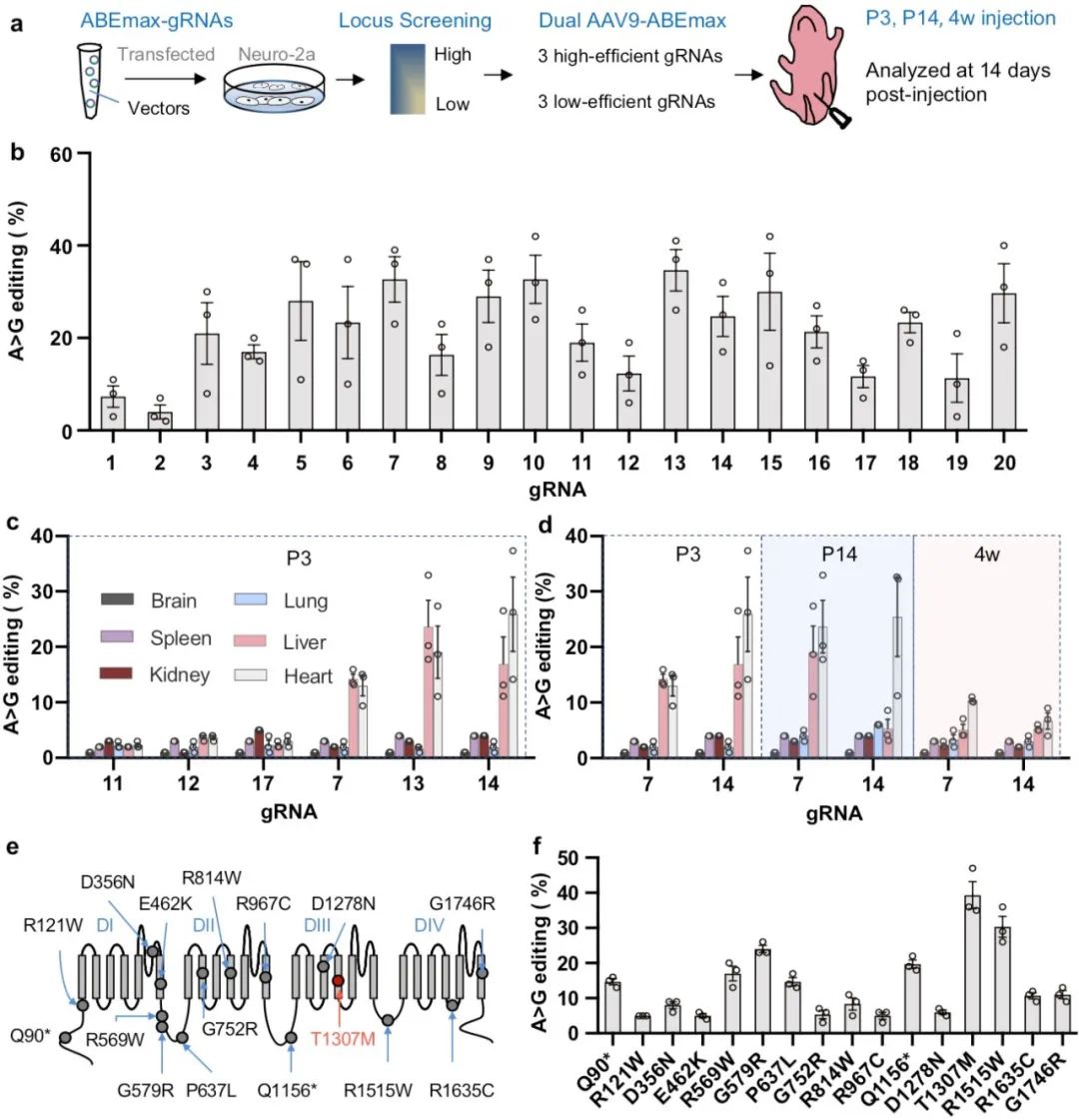
随后,作者选择具有最高编辑效率的Scn5a p.T1307M突变构建了长QT综合征3 (LQT3)小鼠模型。Scn5a T1307M小鼠具有LQT3患者典型的心电图特点,即QT和校正QT (QTc)延长。此外,在给予卡巴胆碱降低小鼠心率后,可增加杂合或纯合T1307M小鼠心脏窦性停搏的发生;同时卡巴胆碱可诱导纯合T1307M小鼠产生室性心动过速。
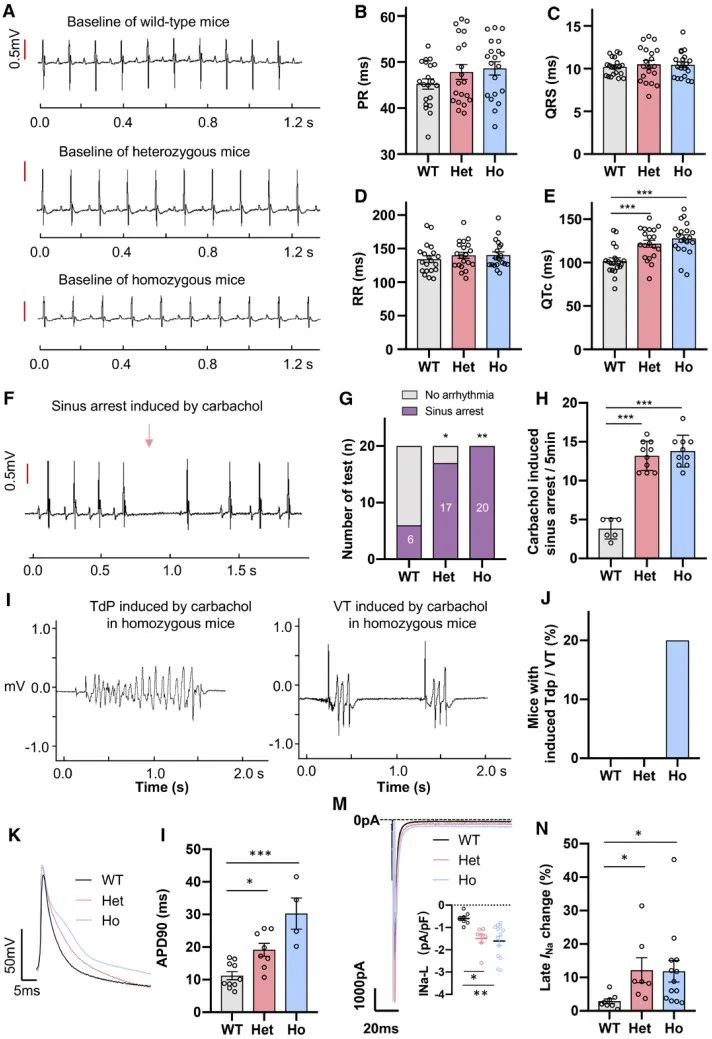
为了探究ABE在体实现Scn5a T1307M修正的可行性,作者利用装载了ABE的双AAV9递送系统对T1307M突变进行修正。在单次腹腔注射AAV9-ABE病毒后,在小鼠心脏中实现了最高99.20%的Scn5a转录本修正。AAV9-ABE单次治疗可以缩短T1307M小鼠的QT间期,并减少了窦性停搏。同时,在纯合突变小鼠中,ABE治疗还防止了室性心动过速的发生。
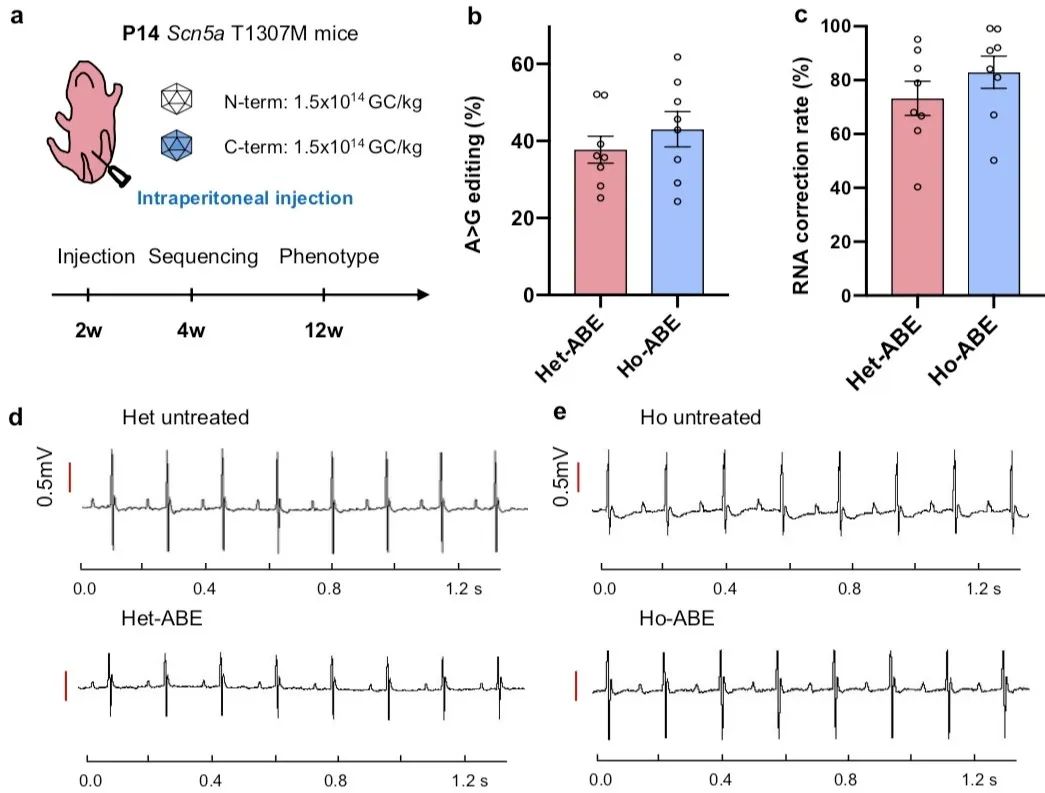
在治疗过程中,研究者观测到单次AAV9-ABE注射后,突变基因的修正效率存在差异。为了探究在体消除LQT3表型的最佳T1307M突变修正率,研究者向新生14天的杂合T1307M小鼠腹腔注射一定量的AAV9-ABE病毒。注射10周后,研究者观察到T1307M mRNA的修正率从23.29%到95.72%不等。将mRNA修正率与QT、QTc间期以及窦性停搏次数等观察数据进行相关性分析,结果显示QT、QTc间期以及卡巴胆碱诱导的窦性停搏次数随着mRNA校正率的增加而下降。当mRNA的修正率超过60%时,可完全消除杂合T1307M小鼠心律失常的表型。在治疗组的纯合T1307M小鼠中也观察到了同一现象。同时,在所有编辑效率高于20%的纯合T1307M小鼠中,单次ABE治疗都可实现致命室性心动过速的消除。由于ABE编辑会引起心脏中产生部分Scn5a基因型修复的心肌细胞混杂于未修复的细胞,这种人为造成的基因型嵌合状态是否对整体心脏电生理稳定性造成影响尚不明确。本研究的结果表明针对心肌细胞的基因编辑治疗对于电生理功能表型是有效和安全的。

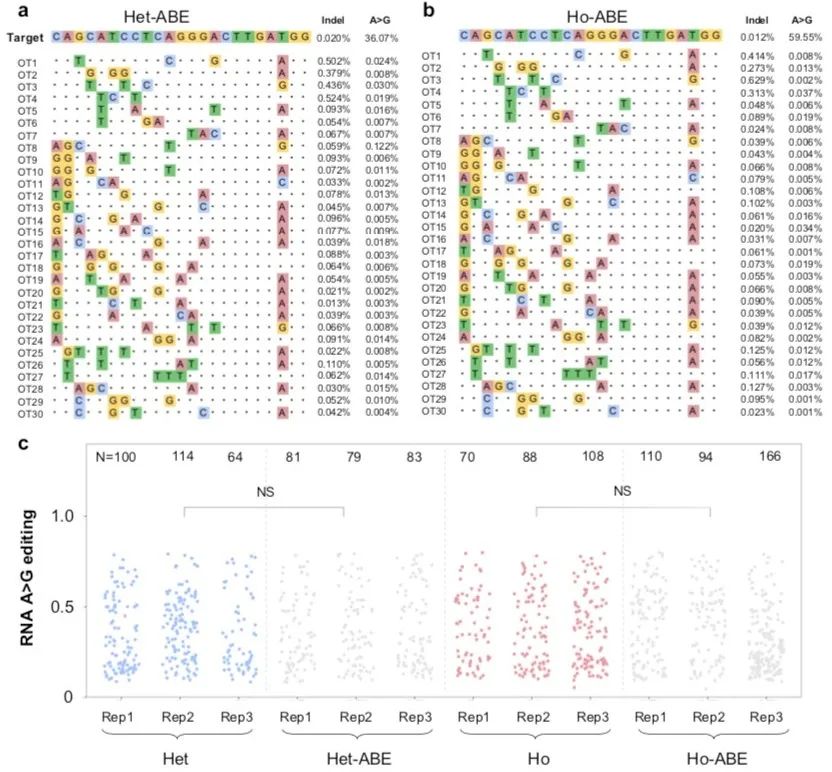
为了评估ABE心脏治疗的安全性,研究者对编辑后的心脏DNA进行全转录组测序,测序结果并未发现明显的DNA或RNA脱靶。
该研究在心脏基因编辑治疗领域取得了突破:1.在靶点预测的基础上,单次AAV载体治疗即可完全清除突变mRNA,从而根本性阻断致病基因带来的表型改变;2.高于阈值(20%)的基因编辑即可消除致死性心律失常,表明部分心肌细胞的恢复正常即可带来显著的获益。

中国医学科学院阜外医院兰峰教授与复旦大学王永明教授为共同通讯作者;兰峰教授课题组博士后齐曼、马树红以及复旦大学王永明教授课题组博士生刘靓童为本文共同第一作者。该研究得到国家自然科学基金、北京市自然科学基金、国家重点研发计划、中国医学科学院医学科学创新基金、中国医学科学院非营利性中央研究院基金、深圳市基础研究项目、国家高水平医院临床研究基金、中国博士后科学基金等课题的资助。
参考文献:
1. Bezzina CR, Lahrouchi N and Priori SG. Genetics of sudden cardiac death. Circ Res. 2015;116:1919-1936.
2. Offerhaus JA, Bezzina CR and Wilde AAM. Epidemiology of inherited arrhythmias. Nat Rev Cardiol. 2020;17:205-215.
3. Pan X, Philippen L, Lahiri SK, Lee C, Park SH, Word TA, Li N, Jarrett KE, Gupta R, Reynolds JO, Lin J, Bao G, Lagor WR and Wehrens XHT. In Vivo Ryr2 Editing Corrects Catecholaminergic Polymorphic Ventricular Tachycardia. Circ Res. 2018;123:953-963.
4. Ma S, Jiang W, Liu X, Lu WJ, Qi T, Wei J, Wu F, Chang Y, Zhang S, Song Y, Bai R, Wang J, Lee AS, Zhang H, Wang Y, Lan F. Efficient Correction of a Hypertrophic Cardiomyopathy Mutation by ABEmax-NG. Circ Res. 2021;129:895-908.
5. Lim GB. Adenine base editing in mouse embryos to correct HCM. Nat Rev Cardiol. 2021 Dec;18(12):807.
6. Chai AC, Cui M, Chemello F, Li H, Chen K, Tan W, Atmanli A, McAnally JR, Zhang Y, Xu L, Liu N, Bassel-Duby R, Olson EN. Base editing correction of hypertrophic cardiomyopathy in human cardiomyocytes and humanized mice. Nat Med. 2023;9:401-411.
7. Reichart D, Newby GA, Wakimoto H, Lun M, Gorham JM, Curran JJ, Raguram A, DeLaughter DM, Conner DA, Marsiglia JDC, Kohli S, Chmatal L, Page DC, Zabaleta N, Vandenberghe L, Liu DR, Seidman JG, Seidman C. Efficient in vivo genome editing prevents hypertrophic cardiomyopathy in mice. Nat Med. 2023;29:412-421.


