【佳作推荐】McMaster大学Stokes小组和麻省理工学院Collins小组NCB论文:深度学习指导窄谱抗生素设计
时间:2023-11-18 21:37:08 热度:37.1℃ 作者:网络
鲍曼不动杆菌(Acinetobacter baumannii,Ab)是一种极易产生耐药性的条件致病菌,广泛分布于医院环境。近年来,Ab的耐药性和感染率不断上升,已成为抗感染领域的重大挑战。传统的抗生素研发方法难以有效抑制Ab的耐药性扩散,且广谱抗生素的使用往往会加剧耐药性问题。因此,使用新方法寻找新型窄谱抗生素是一种可行的解决方案。
为了解决鲍曼不动杆菌的感染及耐药问题,McMaster大学的Stokes小组和麻省理工学院的Collins小组利用深度学习技术,从大规模的化合物数据库中筛选出可能的候选物,并通过实验验证其抗菌活性和作用机制。近日,该项研究工作发表在Nature Chemical Biology期刊(Nat. Chem. Biol 2023, 19, 1342–1350)。该研究展示了深度学习在探索新型抗生素方面的潜力,为解决Ab耐药问题提供了新的思路和方法。
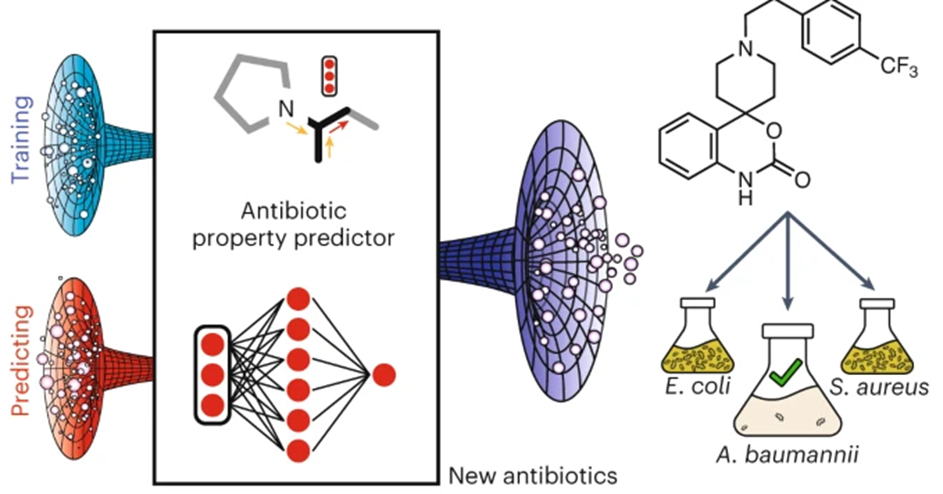
研究人员首先从大规模的化合物数据库中选择了7684个分子,在Luria-Bertani(LB)培养基中以50 μM浓度测试了它们对鲍曼不动杆菌ATCC 17978的生长抑制效果。根据实验结果,他们构建了一个包含480个活性分子和7204个非活性分子的数据集,用作深度学习模型的训练数据。进而,研究人员使用了一种基于定向消息传递的神经网络模型,将分子结构转换为连续的向量表示。简单来说,模型每次迭代传递局部化学信息,对局部信息进行求和后,结合RDKit计算的全局分子特征,作为预测网络的输入向量。他们还使用了一种集成学习的方法,综合十个不同的分类器的预测结果,提高了模型的鲁棒性和准确性。该模型能够为每个分子输出一个预测分数,表示其对鲍曼不动杆菌的生长抑制概率。
根据模型的预测分数,研究人员从数据库中挑选出了240个可能具有抗菌性和结构特异性的分子,即预测分数大于0.2且与训练数据集中活性分子的谷本相似系数小于0.3的分子。研究人员再次在LB培养基中以50 μM浓度进行了实验验证,发现其中9个分子能够达到80%的生长抑制率,证明了模型的有效性。同时,研究人员还测试了预测分数最低的240个分子,发现它们都没有抗菌活性,表明模型对于不同分子的结构和功能具有较强的判别能力。
为了进一步筛选出具有结构特异性和抗菌活性的分子,作者对9个活性分子进行了详细的分析,排除了以下三类分子:(1)与已知的抗生素或其他活性分子结构高度相似的分子;(2)文献中已报道的分子;(3)可能通过破坏细胞膜的非特异性方式杀死细菌的分子。经过筛选,作者最终得到了两个分子,分别命名为abaucin和serdemetan。这两个分子能够在较低的浓度下抑制鲍曼不动杆菌ATCC 17978的生长,abaucin的最低抑菌浓度(MIC)约为2 μg/ml,serdemetan的MIC约为32 μg /ml。
研究人员选择了abaucin作为后续研究对象,转录组分析结果表明,abaucin能够干扰鲍曼不动杆菌的生长和分裂过程,从而达到抗菌效果。同时,该研究还通过细胞膜渗透性实验证明,abaucin不会通过破坏细胞膜的完整性来杀死细菌。
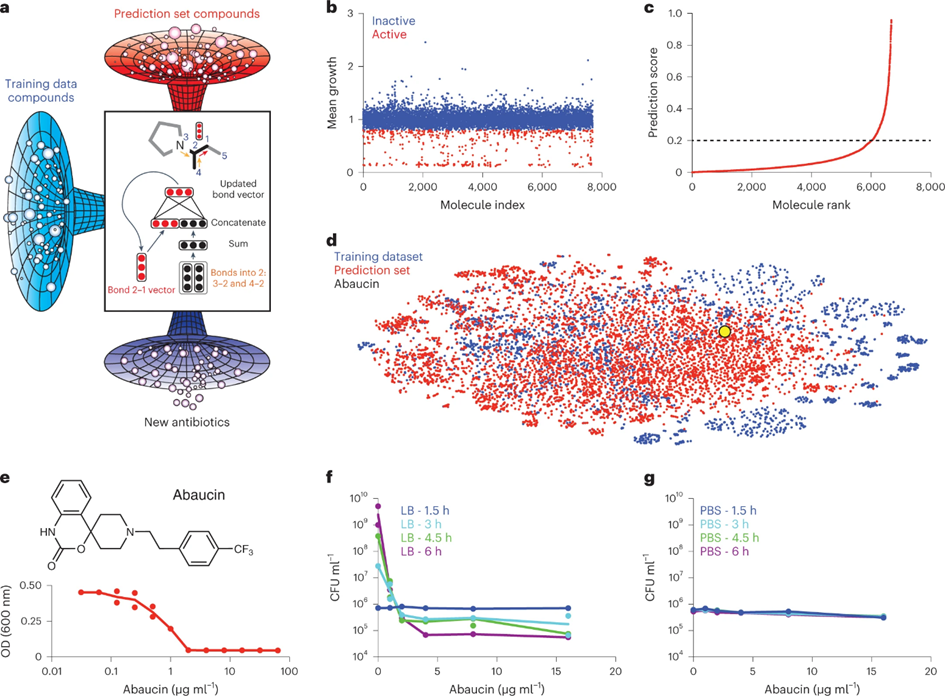
图-1:深度学习指导的新型窄谱抗生素发现过程及abaucin的生物活性数据
为了探索abaucin的抑菌范围,研究人员进一步对鲍曼不动杆菌的临床分离株和其他菌株(如铜绿假单胞菌、金黄色葡萄球菌等)的抗菌效果进行了测试。结果表明,abaucin针对多种固有耐药和获得性耐药的鲍曼不动杆菌耐药株均有效。针对其他菌株的实验结果证明abaucin具有窄谱的抗菌活性,该特点有利于减少抗生素对正常菌群的影响,保持微生物环境的平衡。为了验证这一点,研究人员使用人体肠道和皮肤的共生菌进行测试,发现abaucin对这些菌株的抑制效果很弱,不会破坏人体的微生物群。
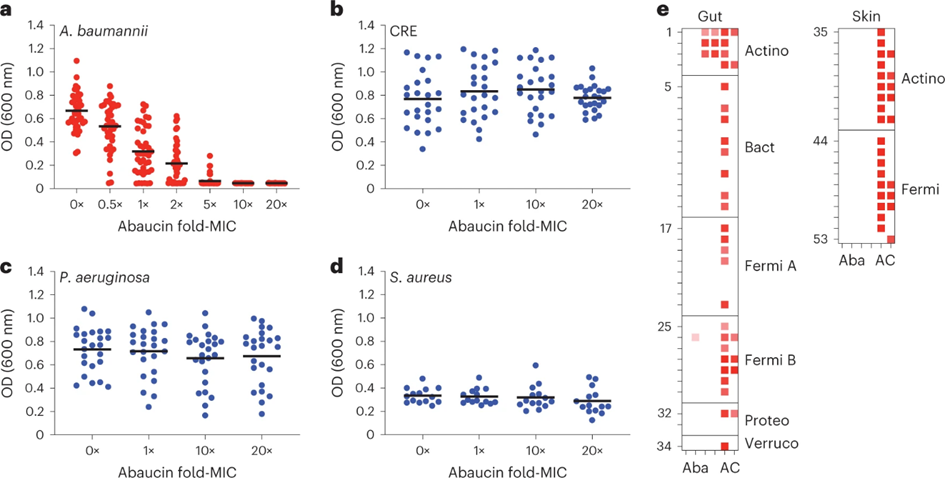
图-2:abaucin具有窄谱的抗生素活性
在后续实验中,研究人员对abaucin的抑菌机制进行研究。首先对4个abaucin耐药株进行了全基因组测序,发现了突变位点位于LolE基因或其上游区域。LolE是一种位于细胞内膜的蛋白质,参与脂蛋白的运输过程,是革兰阴性菌抗生素的重要靶标。研究人员推测,abaucin可能通过干扰LolE的功能,影响脂蛋白的运输,从而达到抗菌效果。其次,研究人员通过转录组分析的方法,对abaucin处理的鲍曼不动杆菌的基因表达进行研究,发现abaucin能够显著下调与脂蛋白运输相关的基因表达。再次,作者使用了脂蛋白运输缺失的大肠杆菌模型作为对照,进一步证实abaucin通过干扰脂蛋白的运输过程发挥抗菌效果。最后,为了评估abaucin的体内抗菌效果和安全性,作者建立了鲍曼不动杆菌ATCC 17978引起的小鼠皮肤伤口感染模型。研究发现,abaucin能够有效抑制鲍曼不动杆菌的多种多重耐药临床分离株在小鼠伤口中的生长,有效减缓感染的严重程度。
在未来的研究中,作者提出了以下几个可能的优化方向:(1)扩大鲍曼不动杆菌抗生素的训练数据集,提高模型的预测准确性;(2)扩大计算机化学筛选的文库,扩增模型可探索的化学空间;(3)使用多属性优化的模型,同时预测化合物的抗菌活性和毒性,增强模型的实用性。
在该项工作中,作者利用初步筛选结果构建了一个深度学习模型,然后从大规模化合物数据库中筛选出了一种具有窄谱抗菌性和结构特异性的新型抗生素abaucin。该化合物对鲍曼不动杆菌的最低抑菌浓度约为2 μg/ml,能够克服鲍曼不动杆菌的多种耐药机制,且不会破坏正常的微生物群。通过多种实验方法,研究人员揭示了abaucin的可能抗菌机制,即通过干扰脂蛋白的运输过程,抑制鲍曼不动杆菌的生长和分裂。在小鼠皮肤伤口感染的动物模型中,研究人员证明了abaucin的体内抗菌效果和安全性,为解决鲍曼不动杆菌耐药问题提供了新的思路和方法。
参考文献
[1] Liu, G., Catacutan, D.B., Rathod, K. et al. Deep learning-guided discovery of an antibiotic targeting Acinetobacter baumannii. Nat Chem Biol 19, 1342–1350 (2023).


