Circulation:兰峰/王永明团队合作采用碱基编辑技术治疗遗传性心律失常
时间:2023-11-21 16:27:20 热度:37.1℃ 作者:网络
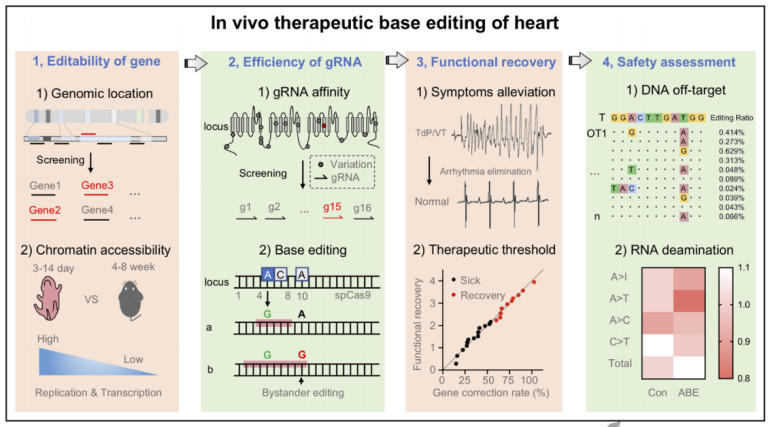
SCN5A的致病变异可导致3型长QT综合征,这是一种危及生命的遗传性疾病。腺嘌呤碱基编辑器可以将靶向的A - T碱基对转化为G - C碱基对,为纠正致病变异提供了一种有前途的工具。
2023年11月15日,中国医学科学院阜外医院兰峰教授和复旦大学王永明教授团队合作在Circulation在线发表题为“In Vivo Base Editing of Scn5a Rescues Type 3 Long QT Syndrome in Mice”的研究论文,该研究发现Scn5a的体内碱基编辑可拯救小鼠3型长QT综合征。纯合子和杂合子T1307M小鼠均表现出明显的QT延长。在纯合子T1307M小鼠(20%)中给药可引起点扭转或室性心动过速,而在杂合子或野生型小鼠中则无此现象。
在T1307M小鼠中,出生后第14天单次腹腔注射AAV9-ABEmax可纠正高达99.20%的Scn5a转录本。Scn5a mRNA校正率bbb60 %消除QT延长;Scn5a mRNA校正率<60%可缓解QT延长。部分Scn5a校正导致心肌细胞异质性,但并未引起严重的心律失常。研究人员没有在ABEmax处理的小鼠心脏中检测到脱靶DNA或RNA编辑事件。这些发现表明,在体内编辑AAV9-ABEmax可以纠正Scn5a等位基因变异,有效改善心律失常表型。该结果为遗传性心律失常的治疗提供了一个概念证明。

遗传性心律失常是一个重要的死亡原因,占心脏性猝死的12%至20%。编码心脏离子通道和相关蛋白的基因致病性变异(pv)可损害它们的转录、组装、运输和门控,导致长QT综合征(LQTS)类型(LQT1、LQT2和LQT3)、短QT综合征、Brugada综合征、儿茶酚胺能多态性室性心动过速、病态窦性综合征。虽然已经制定了预防心律失常和心源性猝死的策略,但它们往往会引起副作用。例如,β受体阻滞剂在LQTS中具有临床适应症。然而,心血管事件和猝死仍然时有发生因此,对于这种疾病的永久治愈治疗有一个重要的未满足的需求。到目前为止,最有希望预防遗传性心律失常的治疗策略是通过使用基因编辑工具直接靶向突变基因来消除遗传性遗传病变。
碱基编辑器,包括腺嘌呤碱基编辑器(ABEs)和胞嘧啶碱基编辑器,是潜在临床应用中最安全、最有效的基因编辑工具。它们是Cas9的镍酶版本与核碱基脱氨酶的融合。碱基编辑器使用CRISPR引导RNA (gRNA)与目标序列结合,并用化学方法将一个DNA碱基字母转变为另一个碱基字母。碱基编辑器可以潜在地纠正ClinVar数据库中47%的致病性单核苷酸多态性(G>A或T>C)。通过病毒或纳米颗粒递送碱基编辑器已经在几种动物模型中达到了治疗水平的编辑,包括小鼠和非人灵长类动物模型。先前使用ABEs纠正肥厚小鼠心脏中的Myh7 PV,突出了碱基编辑治疗疾病的巨大潜力。
机理模式图(图源自Circulation )
为了研究碱基编辑器是否可以治疗遗传性心律失常,研究人员选择了编码心脏钠通道α亚基(Nav1.5)的SCN5A基因作为靶标。SCN5A的PVs可导致LQT3、Brugada综合征、病态窦综合征、和心传导障碍。NM_000335.5 (SCN5A): c.3908C > T (p.Th1304met)错义变体用蛋氨酸取代SCN5A(钠通道蛋白5型亚单位α)蛋白密码子1304处的苏氨酸,这在LQTS患者中有报道。不同的研究表明,携带T1304M序列变体的患者在细胞中表现出QT增加和钠电流晚期。作者将该序列变异引入到Scn5a中,并建立了LQT3小鼠模型,该模型显示QT间期延长。
用全细胞膜片钳进一步检测了心肌细胞中的钠电流。结果显示,与野生型(WT)心肌细胞相比,Scn5a T1307M心肌细胞晚期钠电流密度增加。用双腺相关病毒(AAV)递送的ABE处理小鼠模型,在心脏转录水平上纠正高达99.20%的T1307M PV,并改善心律失常。这些结果表明,使用双AAV血清型9 (AAV9) - ABE递送系统进行基因编辑对于LQT3治疗是有希望的。
中国医学科学院阜外医院兰峰教授与复旦大学王永明教授为共同通讯作者;兰峰教授课题组博士后齐曼、马树红以及复旦大学王永明教授课题组博士生刘靓童为本文共同第一作者。该研究得到国家自然科学基金、北京市自然科学基金、国家重点研发计划、中国医学科学院医学科学创新基金、中国医学科学院非营利性中央研究院基金、深圳市基础研究项目、国家高水平医院临床研究基金、中国博士后科学基金等课题的资助。
原文链接:
https://doi.org/10.1161/CIRCULATIONAHA.123.065624


