临床研究|慢加急性肝衰竭:基于起病表现的新型临床分型特征及预后分析
时间:2023-11-28 21:29:06 热度:37.1℃ 作者:网络
慢加急性肝衰竭(ACLF)是在慢性肝病基础上,由各种诱因引起的急性肝功能失代偿,可合并一个或多个肝外器官功能衰竭,短期病死率高。目前东西方对于ACLF的定义和诊断标准尚未达成共识,主要差异表现在慢性肝病基础、病因及器官衰竭的类型等方面。
亚太肝病学会(APASL)将非肝硬化慢性肝病和代偿性肝硬化纳入ACLF,认为肝脏本身衰竭是诊断的核心,肝外器官衰竭为肝衰竭的继发事件,不应纳入定义中。中国《肝衰竭诊治指南(2018年版)》根据不同慢性肝病基础将ACLF分为A型(在慢性非肝硬化肝病基础上发生的ACLF)、B型(在代偿期肝硬化基础上发生的ACLF)和C型(在失代偿期肝硬化基础上发生的ACLF)。但不同慢性肝病基础与ACLF预后转归并非总是一致,且该指南基于专家共识,循证医学证据不足。欧洲肝病学会-慢性肝功能衰竭联盟(EASL-CLIF)将ACLF定义为肝硬化急性失代偿基础上出现的多脏器功能衰竭(包括肝、肾、脑、凝血、呼吸、循环系统),且伴有28天高病死率的复杂临床综合征。该定义未进行临床分型,根据器官衰竭的类型和数目将ACLF分为1~3级。北美终末期肝病研究联盟(NACSELD)将ACLF定义为肝硬化急性失代偿患者至少存在2种严重的肝外器官衰竭,包括休克、Ⅲ~Ⅳ级肝性脑病、肾脏替代治疗或机械通气。但符合EASL或NACSELD标准时,患者病情可能十分严重,不利于ACLF的早期诊治。美国胃肠病学会(ACG)综合以上定义,提出ACLF是发生在慢性肝病伴或不伴肝硬化患者中的一种潜在可逆性疾病,在缺乏基础肝病治疗、肝脏支持治疗或肝移植的情况下,可能导致多器官衰竭和3个月内死亡。ACLF通过慢性肝病、血清总胆红素升高和INR延长来识别,肾脏、循环、呼吸或脑功能衰竭的出现支持诊断的建立。
结合以上东西方ACLF疾病定义和临床特点,本研究根据ACLF起病时肝内、肝外器官衰竭特征,探索新型ACLF临床分型,分析不同分型患者的临床特征和适宜的预后评分系统,以制订个体化的诊治策略,合理优化医疗资源。
1资料与方法
1.1. 研究对象
收集2015年1月—2022年10月于首都医科大学附属北京佑安医院住院治疗的ACLF患者。纳入标准:在慢性肝病基础上,各种急性诱因下发生的肝衰竭,表现为黄疸(血清胆红素≥85 mmol/L)、凝血功能障碍(INR≥1.5,排除服用抗凝药物),慢性肝病包括非肝硬化慢性肝病、代偿性肝硬化、失代偿性肝硬化。排除标准:妊娠期女性;恶性肿瘤;存在严重的肝外器官基础疾病:慢性肾衰竭、严重心脑血管疾病、严重慢性阻塞性肺疾病合并呼吸衰竭、长期服用免疫抑制剂治疗患者。
1.2. 研究方法
收集ACLF患者的临床资料,包括年龄、性别、肝病基础、病因、实验室检查、并发症和受累脏器等信息,以及随访90天的预后情况。根据起病时肝内、肝外器官衰竭特征,将患者分为Ⅰ型和Ⅱ型ACLF。Ⅰ型ACLF为慢性肝病基础上的急性肝损伤,起病时受累脏器为肝脏,以黄疸和凝血功能障碍为主要表现,部分患者有Ⅰ~Ⅱ级肝性脑病。Ⅱ型ACLF为慢性肝病基础上发生肝功能急性失代偿,表现为血清胆红素升高、INR延长,1周内伴随至少1种肝外器官衰竭,包括肾、脑、呼吸系统和循环系统(器官功能衰竭的诊断依据EASL-CLIF标准)。根据患者的临床指标,计算MELD、MELD-Na和CLIF-C ACLF评分。
2结果
2.1. ACLF患者一般情况
本研究共纳入582例ACLF住院患者,中位年龄为47(38~54)岁,男性483例(83.0%),其中Ⅰ型535例(91.9%),Ⅱ型47例(8.1%)。基础肝病为慢性非肝硬化153例(26.3%)、代偿性肝硬化320例(55.0%)、失代偿性肝硬化109例(18.7%)。ACLF患者的病因以乙型肝炎和酒精性肝病为主,其余包括药物性肝损伤、原发性胆汁性胆管炎和自身免疫性肝炎等,针对不同病因给予抗HBV治疗、戒酒、停用肝损伤药物、酌情应用糖皮质激素等保肝、退黄内科综合治疗,部分患者给予人工肝治疗,部分患者进行肝移植。582例ACLF患者中位MELD评分为23.0(18.6~27.5)分,中位MELD-Na评分为24.7(20.1~31.2)分,中位CLIF-C ACLF评分为41.7(36.8~46.4)。患者28天和90天存活率分别为67.5%和51.5%,病死率分别为17.4%和29.6%,肝移植率分别为15.1%和18.9%(表1)。
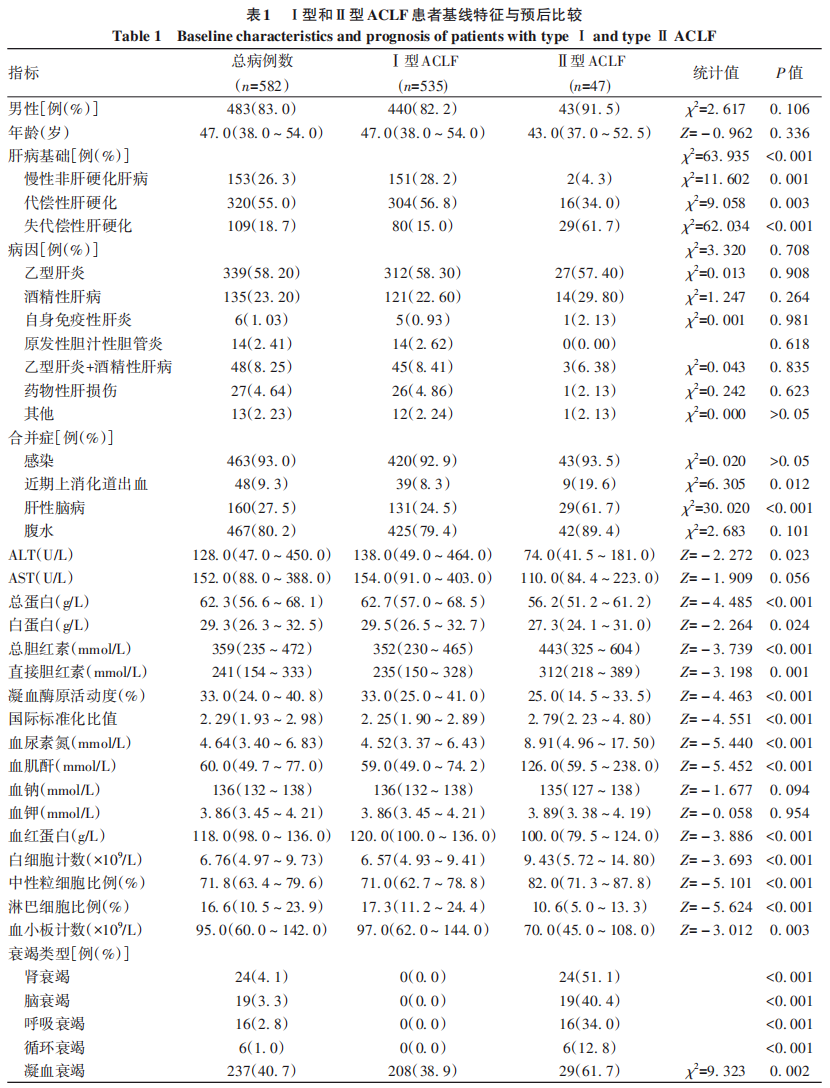
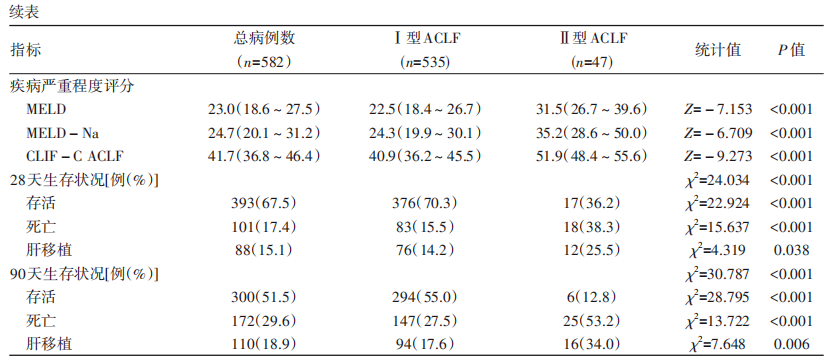
2.2. Ⅰ型和Ⅱ型ACLF患者基线特征与预后比较
Ⅰ型和Ⅱ型ACLF患者的性别、年龄均无统计学差异(P值均>0.05)。两组患者的病因均以乙型肝炎、酒精性肝病为主,差异均无统计学意义(P值均>0.05)。对于肝病基础,Ⅰ型ACLF以慢性非肝硬化肝病和代偿性肝硬化为主,Ⅱ型ACLF以代偿性肝硬化和失代偿性肝硬化为主,两组患者的肝病基础差异有统计学意义(P<0.001)。Ⅱ型ACLF患者发生上消化道出血和肝性脑病并发症的比例较Ⅰ型ACLF高,而且Ⅱ型ACLF患者的总蛋白、白蛋白、凝血酶原活动度、血红蛋白、血小板计数均低于Ⅰ型ACLF患者,总胆红素、直接胆红素、国际标准化比值、血尿素氮、血肌酐、白细胞计数、中性粒细胞比例均高于Ⅰ型ACLF患者,差异均有统计学意义(P值均<0.05),提示Ⅱ型ACLF患者肝损伤重于Ⅰ型,疾病更为严重。Ⅰ型ACLF患者起病时不合并肝外器官衰竭,Ⅱ型ACLF起病时同时合并肾衰竭(51.1%)或脑衰竭(40.4%)的患者居多,其次为呼吸衰竭(34.0%),循环衰竭患者较少(12.8%)。Ⅱ型ACLF患者的中位MELD、MELD-Na和CLIF-C ACLF评分均高于Ⅰ型,差异均有统计学意义(P值均<0.001)(表1)。
从预后来看,Ⅰ型ACLF患者28天和90天存活率高于Ⅱ型、病死率低于Ⅱ型、肝移植率低于Ⅱ型,差异均有统计学意义(P值均<0.05)(表1、图1)。
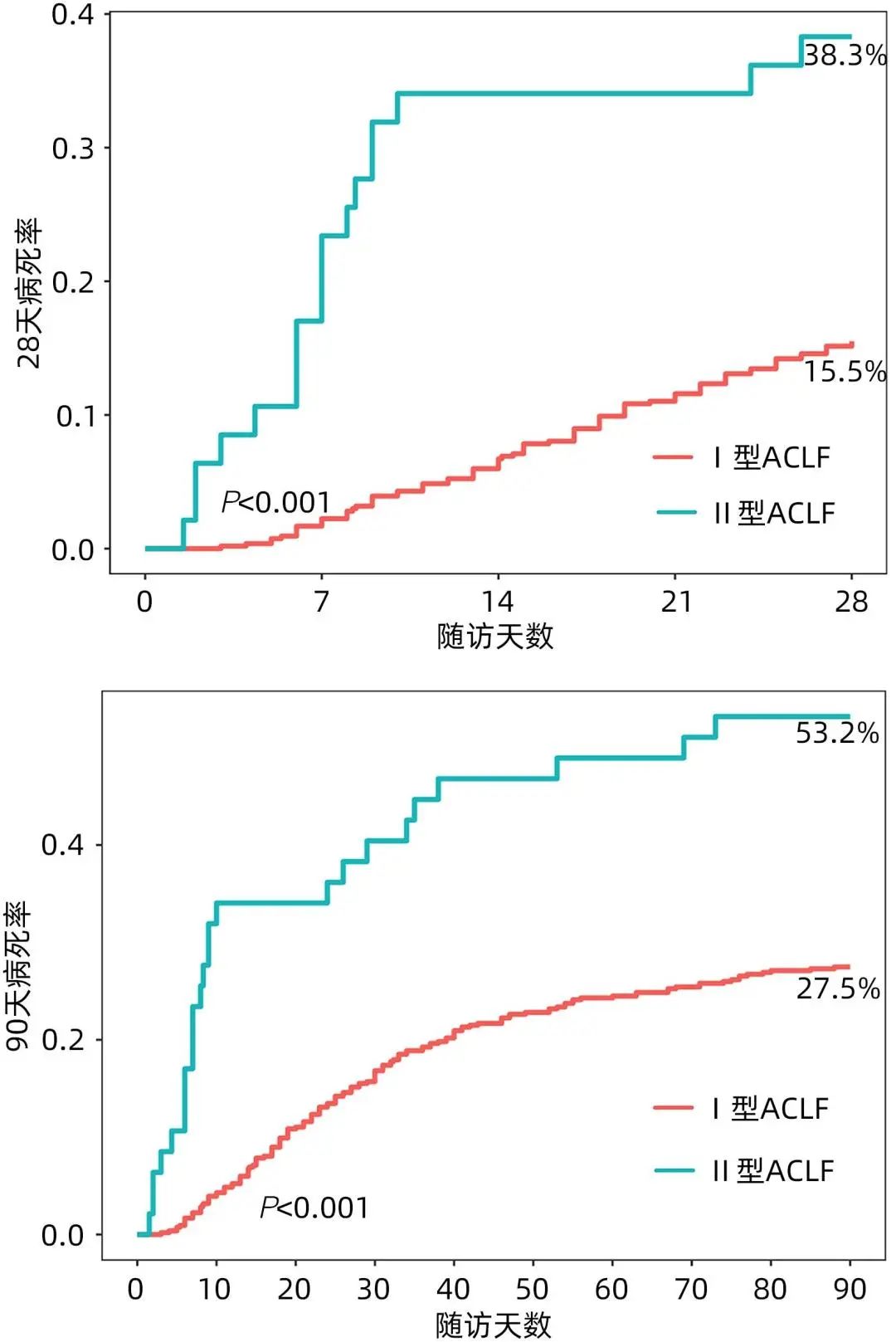
图1 Ⅰ型和Ⅱ型ACLF患者28天和90天的累积病死率曲线
2.3. 不同预后评分系统对Ⅰ型和Ⅱ型ACLF患者90天预后的预测价值
在非肝移植患者中评估三种评分系统对Ⅰ型和Ⅱ型ACLF患者90天预后的诊断价值。在Ⅰ型ACLF患者中,MELD评分、MELD-Na评分和CLIF-C ACLF评分的ROC曲线下面积(AUC)分别为0.735、0.737和0.740,两两比较差异均无统计学意义(P值分别为0.907、0.864和0.913)(表2、图2)。在Ⅱ型ACLF患者中,CLIF-C ACLF评分的AUC为0.880,显著高于MELD评分(AUC=0.560)和MELD-Na评分(AUC=0.513),差异均有统计学意义(P值分别为<0.001和0.005);MELD和MELD-Na间的AUC差异无统计学意义(P=0.585)(表2、图3)。
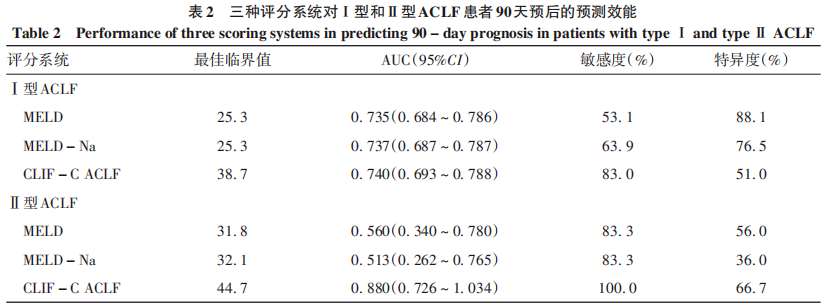
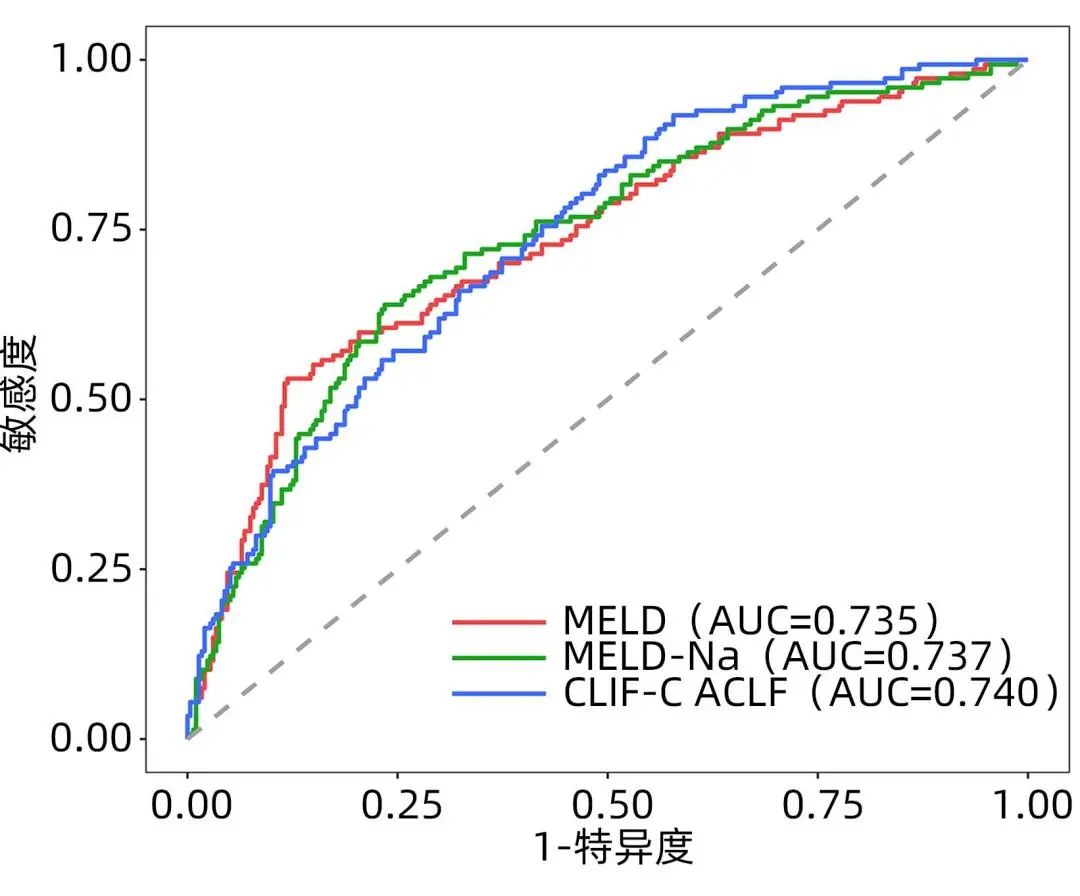
图2 三种评分系统预测Ⅰ型ACLF患者90天病死率的ROC曲线

图3 三种评分系统预测Ⅱ型ACLF患者90天病死率的ROC曲线
2.4. MELD评分的动态变化对于Ⅰ型ACLF患者预后的影响
Ⅰ型ACLF 患者在随访时间90天内,438例(82%)未进展为肝外多脏器衰竭,97例(18%)在病程1周后进展为多脏器衰竭。本研究进一步分析了MELD评分的动态变化与两组患者预后的关系。在未进展为多脏器衰竭的Ⅰ型ACLF患者中,存活287例,死亡151例,死亡组中有63.7%的患者MELD评分升高,而存活组MELD升高比例仅10.1%,差异有统计学意义(P<0.001)。在进展为多脏器衰竭的Ⅰ型ACLF患者中,存活7例,死亡90例,存活组与死亡组之间MELD动态变化趋势的差异无统计学意义(P=0.580)(图4)。
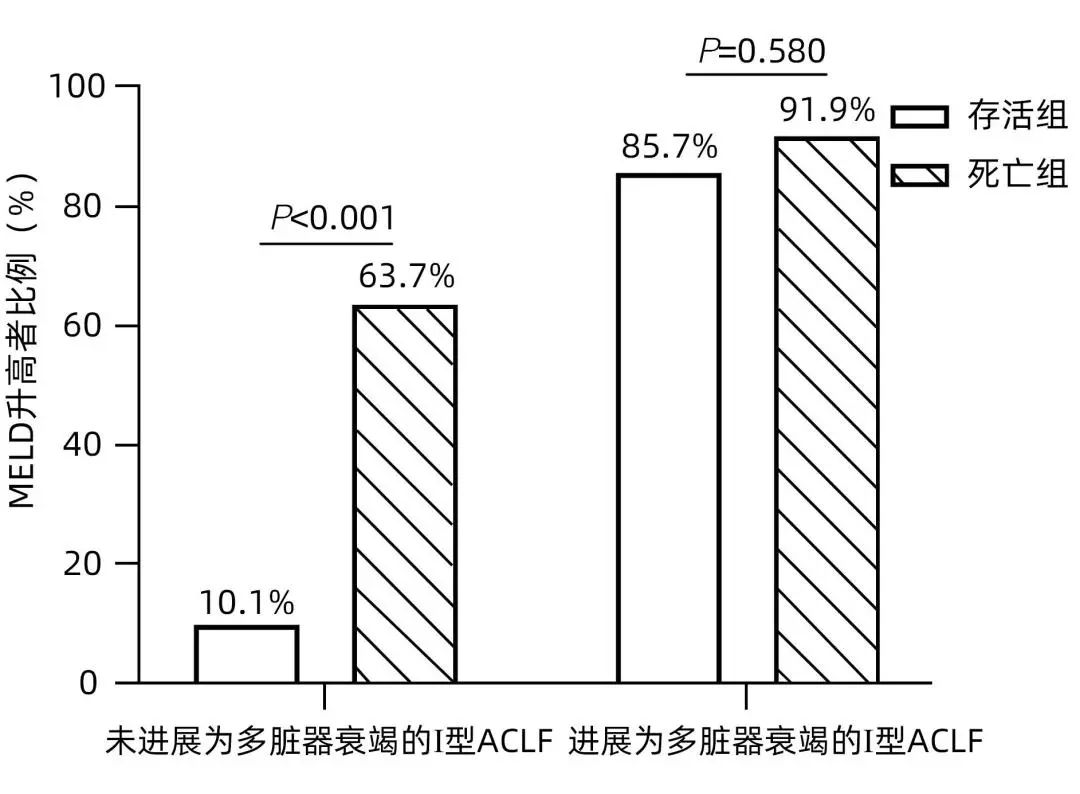
图4 MELD评分的动态变化对Ⅰ型ACLF患者预后的影响
3讨论
ACLF患者病情进展迅速,短期病死率高,识别其临床特征、早期及时干预十分重要。但因东西方对ACLF的定义、诊断标准及预后评估等方面存在诸多差异,给认识和诊治ACLF带来困惑。本研究结合东西方ACLF定义和临床特征,依据ACLF起病时肝内、外器官衰竭特点,探索新型ACLF临床分型特征。
Ⅰ型ACLF患者起病时肝衰竭为首发表现,主要表现为黄疸、凝血功能障碍,不同时伴随其他脏器功能衰竭。本研究发现Ⅰ型ACLF慢性肝病基础以慢性非肝硬化肝病(28.2%)和代偿性肝硬化(56.8%)为主,28天和90天病死率分别为15.5%和27.5%,病死率相对较低。从肝病基础、器官衰竭的类型和临床指标来看,Ⅰ型ACLF更接近APASL和中国《肝衰竭诊治指南(2018年版)》中ACLF的诊断标准,更符合中国的ACLF疾病特征。
Ⅱ型ACLF强调起病时肝衰竭伴随肝外脏器衰竭同步发生(1周内)。Ⅱ型ACLF多为肝硬化基础上(95.7%)肝脏急性失代偿合并多脏器功能衰竭,仅少数患者为慢性非肝硬化肝病基础(4.3%)。Ⅱ型ACLF患者病情危重,28天和90天病死率分别为38.3%和53.2%,预后较Ⅰ型ACLF患者差(P值均<0.001)。Mezzano等学者首次使用EASL-CLIF标准,对全球30项队列研究的184 041例肝硬化急性失代偿患者进行荟萃分析,结果表明ACLF患者的28天和90天病死率分别为45%和58%。因此,从肝病基础、器官衰竭的类型和预后来看,Ⅱ型ACLF更接近于EASL-CLIF的诊断标准。
ROC曲线分析得知,对于Ⅰ型ACLF患者,基线MELD、MELD-Na和CLIF-C ACLF评分对预后的预测价值中等,三者无统计学差异(P值均>0.05)。对于起病时合并肝外脏器衰竭的Ⅱ型ACLF患者,MELD或MELD-Na评分系统预测预后的性能较差,而CLIF-C ACLF评分的AUC为0.88,显著高于MELD和MELD-Na评分。Ⅰ型ACLF患者在起病1周后可进展为多脏器衰竭,研究进一步分析了MELD评分的动态变化与Ⅰ型ACLF患者预后的关系。结果显示,对于未进展为多脏器衰竭的Ⅰ型ACLF患者,MELD评分的动态变化趋势可反映患者的预后,死亡组中有63.7%的患者MELD评分升高,而存活组MELD升高者仅10.1%(P<0.001)。而对于进展为多脏器衰竭的Ⅰ型ACLF患者,存活组与死亡组之间MELD评分的变化趋势差异并不显著(P=0.580)。因此,对于Ⅰ型ACLF患者,如未出现肝外器官衰竭,可观察MELD评分的变化,如患者进展至肝外器官衰竭,再结合CLIF-C ACLF评分进行评估。对于起病时合并肝外脏器衰竭的Ⅱ型ACLF患者,建议早期应用CLIF-C ACLF评分来评估患者预后,指导肝移植。
MELD-Na评分系统包括总胆红素、肌酐、国际标准化比值、血清钠和病因,兼顾了肝脏、肾脏、凝血功能及电解质的情况,可较好地评估肝硬化患者的严重程度及预后,适合于肝衰竭的患者,但没有考虑脑、循环和呼吸等肝外器官功能和全身炎症对ACLF患者预后的重要影响,因此,对于在病程中进展至多器官衰竭的Ⅰ型ACLF患者和Ⅱ型ACLF患者,单纯应用MELD或MELD-Na评分可能会低估患者的病情。CLIF-C ACLF评分是产生于EASL-CLIF开展的一项前瞻性、多中心队列研究(CANONIC),建立在西方肝硬化急性失代偿患者中,该评分在CLIF-C OF评分基础上,结合了年龄、白细胞,充分评估了肝、肾、脑、凝血、呼吸、循环6个系统的疾病严重程度,且白细胞可更好地反映全身炎症反应,考虑了同时具有“危重症”和“肝病”特征的患者。西方国家的多项研究证实,MELD评分系统不能真正反映ACLF的严重程度,会低估ACLF患者的90天病死率,不利于ACLF肝移植肝源分配,特别是对于病情危重的ACLF 3级患者,而CLIF-C ACLF评分优于MELD评分系统,本研究结果也证实了上述观点。
本研究结果说明Ⅰ型ACLF与Ⅱ型ACLF的肝病基础、临床特征和预后均存在差异,预后评分系统侧重不同,为新型ACLF临床分型提供了循证医学依据。但本研究尚存在一定缺陷,本研究采用单中心回顾性研究,且Ⅱ型ACLF患者样本量较少,未来还需多中心、大样本、前瞻性队列研究进行验证,进一步探讨新型ACLF分型的特征。
总之,基于起病时脏器衰竭表现的新型ACLF临床分型兼容了东西方ACLF的疾病特征,结合了临床实际,有利于临床医生制定个体化诊疗策略,判断疾病预后和肝移植紧迫性,让患者得到更科学的管理和干预,从而更高效合理利用医疗资源。
全文下载
http://www.lcgdbzz.org/cn/article/doi/10.3969/j.issn.1001-5256.2023.10.015
引证本文
武羽, 董金玲, 徐曼曼, 等. 慢加急性肝衰竭:基于起病表现的新型临床分型特征及预后分析[J]. 临床肝胆病杂志, 2023,39(10): 2375-2382



