中山大学曾小伟、陈洪中/南洋理工赵彦利《自然·通讯》:多功能微针绷带,有效治疗糖尿病创面!
时间:2023-11-30 16:30:34 热度:37.1℃ 作者:网络
由于复杂的伤口环境,例如受感染的生物膜、过度炎症和受损的血管生成,糖尿病伤口的治疗面临着巨大的挑战。微环境在慢性糖尿病伤口中的关键作用尚未在治疗开发中得到解决。在此,中山大学曾小伟、陈洪中/南洋理工大学赵彦利开发了一种微针(MN)绷带,其功能化为含有硒和二氢卟酚e6的多巴胺涂层杂化纳米颗粒(SeC@PA),它能够双向调节活性物种(RS)的产生,包括活性氧物种( ROS)和活性氮(RNS),响应伤口微环境。SeC@PA MN绷带可以破坏伤口覆盖物中的屏障,以实现有效的SeC@PA输送。SeC@PA不仅消耗内源性谷胱甘肽(GSH)以增强RS的抗生物膜作用,而且还通过级联反应降解生物膜中的GSH,产生更具杀伤力的RS以消灭生物膜。SEC@PA在低GSH水平的伤口床上起到RS清除剂的作用,发挥抗炎作用。SEC@PA还促进巨噬细胞的M2表型极化,加速伤口愈合。这种由创面微环境激活的自我增强、分解代谢和动态疗法为治疗慢性创面提供了一种方法。该研究以题为“Biofilm microenvironment triggered self-enhancing photodynamic immunomodulatory microneedle for diabetic wound therapy”的论文发表在《Nature Communications》上。

该研究开发了一种用于糖尿病伤口治疗的多功能微针(MN)绷带。首先制备含有硒(Se)和氯6(Ce6)的多巴胺包覆杂化纳米颗粒(SeC@PA),然后在表面用L-精氨酸(LA)进行修饰。MN绷带上加载SeC@PA以获得SeC@PA MN。当SeC@PA MN应用于糖尿病伤口时,理化屏障被打破,SeC@PA被有效地递送到生物膜和伤口活组织。该研究假设,SeC@PA输送到生物膜感染部位后,不仅可以消耗GSH并产生活性氮(RNS)以增强PDT的抗生物膜效果,还可以利用生物膜中高水平的GSH产生活性氮(RNS),从而增强PDT的抗生物膜效果。通过一系列催化级联反应产生羟基自由基(·OH)。相反,在递送至高度炎症的伤口组织后,SeC@PA通过快速清除RS并增强谷胱甘肽过氧化物酶(GPX)活性而表现出有效的抗氧化作用。此外,SeC@PA可以有效促进巨噬细胞向M2表型极化,从而促进伤口愈合。SeC@PA 通过不同GSH水平对RS的双向调节在体外和体内均得到证实。SeC@PA MN的治疗效果在糖尿病伤口小鼠模型中进行了研究。该研究强调了一种自我增强、分解代谢和动态疗法,可以有效管理慢性糖尿病伤口。
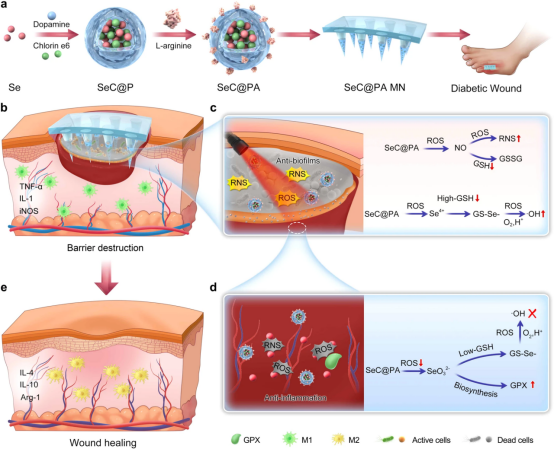
图1|糖尿病伤口治疗的自我增强分解代谢动态策略
【SeC@PA和SeC@PA MN绷带的制备和表征】
在本研究中,采用多巴胺(DA)包覆Se表面并封装光敏剂(Ce6)得到SeC@P。LA通过静电作用吸附在SeC@P表面形成SeC@PA。预计将SeC@PA传递到生物膜将导 PDA层快速降解,从而释放Ce6和Se。这种释放会引发级联反应,产生RS风暴以消除生物膜。 SeC@PA中 Ce6的释放在弱酸性环境(pH = 5.5)下加速,并且Se在pH = 5.5条件下也成功释放。由于生物膜微环境呈弱酸性,当SeC@PA递送到生物膜时,Se和Ce6被有效释放到作用点。且从SeC@PA释放的Se在辐照下可以被氧化为Se4+。为了验证SeC@PA在体外不同GSH水平下双向调节RS的能力,使用荧光探针2,7-二氯荧光素二乙酸酯(DCF-DA)来评估RS的生成。结果表明,在高GSH水平下,SeC@PA(+)参与GSH降解并导致较高的RS水平,而在低GSH水平下表现出RS清除能力,从而实现双向RS调节。
该研究成功制备了负载SeC@PA的MN绷带。SeC@PA MN绷带在PBS中表现出快速溶解性能,表明SeC@PA MN绷带的使用时间很短。为了评估 SeC@PA 的递送效率,我们组装了一个模仿伤口屏障的体外模型。结果证明了MN绷带具有穿透屏障并直接将SeC@PA递送至所需目标区域的卓越能力。总的来说,这些结果表明MN绷带可以克服慢性伤口局部药物输送的障碍,将药物直接输送到作用部位以获得治疗效果。
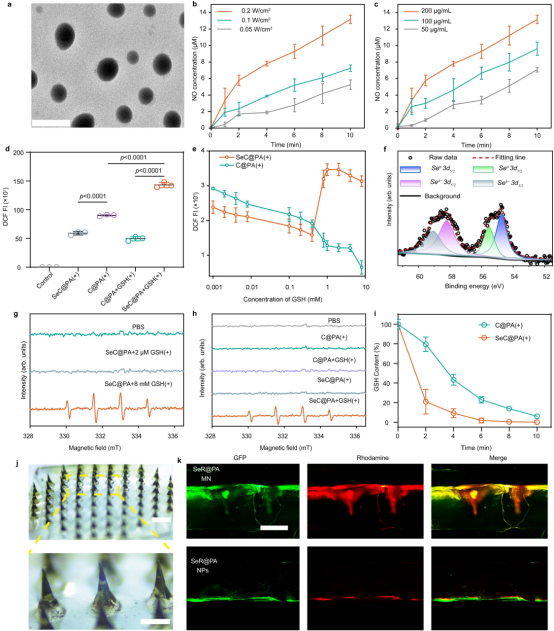
图2| SeC@PA和SeC@PA MN的表征
【SeC@PA的抗生物膜特性】
对于抗生物膜评估,金黄色葡萄球菌(SA)和铜绿假单胞菌(PA)被用作代表菌株,因为它们是从慢性伤口生物膜中分离出的最常见物种。首先研究了不同浓度的SeC@PA(+)的抗菌活性和细胞活力,证明了针对RS的抗菌潜力。为了探讨SeC@PA(+)组是否可以通过分解GSH产生更高水平的RS来消除生物膜,测量了不同处理后生物膜中的GSH浓度和RS。结果表明,SeC@PA(+)可以分解和清除生物膜中的GSH,产生RS风暴,从而消灭生物膜。
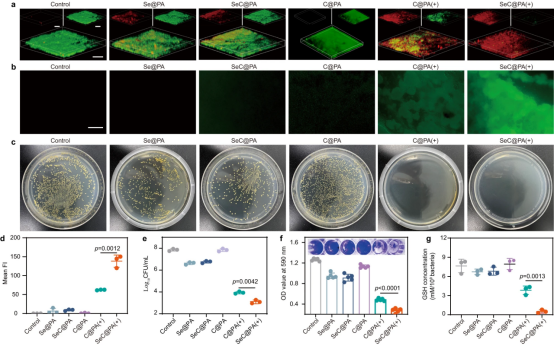
图3|纳米颗粒的抗生物膜效应
【SEC@PA的抗氧化性能】
由于HUVECs对RS极其敏感,因此采用人脐静脉内皮细胞(HUVECs)来验证SeC@PA的抗氧化特性。结果表明SeC@PA是一种优秀的RS清除剂。为了评估SeC@PA是否可以通过生物合成促进GPX的水平和活性,增强伤口的抗氧化能力,研究了治疗后GPX4的水平和活性。与对照组和C@PA(+)组相比,Se@PA和SeC@PA(+)处理组细胞质和细胞核中的红色荧光显着增强,表明GPX4水平增加。进一步使用蛋白质印迹分析了GPX4的水平,与对照组相比,C@PA(+)的应用显着降低了GPX活性,表明RS损害了GPX活性,而SeC@PA可以逆转这种情况。
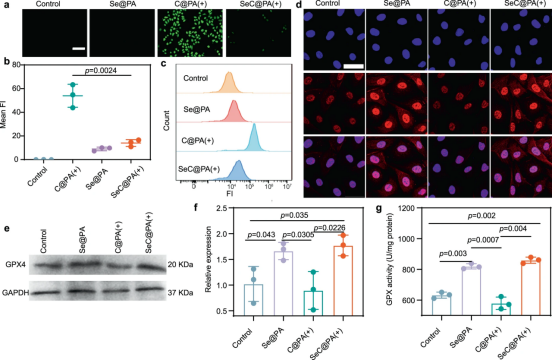
图4|纳米颗粒的抗炎作用
【SeC@PA的巨噬细胞极化促进特性】
巨噬细胞在调节炎症和促进伤口愈合中发挥核心作用,并经历极化为M1和M2表型。慢性伤口被M1表型巨噬细胞浸润,导致持续的炎症反应,延迟伤口愈合。已证明M2表型巨噬细胞在调节炎症、促进血管生成和伤口愈合中发挥关键作用。因此,增强巨噬细胞极化至M2表型提供了加速慢性伤口愈合的机会。该研究首先使用特征表面生物标志物CCR7和 CD206来识别M1和M2表型巨噬细胞,并确定不同处理对巨噬细胞极化的影响。总体而言,SeC@PA(+)可以通过调节巨噬细胞向M2型极化,从而分泌VEGF,促进HUVECs迁移和管形成,从而促进伤口愈合。
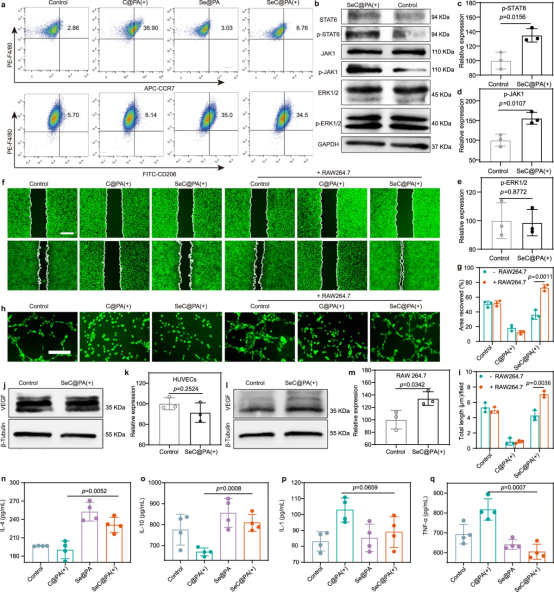
图5 |SeC@PA有效极化巨噬细胞向M2表型
【使用SeC@PA绷带治疗糖尿病小鼠非生物膜感染伤口】
采用没有感染生物膜的糖尿病慢性伤口来验证SeC@PA MN对伤口组织的直接RS清除作用。SeC@PA MN(+)组中的RS水平低于C@PA MN(+)组,表明SeC@PA MN(+)在伤口组织中RS清除中具有潜在作用。苏木精-伊红(HE)染色,Masson三色染色和CD31免疫荧光显示,含硒MN组表现出更规则的皮肤结构,胶原蛋白增强沉积,血管密度增加。总的来说,在非生物膜感染的糖尿病慢性伤口中,含Se MN可以通过清除RS来减轻炎症,同时通过胶原沉积和血管生成促进伤口愈合。这些结果表明,仅通过PDT治疗(C@PA MN(+))产生的RS具有延迟糖尿病慢性伤口愈合的风险。必须立即清除PDT产生的RS,以免对创面组织造成二次损伤。SeC@PA MN (+)能够有效去除创面组织中PDT产生的RS,减轻氧化应激,促进创面愈合。
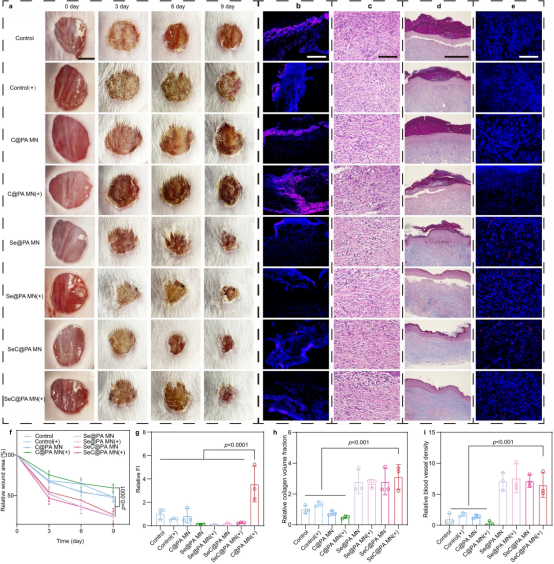
图6|SeC@PA MN促进了大鼠非生物膜感染的全层糖尿病伤口的愈合
【SeC@PA MN通过有效传递SeC@PA促进生物膜感染的慢性伤口愈合】
为了进一步探讨SeC@PA在创面的位置是否是导致SeC@PA MN(+)组和SeC@PA NPs(+)组治疗效果差异的原因,研究了SeC@PA给药后的分布情况。首先,通过用表达GFP的大肠杆菌感染慢性糖尿病伤口来生成生物膜,以便于观察。其次,用罗丹明代替Ce6制备了SeR@PA MN和SeR@PA NPs,以便更好地观察SeC@PA在伤口覆盖物中的分布。结果证明了MN在治疗慢性伤口领域所表现出的优势。慢性糖尿病伤口通常覆盖有炎症渗出物和生物膜,它们形成物理化学屏障,阻止治疗药物渗透到伤口覆盖物下方的作用部位。因此,传统的局部递送方法在慢性伤口的治疗中存在局限性。相反,MNs可以穿透创面的理化屏障,实现更深更广的药物输送,有效根除生物膜,减轻氧化应激,促进创面血管生成和胶原蛋白沉积,促进创面愈合。

图7 |SeC@PA MN通过有效输送SeC@PA促进慢性伤口愈合
【使用SeC@PA MN绷带治疗糖尿病小鼠生物膜感染的伤口】
随后,研究了SeC@PA MN对生物膜感染的糖尿病慢性伤口的影响。SeC@PA MN(+)处理的创面中,皮肤表皮和真皮相对完整且高度有序,炎症细胞浸润较少。此外,SeC@PA MN(+)处理的伤口中相对CD31荧光强度显著增加,表明SeC@PA MN(+)治愈的伤口真皮中的血管密度显着更高与其他组相比。
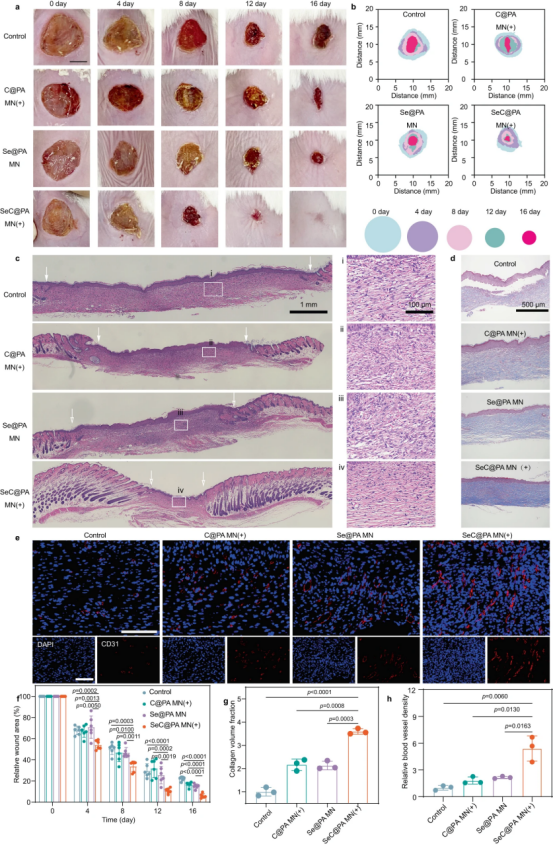
图8 |SeC@PA MN促进大鼠生物膜感染的全层糖尿病伤口愈合
第4天采用二氢乙锭染色法测定不同处理后创面组织中的RS水平。对照组和C@PA MN(+)组显示出强烈的红色荧光,表明创面组织氧化应激严重。应用Se@PA MN和SeC@PA MN(+)后,RS水平明显下降,表明两种MN都能清除RS。同时,测定了伤口组织中的GPX4水平和活性,发现SeC@PA MN可以增强这两个参数。Se@PA MN在体内并没有明显增加GPX4活性和水平,这与体外研究的结果不同。此外,SeC@PA MN(+)处理后伤口覆盖物中的菌落数量与其他处理相比要低得多,证明了SeC@PA MN(+)优异的体内抗生物膜能力。SeC@PA MN(+)通过消除生物膜和减少炎症,从而增加血管生成和胶原蛋白沉积,有效促进伤口愈合。
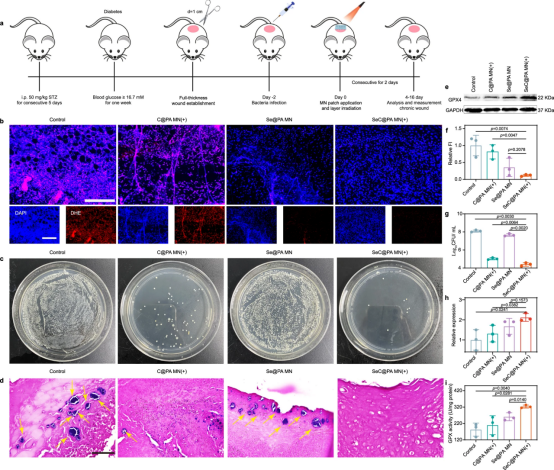
图9 |SeC@PA MN用于减少伤口炎症和细菌促进血管生成
【SeC@PA MN体内巨噬细胞极化】
为了进一步说明SeC@PA MN(+)对巨噬细胞极化的影响,该研究使用免疫荧光染色研究了巨噬细胞向伤口的浸润。与对照组相比,SeC@PA MN(+)处理的伤口表现出M1表型巨噬细胞(F4/80+和CD86+)浸润减少,M2表型巨噬细胞(F4/80+和CD206+)浸润增加。这一结果归因于Se促进巨噬细胞极化至M2表型。此外,SeC@PA MN(+)显着增加了抗炎因子IL-4和IL-10的水平,并降低了促炎因子IL-1和TNF-α的水平。总体而言,SeC@PA MN(+)可以促进巨噬细胞极化为抗炎M2表型并促进伤口愈合。
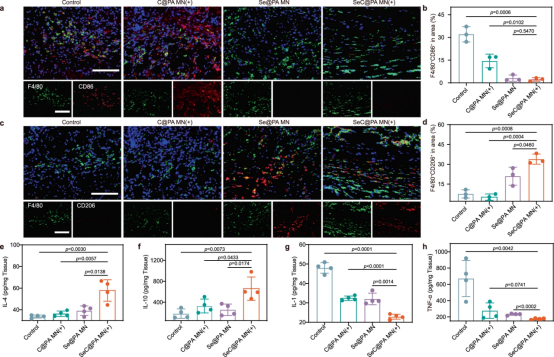
图10 |SeC@PA MN缓解炎症和刺激慢性糖尿病伤口巨噬细胞M2极化
【小结】
该研究设计了一种SeC@ PA MN绷带来治疗慢性糖尿病伤口。在该工作中,MN用于刺穿覆盖伤口床的理化屏障,从而将货物随后输送到生物膜和活性组织。与局部递送SeC@PA NPs相比,SeC@PA MN绷带可以将SeC@PA直接递送至创面下方的生物膜和创面组织,大大提高了药物的生物利用度。当SeC@PA被传递到高GSH水平的生物膜时,在辐照过程中通过一系列级联分解反应会产生比1O2(主要由Ce6产生)毒性更大的·OH。同时,LA产生的NO被用来消耗GSH并产生RNS,形成RS风暴来根除生物膜。这种治疗效果不能仅仅通过消耗GSH来辅助PDT来实现。体外和体内研究均表明 SeC@PA(+)可有效消除生物膜中的细菌,表明高GSH水平下自我增强抗生物膜策略的有效性。当应用于低GSH水平的伤口组织时,SeC@PA充当RS清除剂,快速猝灭SeC@PA在照射后产生的RS,并增加GPX4的水平和活性,从而减少伤口炎症。这些结果表明,SeC@PA可以通过感知不同的GSH水平来动态调节RS,无需额外的添加剂,同时消除生物膜和抑制炎症。此外,SeC@PA通过JAK-STAT6途径明显改善巨噬细胞极化为M2表型,促进抗炎因子IL-4和IL-10的水平并降低促炎因子的水平。巨噬细胞极化至M2表型可通过分泌VEGF促进HUVEC体外迁移和管形成。患有慢性伤口的糖尿病小鼠伤口中M2表型巨噬细胞的浸润明显增加,有利于抑制炎症并促进血管生成。因此,这项研究代表了通过针对生物膜和伤口床的独特微环境对慢性伤口潜在治疗方法的初步探索。这些发现为有效管理慢性伤口的局部治疗的合理设计提供了宝贵的见解。
原文链接:
https://www.nature.com/articles/s41467-023-43067-8


