【blood】我如何治疗复发难治性急性髓系白血病
时间:2023-12-01 20:32:36 热度:37.1℃ 作者:网络
R/R AML的治疗
随着很多新药获得批准,急性髓系白血病(AML)的治疗取得了长足进展,但复发难治性(R/R)白血病的预后仍不佳。《blood》近日发表的一篇综述中,作者通过描述3例患者,说明了这一患者群体的治疗决策。

R/R AML的定义和治疗算法
2022年ELN建议中关于复发难治性AML的缓解标准,不仅基于血液学标准,还基于可测量残留病变(MRD)的评估(多参数流式细胞术或分子学检测)(表1),由MRD触发的治疗(包括异基因HCT)最近已发展成预防明显血液学复发的方案。

诊断R/R AML患者时需进行重复突变分析,因为突变水平的克隆演变经常发生,且可能对治疗产生直接影响(见下文的患者1和2)(图1)。
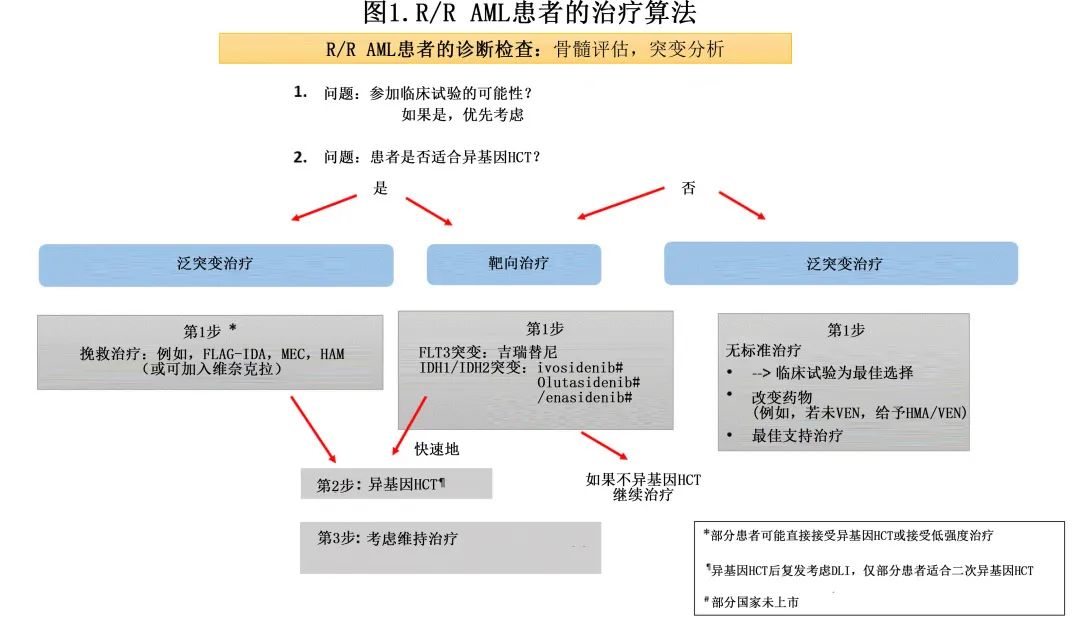
在接受强化治疗的患者中,以下患者的结局尤其不良:细胞遗传学高危、FLT3-ITD、年龄较大、既往接受过异基因造血细胞移植(HCT)和早期复发(6个月内),因此应将R/R AML患者纳入临床试验(图1)。由于异基因HCT是大多数R/R AML的唯一可能治愈方法,并且挽救治疗了约1/3的患者,因此在所有可移植患者中搜索供者(如果在初始诊断时未移植),并在有供者后进行异基因HCT。鉴于R/R AML预后不良(尤其是不适合接受异基因HCT的患者),还需关注患者的生活质量和满意的症状控制。
患者1
2020年,一名52岁女性诊断为NPM1突变AML,核型正常,FLT3 (FLT3-ITD,低等位基因比例为0.21)和TET2共突变。根据2017年ELN归类为低危。给予" 7+3 "方案联合midostaurin治疗并获得完全缓解(CR)。考虑到良好缓解和低危特征,患者接受了3个周期的中剂量阿糖胞苷联合midostaurin巩固治疗。根据ELN MRD工作组推荐的方法,采用实时荧光定量PCR (RT-qPCR)检测患者骨髓和外周血中NPM1突变转录本的MRD,患者获得MRD阴性。但在完成巩固治疗1年后,患者MRD为阳性,骨髓>400 NPM1突变拷贝/ABLx104,外周血>600 NPM1突变拷贝/ABLx104。
问题:MRD复发有什么意义?为了预防形态学复发,在临床上应该如何应对?
治疗考虑:MRD检测的技术进步,包括标准化和共识建议,导致现在可以在常规临床实践中应用MRD评估。目前已有不同的MRD评估技术。多参数流式细胞术(MFC)和实时荧光定量pcr (RT-qPCR)均是目前已建立的AML MRD检测方法,后者还适用于少数异常情况,如NPM1突变和CBF突变AML。基于二代测序(NGS)的MRD评估越来越受到关注,但由于存在挑战(包括如何处理克隆性造血的标志物),该方法尚未在常规实践中建立。根据ELN的建议,作者使用RT-qPCR(用于NPM1mut和CBF白血病),以及MFC用于其他AML亚型。基于NGS的MRD分析正在快速发展,但不应仅基于NGS的MRD检测结果进行临床决策。
该患者在诊断时显示3个突变(NPM1、FLT3-ITD和TET2)。NPM1是一个稳定的MRD标志物,很少在复发时丢失。RT-qPCR可敏感地检测极低水平的NPM1突变(10-4 ~ 10-5),使其成为理想的MRD标志物。TET2常在缓解样本中观察到,而且与DNMT3A和ASXL1突变相似,也是克隆性造血的标志物;这些突变称为DTA突变,不应用作MRD标志物。除DTA外,还有其他突变(例如SRSF2、IDH2、JAK2、TP53)可出现在克隆性造血中,而非残留AML中。相比之下,FLT3-ITD是具有临床相关性的良好MRD标志物。对于CR/CRh/CRiMRD-患者,一旦RT-qPCR检测到MRD阳性或任意两个阳性样本之间的MRD拷贝数增加≥1 log10,需要在连续样本中快速确认结果。虽然针对MRD复发没有已获批准的治疗方法,也没有治疗标准,但作者会立即为适合移植的患者寻找供者。
NPM1突变AML可作为一个例子,其中NPM1mut转录水平升高与复发具有强相关性。一项研究中,随访期间≥200NPM1mut/ABL x104的36例患者均复发。这也得到了一项随机研究的支持:与临床观察相比,监测NPM1突变和FLT3-ITD突变MRD有显著的生存获益。因此,一旦突变转录水平超过200 NPM1mut/ABL x104且经过确证性分析,建议所有适合移植的患者接受异基因HCT。
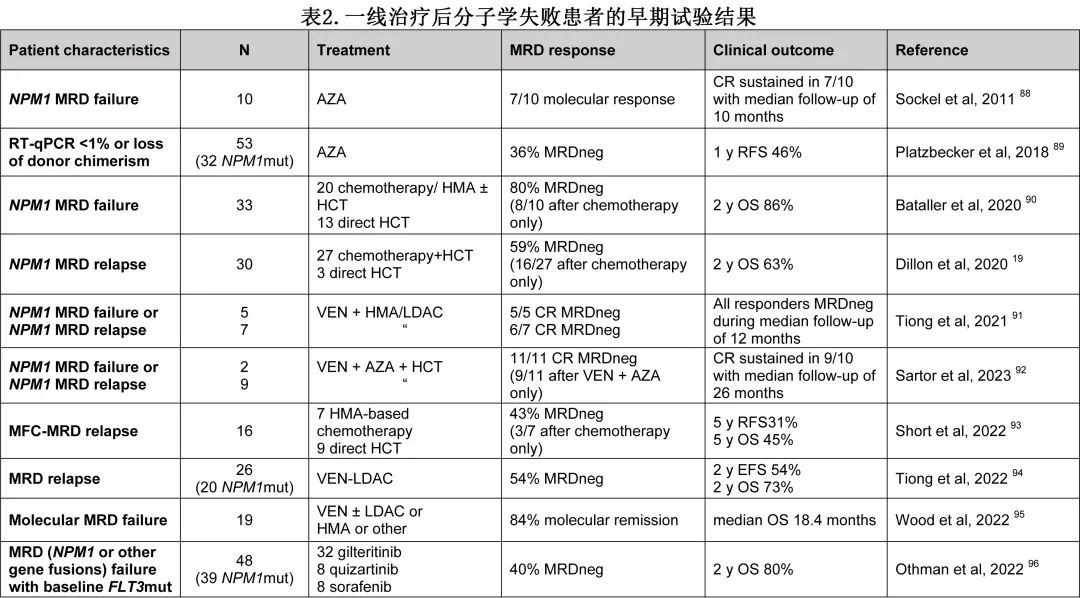
另外,针对MRD阳性患者的临床试验正在进行中,目的是再次诱导分子学CR并预防血液学复发。治疗方法包括未经选择的治疗(图1翻译为泛突变治疗)或靶向治疗(例如去甲基化药物、强化化疗、维奈克拉或FLT3抑制剂;表2)或免疫介导的细胞疗法(例如NK细胞输入)或针对白血病抗原的疫苗接种(如WT1)。
患者1继续
在检测出MRD阳性后4周,患者出现了形态学复发。分子生物学分析发现NPM1、FLT3-ITD(等位基因比例增加至2.7)和TET2突变,以及NRAS的一个新突变。吉瑞替尼单药治疗以120 mg/d的剂量开始。获得CRi后进行相合非亲缘供者异基因HCT。
异基因HCT后的管理包括索拉非尼治疗。FLT3-ITD阳性AML患者接受异基因HCT后,索拉非尼维持治疗可延长总生存期,2022年ELN建议将其描述为合理选择。患者在异基因HCT后180天达到CR。
问题:一线治疗及突变谱如何影响复发时的治疗方案?
治疗考虑:克隆演变是复发时的常见现象,因此重复的分子学分析对于确定白血病克隆的改变很重要。该患者即出现克隆演变,复发时ITD等位基因比例从0.21增加至2.7,通常是由拷贝中性杂合性丢失引起。但在既往接受midostaurin治疗后复发的患者中,有很高比例的患者失去FLT3-ITD克隆,这强调了复发时进行分子学检测的必要性。吉瑞替尼是一种FLT3抑制剂,在R/R AML的1/2期研究中显示出有前景的结果,且抗白血病活性在FLT3突变患者中显著增强,这为在FLT3突变R/R AML中开展比较吉瑞替尼单药治疗和根据医师选择的常规挽救治疗的随机3期研究铺平了道路。
该3期研究中, 247例患者随机分配到吉瑞替尼组,124例患者随机分配到挽救化疗组。吉瑞替尼组的中位总生存期(OS)显著较长(9.3个月vs 5.6个月;P<0.001),CR/CRh率也显著较高(34.0% vs 15.3%)。在初始分析后2年的一项扩展随访研究中,吉瑞替尼组的2年生存率为20.6%,而标准组为14.2%。在本次随访中,接受异基因HCT的64例患者中40例在HCT后接受吉瑞替尼治疗,其中16例在移植后2年存活且无复发。但这些结果也表明,吉瑞替尼未能使大多数患者达到长期治愈。两项研究均在midostaurin成为FLT3突变AML的标准一线治疗之前开展,因此3期试验中只有5.7%的患者在一线治疗期间接受了midostaurin治疗,从而存在midostaurin治疗是否影响复发患者对吉瑞替尼的应答的问题。
一项回顾性分析比较了既往接受过midostaurin或索拉非尼治疗的患者与未接受过治疗的FLT3突变患者接受吉瑞替尼的结局。虽然既往接受过TKI治疗的患者缓解持续时间较短,但在既往接受过TKI治疗的患者中再次观察到吉瑞替尼组有中位OS延长的趋势。另一种FLT3抑制剂quizartinib,因3期研究的结果而未获得FDA和EMA批准。
该患者接受吉瑞替尼治疗,作为异基因HCT之前的桥接治疗。值得注意的是,患者最初不适合接受异基因HCT,因为根据2017年ELN标准(NPM1mut和FLT3-ITDlow),其归类为低危AML伴分子CR1。异基因HCT后该患者接受索拉非尼治疗。
两项随机试验研究了索拉非尼作为移植后维持治疗。在一项随机、安慰剂对照、双盲2期试验中,83例CR期FLT3-ITD阳性成人AML患者接受安慰剂(n=40)或索拉非尼(n=43)治疗,索拉非尼组的2年无复发生存率(RFS)(85%)显著高于安慰剂组(53.3%)(P=0.002);移植前MRD阴性但移植后MRD阳性的患者获益最大。类似地,一项开放标签、多中心3期试验将202例FLT3-ITD阳性AML患者随机分组,分别接受索拉非尼维持治疗或对照组治疗。索拉非尼组1年累积复发率为7%,而未接受TKI治疗的患者为24.5%;在延长随访中,索拉非尼与60.4个月时的OS改善相关,分别为72%和55.9%。在一项纳入FLT3-ITD阳性AML患者的随机3期试验中,研究者比较了异基因HCT后吉瑞替尼维持治疗24个月与安慰剂的效果。在整个队列中,吉瑞替尼维持治疗未显示出RFS(主要终点)获益。然而使用基于NGS的MRD检测方法(阈值为10-6),在移植前或移植后MRD阳性的患者中观察到RFS显著获益,而在MRD阴性的患者中未观察到差异。这就提出了一个问题:是否应根据移植前或移植后的MRD结果来调整移植后的TKI维持治疗
对于无可选靶点的体健患者,移植前多采用ELN和NCCN推荐的挽救化疗方案,包括FLAG-IDA(氟达拉滨、阿糖胞苷、G-CSF和去甲氧柔红霉素)、MEC(米托蒽醌、阿糖胞苷、依托泊苷)、CLAG-M(克拉屈滨、阿糖胞苷、米托蒽醌、G-CSF)和HAM(大剂量阿糖胞苷、米托蒽醌)。CR1持续时间≥1年,CR率约为40-60%。目前正在努力将挽救治疗方案与维奈克拉等新药联合应用,从而改善患者对挽救治疗方案的应答。维奈克拉单药治疗AML疗效不佳,但与化疗有协同作用。已经对FLAG-IDA联合维奈克拉进行了研究:在1B期和2B期研究中,R/R AML患者的总缓解率(ORR)分别为75%和70%,而在新诊断的AML患者中,ORR为97%。总体而言,R/R AML的CR/CRi率为69%。12个月后,2期研究未达到中位OS。46%的R/R AML患者继续接受异基因HCT,移植后1年生存率为78%。
R/R AML患者联用7日维奈克拉和FLA-IDA的单中心回顾性研究表明,与接受FLA-IDA治疗的患者相比,接受FLAVIDA治疗的患者的ORR显著较高(78% vs 47%),而接受异基因HCT或供者淋巴细胞输注(DLI)的患者的EFS和OS相似,分别为81% (FLAVIDA)和79% (FLA-IDA)。总的来说目前仍缺乏这一适应证的随机试验数据。
目前维奈克拉联合强化化疗用于一线治疗的一项随机3期研究正在进行中(NCT04628026)。此外,维奈克拉联合阿扎胞苷(AZA)也被评估作为移植前的桥接方案。
Menin抑制剂是NPM1突变R/R AML患者(正如患者1)或有KMT2A重排的患者的新型疗法,因为这两个白血病亚群的增殖和生存都依赖于Menin,多个menin抑制剂正在R/R AML的早期临床试验中。在一项1期临床试验中,研究者在68例患者(其中56例为R/R AML)中研究了revumenib(menin-KMT2A相互作用的选择性口服抑制剂),其中30%的患者达到CR/CRh。Ziftomenib是meninKMT2A蛋白-蛋白相互作用的口服抑制剂,在NPM1突变或KMT2A重排的AML R/R患者中进行了一项1/2期研究。在初步报告中,CR率和ORR率分别为30%和40%,中位持续时间为8.2个月。
另一个可能的靶点为E-选择素(E-selectin),它通过AML母细胞释放促炎信号在骨髓内皮上调,导致白血病与内皮结合增强。Uproleselan是一种E-选择素拮抗剂,可破坏该细胞粘附。在一项R/R AML的1/2期研究中,Uproleselan联合强化化疗达到41%的CR/CRi率,中位OS为8.8个月。目前,在一项治疗R/R AML的3期研究(NCT03616470)中,Uproleselan联合强化化疗正在进行评估。
对于适合移植患者,挽救治疗的目标是在异基因HCT前降低白血病负荷,这一策略是基于以下结果:CR患者(尤其是MRD阴性的患者)接受异基因HCT后的结局优于活动性疾病患者。在MRD阳性形态学缓解患者和异基因HCT时疾病处于活动性患者之间进行的一项回顾性分析支持这结论。
然而,目前尚不清楚所有R/R AML患者是否均可从挽救治疗(试图在异基因HCT前诱导CR)中获益,最近的一项3期研究探索了这一问题,该试验以1∶1的比例将患者随机分组,采用HAM和后续异基因HCT的缓解诱导策略(RIST组),或在序贯预处理和异基因HCT之前观察等待的疾病控制组(DISC组)。在DISC组和RIST组中,主要终点(异基因HCT后第56日时的CR)的达到率分别为84.1%和81.3%。在两组中,从第56日CR开始的1年无白血病生存率(LFS)以及从随机分组开始的1年和3年OS均相似。
还需要通过进一步研究来阐明哪些分子亚组可能从异基因HCT之前的挽救性治疗中获益,尤其是该研究中FLT3-ITD阳性患者比例不足。此外,挽救性治疗可在无法接受快速异基因HCT(如正在寻找供者)或高度增殖的R/R AML患者中继续发挥重要作用。
总之,对于R/R AML患者,最优先考虑的是对所有适合移植患者进行异基因HCT。
患者2
2021年,一名患充血性心脏病的75岁男性诊断为AML非特指型(NOS)。细胞遗传学分析示8号三体,存在IDH2、ASXL1和NF1基因突变。患者接受阿扎胞苷联合维奈克拉(AZA/VEN)治疗,1个周期后达到CRi。患者共接受12个周期的AZA/VEN治疗,并应其个人要求接受了10周的“药物假期”。但希望重新开始治疗时疾病已经复发,血液涂片上有35%的原始细胞。对于诊断时存在的所有突变,此时的突变谱再次为阳性,还包括额外突变TP53。
问题:R/R AML患者接受AZA/VEN治疗后的前景如何?他们的后续治疗方案是什么?
治疗考虑:对于不适合接受强化化疗的患者,去甲基化药物(HMA)阿扎胞苷或地西他滨联合维奈克拉已成为标准治疗。这一联合治疗方案获得批准是基于安慰剂对照的VIALE-A研究,中位随访时间20.5个月,AZA/VEN组的中位OS为14.7个月,而AZA+安慰剂组为9.6个月(HR=0.66;P<0.001)。在中位随访43.2个月的最新分析中,AZA/VEN治疗患者的生存曲线继续下降,表明对于大多数患者该联合方案无法治愈。几乎所有患者在治疗过程中最终都会复发或变得耐药,即使初始缓解良好。然而,在NPM1突变的AML患者亚组中,大多数患者MRD转阴且预后良好。
然而,HMA/VEN治疗后复发的患者生存较差。在一项纳入41例HMA/VEN后复发患者的回顾性研究中,中位OS仅2.4个月。与不接受挽救治疗相比,挽救治疗并未带来有意义的生存期延长(2.9个月vs 1.3个月),这也是作者的经验。如果患者在HMA/Ven初始治疗后体能状态改善,并且适合异基因HCT,则应在复发前考虑移植。患者对HMA/Ven发生R/R时可能获得高危细胞遗传学和分子学特征(例如TP53、FLT3或N/KRAS突变),这些特征可进一步降低对任何治疗(包括异基因HCT)的缓解率。对于这些患者,转换为其他化疗药物并无获益,目标是纳入临床试验;此时应向患者说明使用已批准的药物可以达到或不能达到什么效果。对于许多患者来说,最佳支持性治疗和纳入姑息治疗可能是首选建议。
对于有可针对靶点的患者,可考虑靶向治疗。该患者在诊断和复发时携带IDH2突变。对于有IDH1和IDH2突变的患者可采用靶向治疗。Ivosidenib和olutasidenib以及enasidenib分别是IDH1和IDH2酶突变的口服选择性抑制剂(表3)。三种抑制剂的缓解率和生存期相似(ivosidenib、olutasidenib和enasidenib的ORR分别为42%、48%和40%,中位OS分别为8.8个月、11.6个月和9.3个月)。然而在既往接受过多线治疗的患者中,对enasidenib与常规治疗方案进行比较的3期研究未能显示总生存期获益(enasidenib 6.5个月vs 标准治疗6.2个月;风险比0.86)。值得注意的是,ivosidenib和enasidenib的研究并未纳入HMA/VEN失败患者,因为这些研究是在维奈克拉成为标准治疗的一部分之前开始的。因此,对于HMA/VEN已R/R的患者,靶向治疗的效果仍有疑问。
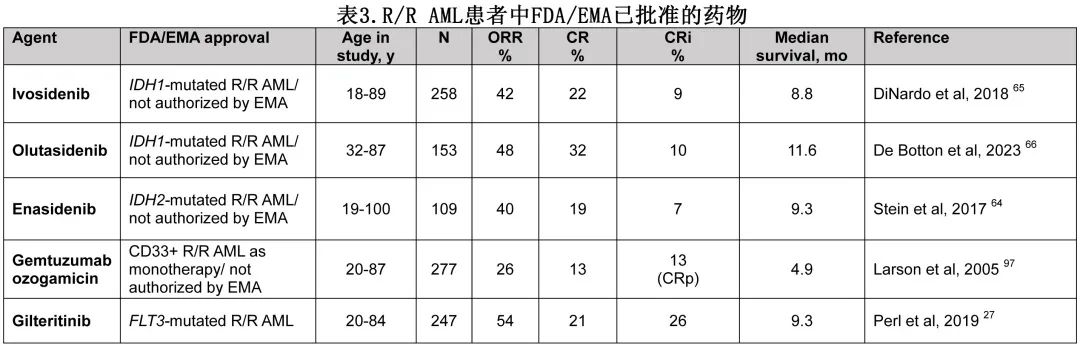
在一项多中心回顾性队列研究中,研究者评估了22例携带FLT3或IDH1/2突变的AML患者(7例携带FLT3-ITD,2例携带FLT3-KTD, 3例携带IDH1, 7例携带IDH2, 3例同时携带FLT3和IDH2突变)在HMA/VEN一线治疗后对挽救治疗的应答情况,患者靶向治疗,包括吉瑞替尼(11例,其中3例联合HMA)、索拉非尼联合HMA(1例)、ivosidenib(2例)、olutasenib(1例)、enasidenib(7例,其中3例联合HMA)。HMA/Ven治疗后疾病进展的中位OS仅为4.4个月(FLT3突变患者为5.6个月,IDH1/2突变患者为4.2个月)。然而,22例患者中有5例生存时间超过10个月,中位OS为11.5个月,而无反应患者为3.3个月。鉴于该回顾性分析的患者数量较少,因此需要谨慎解读结果;但对于选择性IDH1抑制剂olutasidenib,维奈克拉初治和既往维奈克拉暴露R/R AML的ORR无差异。
尽管如此,对于HMA/Ven后复发的患者以及原发性HMA/Ven难治性患者(例如TP53突变患者),仍有非常高的医疗需求。一种可能的方法是靶向巨噬细胞免疫检查点CD47的抗体,CD47是巨噬细胞免疫检查点,在癌细胞上充当“不要吃我”的信号,抑制CD47可促进白血病细胞的吞噬功能。R/R AML中研究Magrolimab (CD47抗体) 与AZA/VEN联合治疗,值得注意的是,在既往有VEN暴露的17例患者中,只有2例达到缓解(CRi),中位OS为3.1个月;考虑到这些不满意的结果而未纳入更多R/R患者。因此,HMA/Ven治疗后复发或难治患者的前景仍然不容乐观。
患者3
2022年,一名65岁男性在常规血液分析中观察到持续性全血细胞减少并接受骨髓活检。诊断性检查显示AML伴骨髓增生异常相关改变(AML-MRC)。骨髓细胞减少,原始细胞占20%,细胞遗传学分析显示复杂核型,分子筛查显示TP53、DNMT3A和NRAS突变。ECOG体能状态评分为1分,且无相关合并症,因此适合强化化疗。1个周期CPX-351化疗后患者获得CR。考虑到患者的高危遗传学特征而接受相合非亲缘供者异基因HCT。不幸的是,患者在异基因HCT后5个月复发。
问题:如何预防该患者异基因HCT后的复发?如果复发该怎么办?
治疗考虑:对于适合移植的AML患者,如预测复发率超过35%~40%,一般建议CR1期行异基因HCT。患者3基于TP53突变和复杂核型,复发概率特别高。
最近的研究表明,与非HCT治疗相比,异基因HCT可改善TP53突变MDS患者的OS;生存获益与TP53的等位基因状态无关。然而,尽管异基因HCT是预防复发的最有效巩固治疗,但高危AML患者中仍有45% ~ 55%在异基因HCT后复发,且TP53突变患者复发率甚至更高。移植后复发的预后非常差,2年OS率为14% ~ 25%,很少有长期治愈;移植后早期复发(即异基因HCT后6个月内)的患者预后尤其糟糕。因此,通过选择最佳的诱导治疗,在HCT前获得缓解的质量非常重要。
比较强化化疗和AZA/VEN作为诱导治疗的随机试验正在进行中。1/2期研究的初始数据提示,magrolimab对高危AML(包括TP53突变AML)可能特别有效。然而,比较AZA/VEN与AZA联合magrolimab单抗一线治疗TP53突变AML的关键研究因无效而提前终止。
此外,目前正在评估移植后预防复发的措施。关于索拉非尼和吉瑞替尼维持治疗的研究,是关于抢先维持治疗降低FLT3突变AML患者复发率的范例。在一项比较异基因HCT后阿扎胞苷维持治疗与观察的随机3期研究中,阿扎胞苷维持治疗未改善RFS。其他正在进行中的试验评估了异基因HCT或口服阿扎胞苷(CC486;NCT04173533)后AZA/VEN维持治疗的效果(VIALE-T研究;NCT04161885)。
在临床试验之外,预防移植后复发并没有标准疗法。作者的目标是尽快减少免疫抑制治疗,并将供者淋巴细胞输注(DLI)纳入治疗计划,以诱导移植物抗白血病(GvL)效应。DLI可以与其他疗法联合使用,如强化化疗、阿扎胞苷、靶向治疗等,但需要仔细监测移植物抗宿主疾病(GvHD)。对于一小部分患者,可考虑进行第二次异基因HCT,例如对于既往无GvHD且晚期复发的较年轻患者。在一项纳入418例首次异基因HCT后复发的成人患者的回顾性EBMT注册研究中,第二次异基因HCT组(n=137)的2年OS为26%,而DLI组(n=281)的2年OS为25%;5年OS也无显著差异(19% vs 15%)。因此只要有可能,就应支持使用DLI。
未来方向/展望
为了改善R/R AML患者的预后,目前正在研究三联疗法,尤其是在老年患者中。AZA/VEN联合靶向治疗(如ivosidenib、enasidenib、gilteritinib)或联合其他新药(如magrolimab、revumenib、IMGN632)的三联方案正在评估中。但三联方案的主要挑战之一是找到正确的方案和剂量,因为这些方案具有显著的骨髓抑制作用。在一项1b/2期研究中,对于FLT3突变患者,不论之前是否接受过TKI治疗,吉瑞替尼+维奈克拉联合治疗均使改良的复合完全缓解(mCRc)率(CR+CRi+CRp+MLFS)达到75%;中位缓解持续时间为4.9个月。三联疗法AZA/VEN +吉瑞替尼可使74%的患者(n=14)达到缓解;中位OS为5.8个月,1年OS率为27%。同样,在一项1b/2期研究中,15例IDH1/2突变R/R AML患者接受ASTX727(口服地西他滨/cedazuridine)和维奈克拉联合ivosidenib或enasidenib治疗:ivosidenib组和enasidenib组的CRc率分别为50%和56%,且维奈克拉初治患者缓解率最高。IMGN632是一种靶向cd123的抗体-药物偶联物(ADC),在一项1/2期研究中,研究者首先在35例R/R AML患者中研究了IMGN632与AZA/VEN联用,其ORR为55%,且在高强度队列中缓解率更高。在纳入61例R/R AML患者的后续研究中,维奈克拉初治患者的ORR为62%,CCR为47%,而既往暴露患者的ORR为37%,CCR为11%。
另一种方法是基于T细胞的免疫疗法,如CAR T细胞、双特异性T细胞接合抗体(BITEs)或双亲和力重靶向(dual-affinity retargeting,DART)抗体。但由于难以找到最合适的靶点,免疫治疗在AML中的发展滞后;包括骨髓抑制在内的脱靶效应以及早期临床试验中不令人满意的疗效仍然存在问题。此外,CAR T细胞在体内的长期持续存在具有挑战性。目前研究的是不同谱系限制性抗原,如CD33、CD123、CLL-1 (CLEC12A)和FLT3。例如靶向CD33的BITEs(如AMV564、AMG330),这些药物对AML仅显示出适当疗效。Flotetuzumab和vibecotamab是基于CD3ε和CD123的双特异性DART抗体分子。Flotetuzumab在88例R/R AML患者中进行了1/2期研究,在接受2期剂量药物治疗的患者(n=30)中,ORR为30%,达到CR/CRh的患者中位OS为10.2个月。靶向CLL1 AML中CAR-T细胞的研发也在不断进展,无显著骨髓毒性,在儿童AML的早期研究取得了有前景的结果。
综上所述,R/R AML患者的治疗选择在不断演变,但仍需要在临床前和临床水平进行大量的工作,以显著改善这些患者的前景和预后。
参考文献
Thol FR, Döhner H, Ganser A.How I treat refractory and relapsed acute myeloid leukemia.Blood . 2023 Nov 9:blood.2023022481. doi: 10.1182/blood.2023022481.


