首例:BRCA突变晚期三阴性乳腺癌经奥拉帕利三线治疗半年后完全缓解,PFS已40个月
时间:2023-12-05 13:33:10 热度:37.1℃ 作者:网络
虽然标准治疗在BRCA突变患者中显示出疗效,但复发率较高,需要其他有效疗法。奥拉帕利是一种聚腺苷二磷酸核糖聚合酶(PARP)抑制剂,获批用于治疗胚系 BRCA1/BRCA2 突变转移性乳腺癌(BC),证据表明,与标准化疗相比,其带来无进展生存期(PFS)获益,安全性良好,患者生活质量改善。本文描述了一例BRCA1突变晚期BC患者,在化疗和免疫治疗后接受了奥拉帕利全身治疗。2011 年 3 月,38 岁时,患者首次被诊断为右乳早期 BC,接受了象限切除术加同侧腋窝淋巴结清扫术,以及5-氟尿嘧啶、表柔比星和环磷酰胺(FEC)辅助化疗,随后放疗。5年后,发现对侧结节,进行左乳象限切除术,随后辅助全身治疗,包括多西他赛加环磷酰胺化疗和放疗。基因检测显示胚系BRCA1有害变异,接受了预防性双侧乳腺切除术和卵巢切除术。1年后,发现皮肤转移和骨浸润,开始一线全身治疗。患者参加了IMpassion131试验(阿替利珠单抗加紫杉醇),但揭盲显示她被随机分配到安慰剂组。接受了 LAG525 联合卡铂作为二线治疗(CLAG525B2101 试验),PFS 为 14 个月。疾病进展时,有资格接受奥拉帕利(300 mg,每日两次)三线治疗,并在治疗 6 个月后完全缓解,撰写本文时 PFS 为 40 个月。本文患者先前接受了化疗和免疫治疗,奥拉帕利三线治疗后完全缓解,且反应持久,耐受性和生活质量相对较好,据我们所知,这是首例此类病例报道。
背 景
尽管治疗取得了进展,并且通过筛查计划越来越早地发现,但乳腺癌(BC)仍然是世界上最常见的癌症,2020 年有 230 万女性被诊断为 BC,有685000 人死亡。每8名女性中就有1名在其一生中受BC影响,在40岁以下的女性中,BC的发病率为109.2/10万。30 多年前发现的 BRCA1 和 BRCA2 致病变异仍然是临床最相关的易感基因。前瞻性队列研究的数据显示,BRCA1 突变(以下作为致病性变异的同义词)携带者罹患 BC 的风险为 72%(80 岁时),BRCA2 突变携带者为 69%,尽管不同研究的数据有所不同。BRCA致病变异相关BC患者疾病通常高危,具有侵袭性,尽管进行了标准治疗,包括手术、放疗和化疗/免疫治疗,但复发率很高。该患者群体对其他新型靶向疗法的需求仍未得到满足,这些疗法可能产生改善和持久的结果。
BRCA1 和 BRCA2 是抑癌基因,编码的蛋白通过同源重组修复(HRR)参与DNA双链断裂修复。BRCA 突变相关 BC 更可能由于 HRR 通路缺陷无法修复双链 DNA 断裂。聚腺苷二磷酸核糖聚合酶(PARP)对修复 DNA 单链断裂很重要,缺乏功能性 BRCA1/BRCA2 的细胞对 PARP 抑制敏感。PARP 抑制剂靶向具有 HRR 缺陷的癌症,可导致合成致死和癌细胞凋亡。奥拉帕利是一种口服 PARP 抑制剂,基于随机、对照、开放标签、多中心、国际 3 期 OlympiAD 试验的阳性结果,美国食品药品监督管理局(FDA)(2018 年 1 月)批准其用于转移性 BC,欧洲药品管理局(EMA)(2019 年 4 月)批准其用于局部晚期/转移性 BC。该研究招募了胚系 BRCA(gBRCA)突变、HER2阴性的转移性 BC 患者,这些患者既往接受过不超过两种转移性疾病化疗方案。结果显示,奥拉帕利单药治疗(205 名患者分配到奥拉帕利组,每日两次,每次 300 mg)相比医生选择的标准治疗(TPC;卡培他滨、艾立布林或长春瑞滨,21 天为一周期,97 名患者)有显著获益。与TPC相比,奥拉帕利单药治疗组的中位PFS延长2.8个月(7.0 vs. 4.2个月),疾病进展或死亡风险低42%。重要的是,与TPC相比,奥拉帕利组的生活质量(QoL)改善,奥拉帕利组有更高比例的患者最佳总体反应评估为“改善”(33.7% vs 13.4%)。干预组的大多数不良事件(AE)为 1/2 级,奥拉帕利组报告 3 级或更高级别 AE 的患者比例(38.0%)低于 TPC 组(49.5%)。奥拉帕利剂量中断对治疗持续时间没有显著影响,因不良事件停止奥拉帕利治疗的患者较少(<5%)。本文报道了一例BRCA1突变(BRCA1m)晚期BC患者,在化疗和免疫治疗后接受了奥拉帕利全身治疗。
病 例
患者为一名白人女性,无相关个人病史,除了很少用低剂量皮质类固醇治疗轻度支气管哮喘。2011 年 3 月,38 岁时,首次被诊断为右乳早期 BC(图 1)。乳腺和腋窝淋巴结超声扫描显示右乳外上象限有一个边缘不规则的结节(直径 23 mm)。双侧乳腺X线显示右乳不透射线,细针穿刺活检显示恶性细胞(C5)(图2)。随后粗针穿刺活检显示浸润性导管癌(ER:0%,PgR:0%,Ki-67:30%,HER2-neu:0),肿瘤标志物如下:CA-15.3 20.7 U/ml,CEA 2.1 ng/ml。未发现远处转移。接受了右乳保乳手术和同侧腋窝淋巴结清扫术。术后TNM分期为pT2(28mm)G3 pN1a(1+/20)。进行辅助治疗(5-氟尿嘧啶 500 mg/m2、表柔比星 100 mg/m2 和环磷酰胺 500 mg/m2,3个周期,每21天一周期,随后多西他赛 100 mg/m2,3个周期,每21天一周期)和右乳放疗。
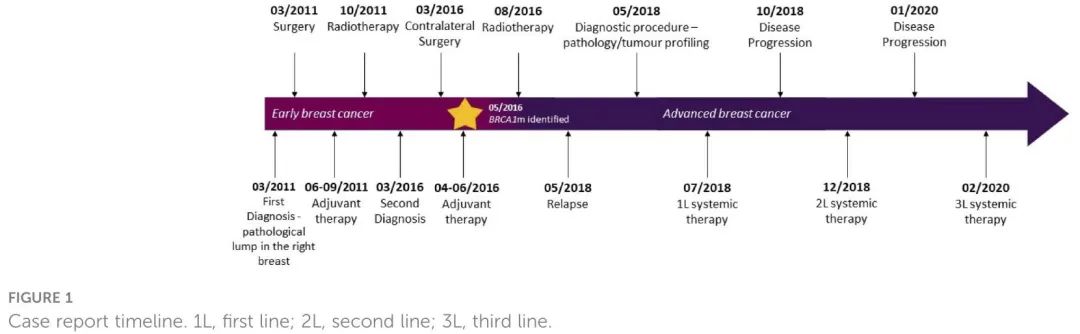
图1. 时间线

图2. 基线乳腺X线显示右乳病理性肿块
随访结果一直为阴性,直到 2016 年 3 月发现第二个对侧结节(15 mm)。同样,没有远处转移的迹象。进行保乳手术(左乳象限切除术)和同侧腋窝取样[术后pT1c 18 mm,pN0(0/10),ER:0%,PgR:0%,Ki-67:75%,HER2-neu:0],然后多西他赛600 mg/m2加环磷酰胺75 mg/m2治疗,4个周期,每21天一周期,随后放疗。
由于早发性异时性 BC 和家族史,包括乳腺癌和卵巢癌(外祖母),转诊至意大利那不勒斯费德里科二世大学遗传性癌症遗传学诊所。2016年5月,胚系BRCA基因检测结果显示BRCA1基因有害变异c.3514G>T p.Glu1172*。分别于 2017 年 6 月和 7 月接受了预防性双侧乳腺切除术和卵巢切除术。1年处于无病生存,随后,2018 年 5 月,PET-CT 扫描显示左乳皮肤受累,左腋窝和左内乳多个淋巴结摄取增高,以及骨浸润(左侧第四和第六肋骨)(图 3)。病理检查显示乳腺癌皮肤转移(ER:0%,PgR:0%,Ki-67:80%,HER2-neu:0)。肿瘤血清标志物在正常值范围内:CA-15.3 13.9 U/ml,CEA 2.1 ng/ml。
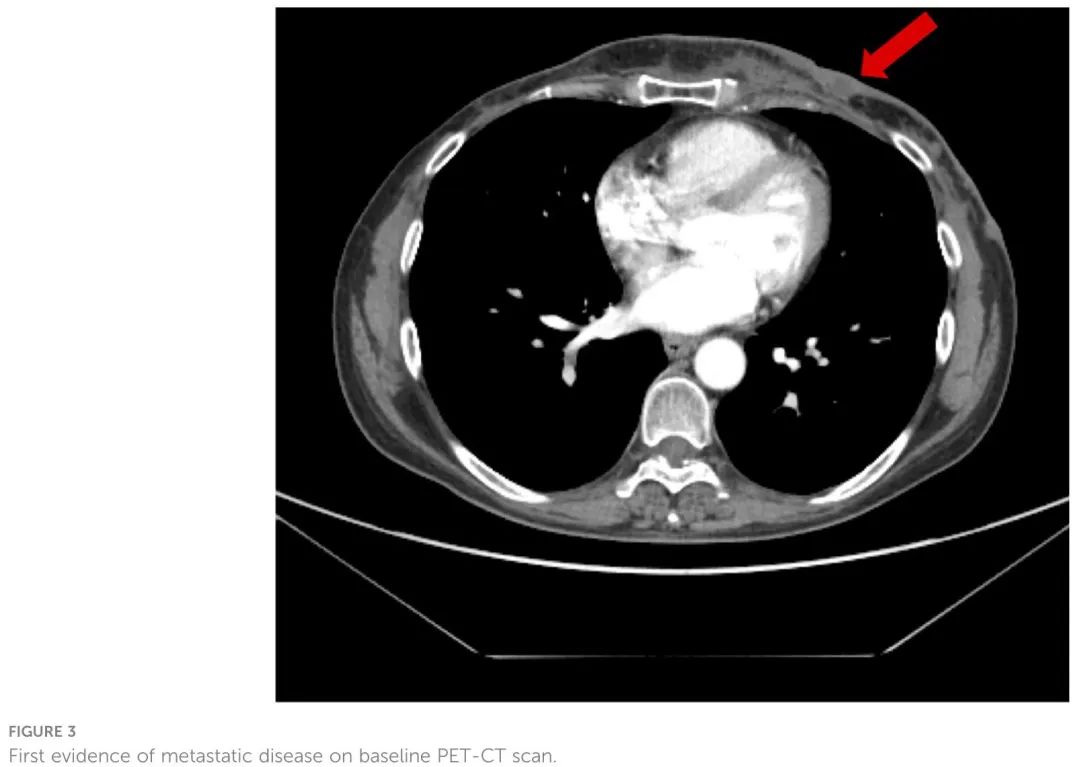
图3. 基线PET-CT扫描显示转移性疾病
2018 年 7 月,参加了评估化疗联合免疫治疗的 III 期 IMpassion131 试验 [静脉输注阿替利珠单抗 840 mg 或安慰剂,第 1 天和第 15 天(± 3 天),每 28 天重复,加紫杉醇 90 mg/m2,第 1、8 和 15 天,每 28 天重复,直至疾病进展或不可接受的毒性]。接受了4个周期的治疗。疾病进展时的试验揭盲显示,患者在安慰剂组。
2018年12月,出现轻度咳嗽和呼吸困难,胸部CT显示左胸壁疾病进展。于是,停止了正在进行的转移性 BC 治疗,参加了CLAG525B2101试验,该试验探索了LAG525 联合 spartalizumab,或联合spartalizumab 和卡铂,或联合卡铂(图 4A)。LAG525 是一种人源化 IgG4 单克隆抗体,作为检查点抑制剂结合淋巴细胞活化基因 3(LAG-3)蛋白,阻止其与主要组织相容性复合体 II 类(MHC-II)分子的相互作用。虽然spartalizumab是一种针对人类程序性死亡-1(PD-1)受体的单克隆抗体,但也抑制免疫检查点。患者接受 LAG525(400 mg,每 21 天一次 )联合卡铂(AUC 6,每 21 天一次),均静脉输注(iv),共 17 个周期,直至疾病进展。PFS为14个月。AE包括血小板减少症 3 级(G3)、腹泻 G1、呕吐 G1 和甲状腺功能减退症 G2。卡铂在10个周期后因输注相关超敏反应而停用。
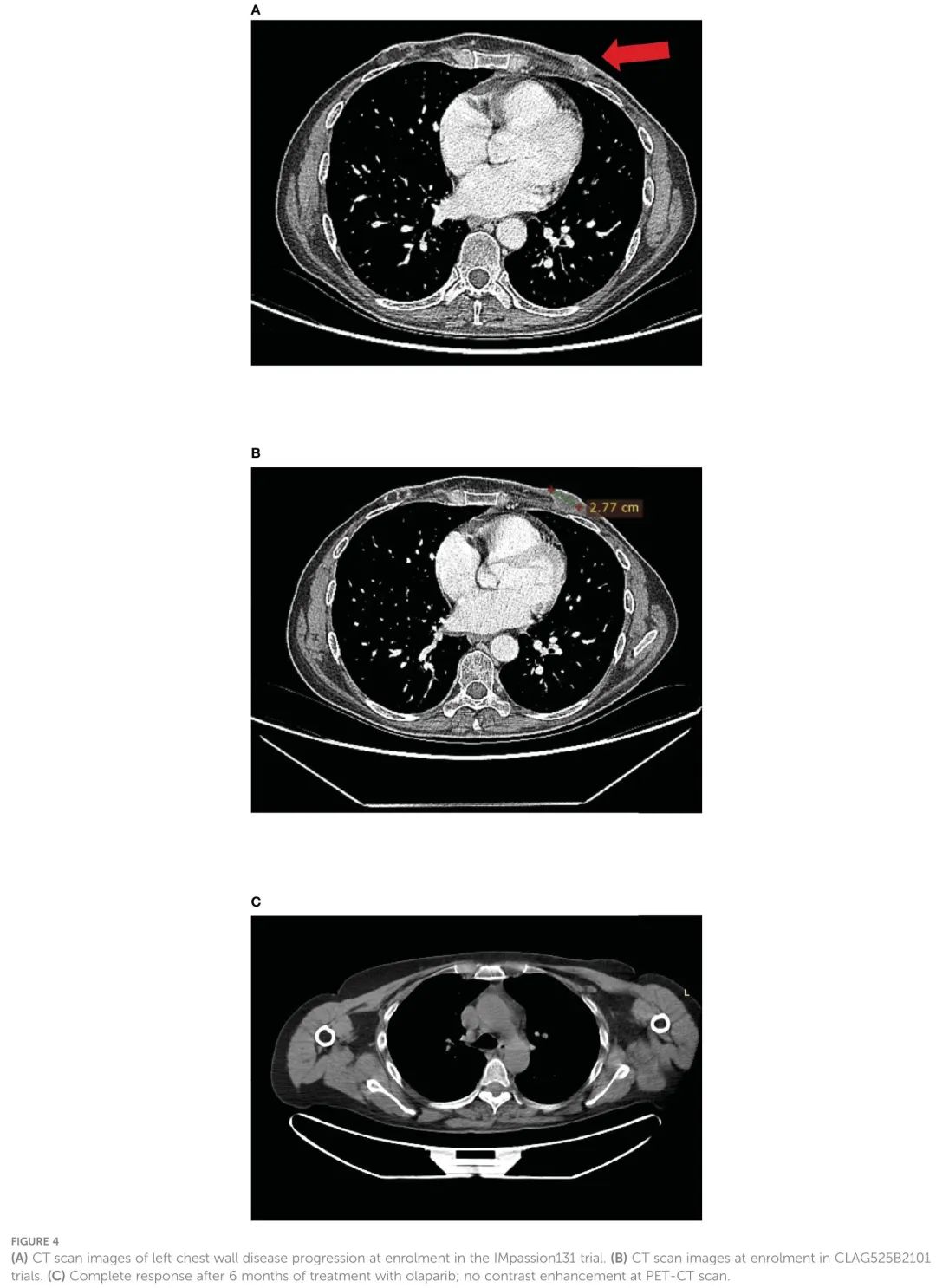
图4.(A)IMpassion131试验入组时左胸壁疾病进展的CT扫描图像;(B)CLAG525B2101试验入组时的CT扫描图像;(C)奥拉帕利治疗6个月后完全缓解;PET-CT扫描无对比增强。
2020 年 2 月,作为一名胚系 BRCA 突变患者,且既往接受过不超过两种转移性疾病化疗方案,有资格接受奥拉帕利(300 mg,每日两次)治疗(图 4B)。治疗耐受性良好,除了 G2 贫血导致剂量减少——7 个月后奥拉帕利剂量为 100 mg 加 150 mg 片剂,每日两次。报告的其他AE包括恶心、呕吐和腹泻(均为 G1)。PET/CT扫描未见摄取增高(图4C)。奥拉帕利治疗6个月后完全缓解,在撰写本文时,患者的PFS为40个月。患者很感激能够接受不影响生活质量的有效治疗。患者45岁时知道疾病处于晚期,一线治疗的PFS只有5个月。通过持久且总体耐受性良好的口服治疗实现疾病完全缓解也增加了对治疗本身的依从性,增强了疗效。
讨 论
近年来,BC的诊断和治疗格局发生了巨大变化,引入了全身靶向治疗,提高了缓解率,延长了生存期,同时保持生活质量。本文患者在 38 岁时首次被诊断为早期 BC。参加了IMpassion131试验,一线治疗是每周一次紫杉醇加安慰剂(不含阿替利珠单抗),PFS为5个月。IMpassion131/130 试验探索了在转移性三阴性 BC(TNBC)的一线治疗中,将免疫治疗药物阿替利珠单抗加入紫杉烷化疗的益处。IMpassion130 研究结果表明,对于程序性死亡配体 1(PD-L1)阳性疾病患者,阿替利珠单抗联合白蛋白结合型紫杉醇可改善 PFS ,带来具有临床意义的总生存期(OS)获益,阿替利珠单抗联合白蛋白结合型紫杉醇或可作为这一需求高度未满足疾病的重要治疗选择。然而,在后续的IMpassion131研究中,这些结果没有得到复制——与单独使用紫杉醇相比,阿替利珠单抗联合紫杉醇并未改善意向治疗(ITT)人群或PD-L1阳性组的PFS或OS。二线治疗是 LAG525 免疫治疗加卡铂,LAG525 可抑制 LAG-3(一种与 T 细胞增殖和细胞因子生成减少相关的抑制性免疫受体)。共接受 17 个周期的治疗(10 个周期后由于 AE 停用卡铂),PFS 为 14 个月。接受奥拉帕利作为三线治疗,基于具有里程碑意义的OlympiAD试验显示,与化疗相比,奥拉帕利可改善PFS,还可减少住院治疗(口服治疗相比静脉输注的优势)以及改善生活质量。之后,OlympiA研究展现了“改变实践的结果”——首次报告了PARP抑制剂辅助治疗对胚系BRCA1/2突变相关早期BC的益处。这项双盲、随机、III 期试验招募了具有 BRCA1 或 BRCA2 胚系致病性或可能致病性变异和高危临床病理因素的 HER2 阴性早期 BC 患者,这些患者既往接受过局部治疗和新辅助/辅助化疗。中位随访 3.5 年,接受奥拉帕利治疗的患者侵袭性无病生存率(IDFS)改善,BC 的局部和转移性复发、其他新发癌症以及因任何原因导致的死亡降低 37%。在携带胚系BRCA1/BRCA2有害变异的高危HER2阴性早期BC患者中,局部治疗和新辅助/辅助化疗后进行奥拉帕利辅助治疗相比安慰剂,与IDFS和无远端疾病生存期(DDFS)显著较长相关。更重要的是,报道了奥拉帕利辅助治疗可提高该人群OS率(4年OSΔ3.4%,95% CI 0.1%-6.8%)。该研究的首席研究员总结道,“在手术和化疗后接受奥拉帕利治疗的患者相比接受安慰剂的患者,更有可能无癌存活,[以及]不发生转移——在对PARP 抑制剂用于 BC 进行了 10 年的评估后,一种可能挽救许多生命的疗法终于即将可及”。目前,一些证据表明了 PARP 抑制剂用于非胚系 BRCAm 晚期 BC 的有效性。随机对照 II 期 S1416 试验报告,在铂类化疗中加入veliparib(维利帕尼)可有效治疗具有 BRCA 样表型的转移性胚系 BRCA 野生型 TNBC [同源重组缺陷(HRD)导致基因组不稳定]。II 期 TBCRC 048 试验进一步评估了奥拉帕利单药用于具有胚系(BRCA 除外)或体细胞(包括 BRCA)DNA 损伤反应通路基因致病变异的晚期 BC 患者。在体细胞 BRCA1/2 或胚系PALB2(BRCA2的伴侣和定位器)突变患者中,PARP 抑制剂治疗带来客观缓解。
总之,本病例表明,在转移性 BC 患者中,奥拉帕利三线治疗可导致快速持久的反应,临床完全缓解,生活质量相对较好。
参考文献:
Caputo R, Pagliuca M, Pensabene M, Parola S, De Laurentiis M. Long-term complete response with third-line PARP inhibitor after immunotherapy in a patient with triple-negative breast cancer: a case report. Front Oncol. 2023 Aug 4;13:1214660. doi: 10.3389/fonc.2023.1214660. PMID: 37601649; PMCID: PMC10438988.



