Cell Death Differ 空军军医大学唐都医院李妍教授团队揭示内质网蛋白RTN3调控心肌细胞脂滴生成的作用机制
时间:2023-12-09 20:48:13 热度:37.1℃ 作者:网络
脂代谢在心脏能量供应中起着至关重要的作用,心肌细胞60-80%以上的能量供应来源于脂肪酸β氧化。肥胖患者心肌组织中存在显著脂质代谢紊乱,主要表现为脂质异常堆积及脂滴含量增多,伴随出现肥胖患者心功能受损。动物试验也表明增加小鼠心肌脂质含量可导致左室功能障碍的出现。脂滴是细胞中负责脂质存储的主要细胞器,然而心肌细胞中脂滴生成的具体机制尚不明晰,肥胖如何影响心肌细胞脂滴含量也尚不明确。
2023年11月28日,空军军医大学唐都医院李妍教授团队在Cell Death & Differentiation杂志在线发表了题为“Lipid overload-induced RTN3 activation leads to cardiac dysfunction by promoting lipid droplet biogenesis”的研究论文,首次揭示了内质网蛋白RTN3在心肌细胞脂滴生成中的关键作用,明确了脂质超载通过激活RTN3介导的脂滴生成进而引发心肌脂质堆积及心功能障碍的具体机制,为治疗肥胖相关心功能障碍提供了新思路。

首先,作者发现高脂喂养(HFD)小鼠随着喂养时间延长,逐步出现心肌脂质堆积及心脏功能障碍,伴随出现心肌细胞RTN3表达量显著升高。
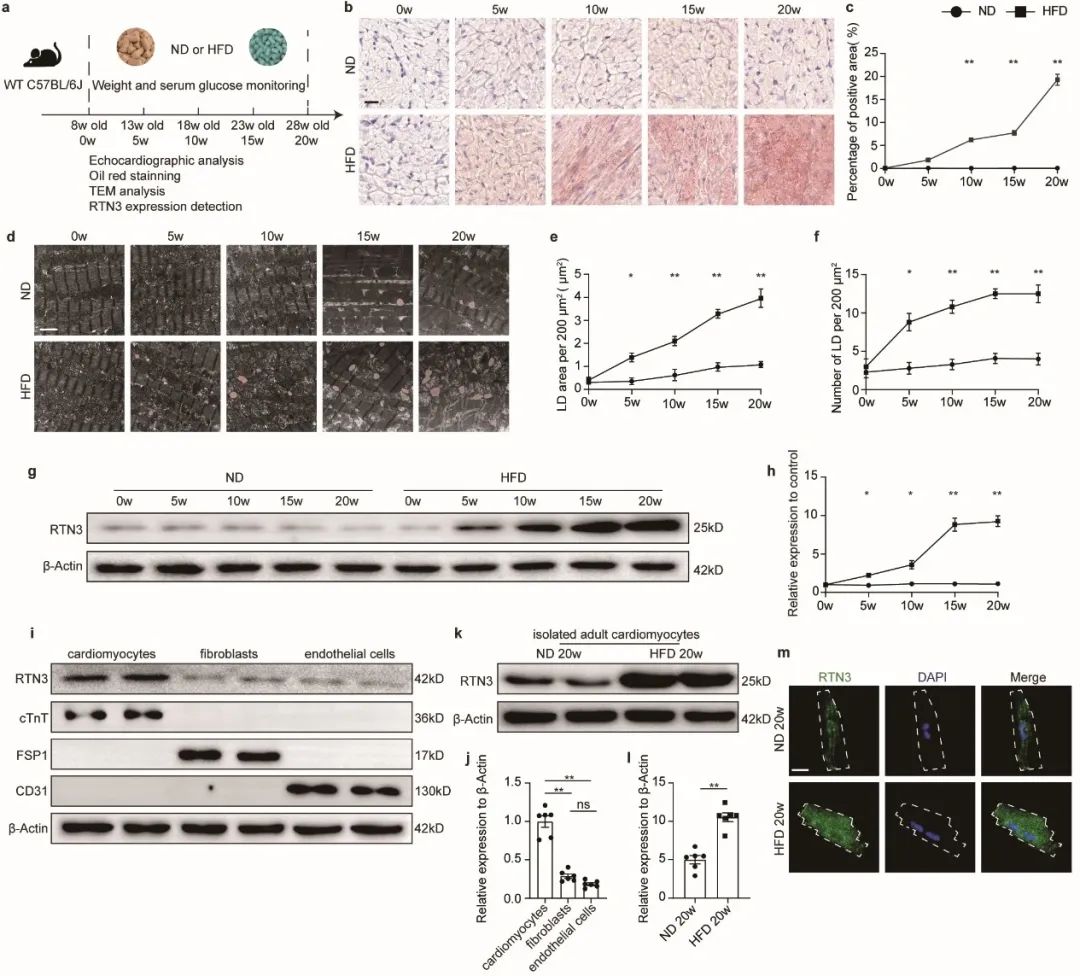
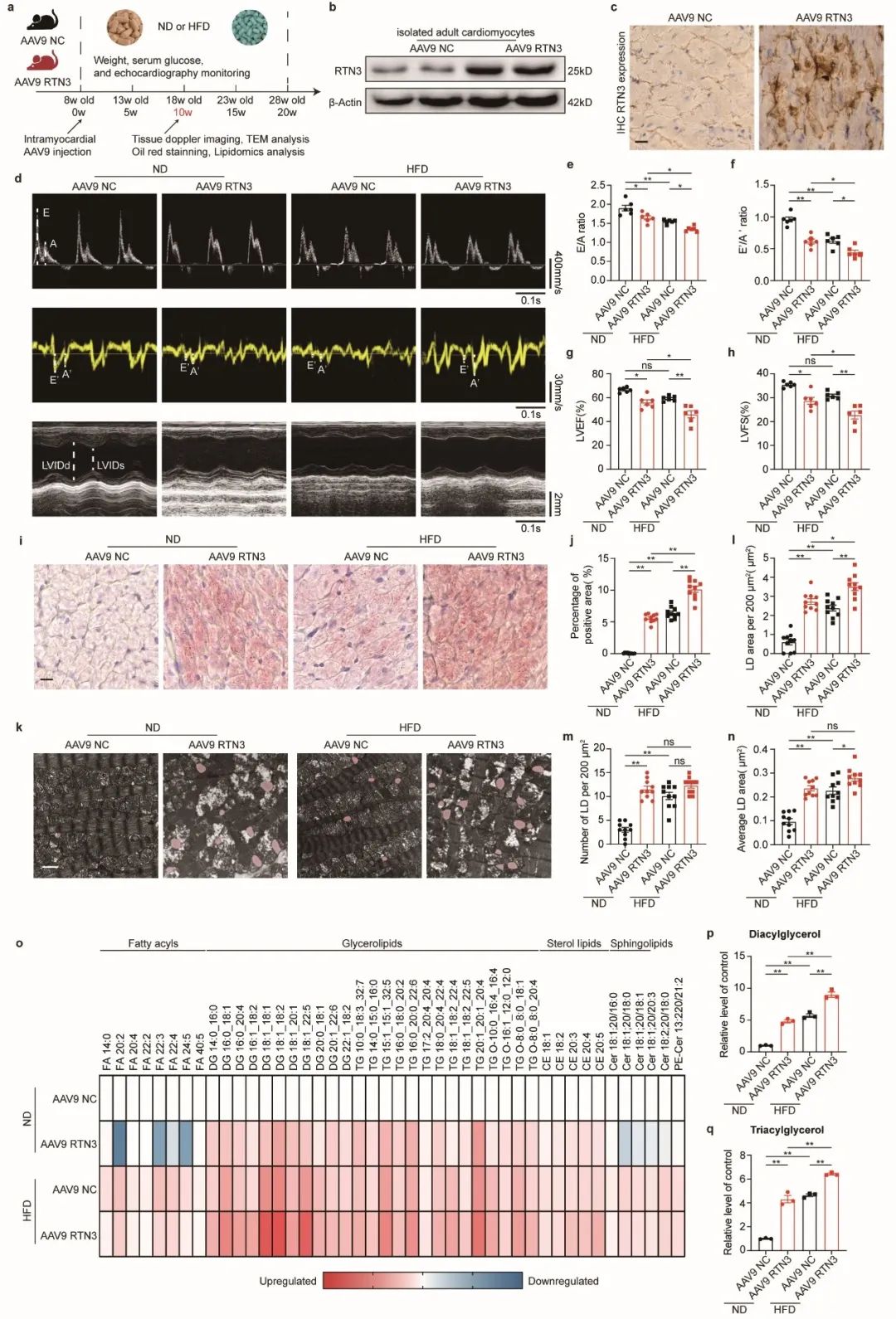
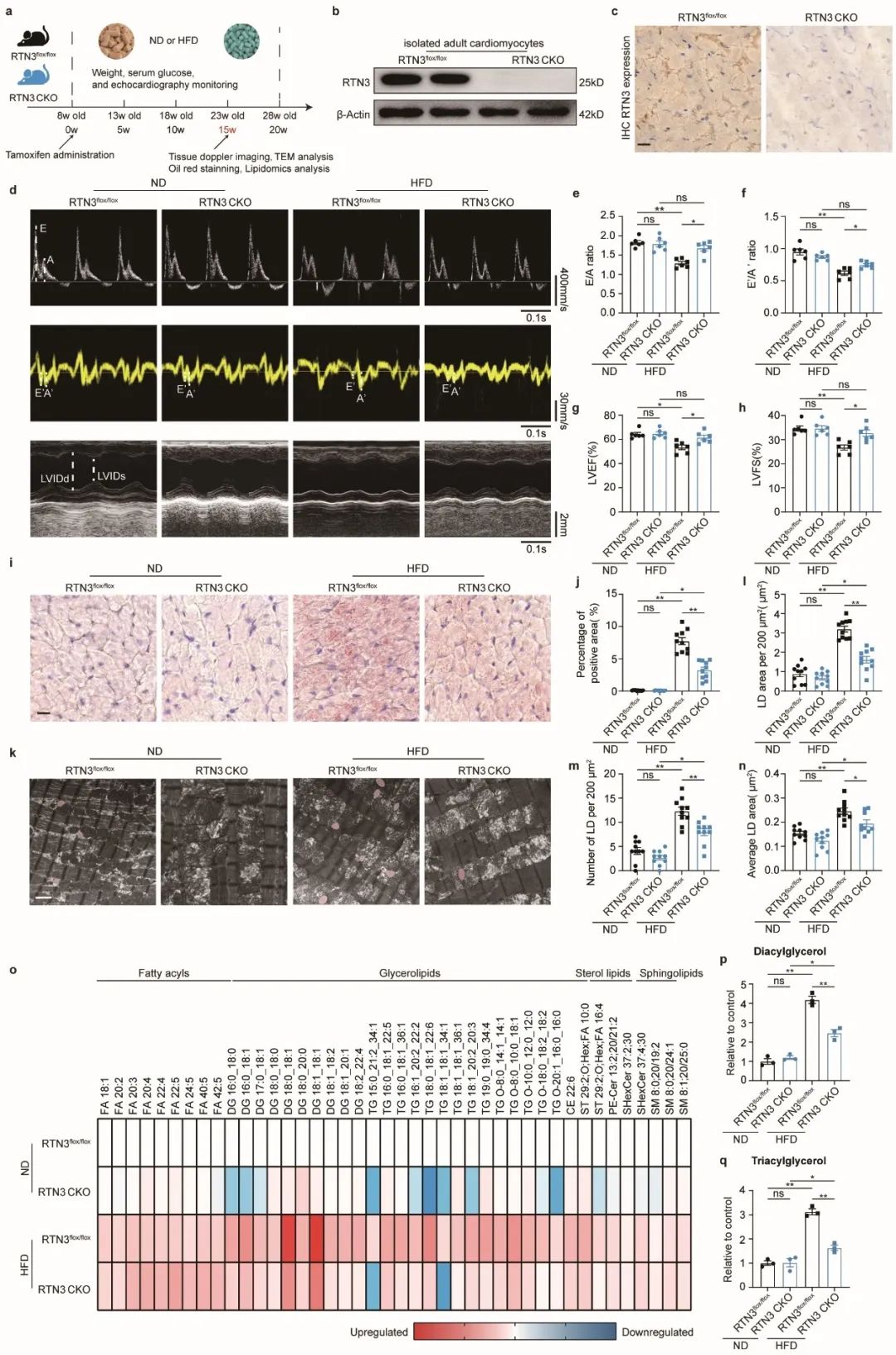
为进一步明确RTN3在心肌脂质代谢中的作用,作者分别构建了心肌细胞特异性RTN3过表达/敲除小鼠。结果表明,心肌细胞特异性过表达RTN3可导致小鼠出现心肌脂质堆积及心脏功能障碍,与HFD小鼠表型相一致;心肌细胞特异性敲除RTN3可抑制HFD引发的心肌脂质堆积及心功能障碍。上述结果表明,RTN3确为心肌脂质代谢中的关键分子,参与了肥胖相关心功能损伤。
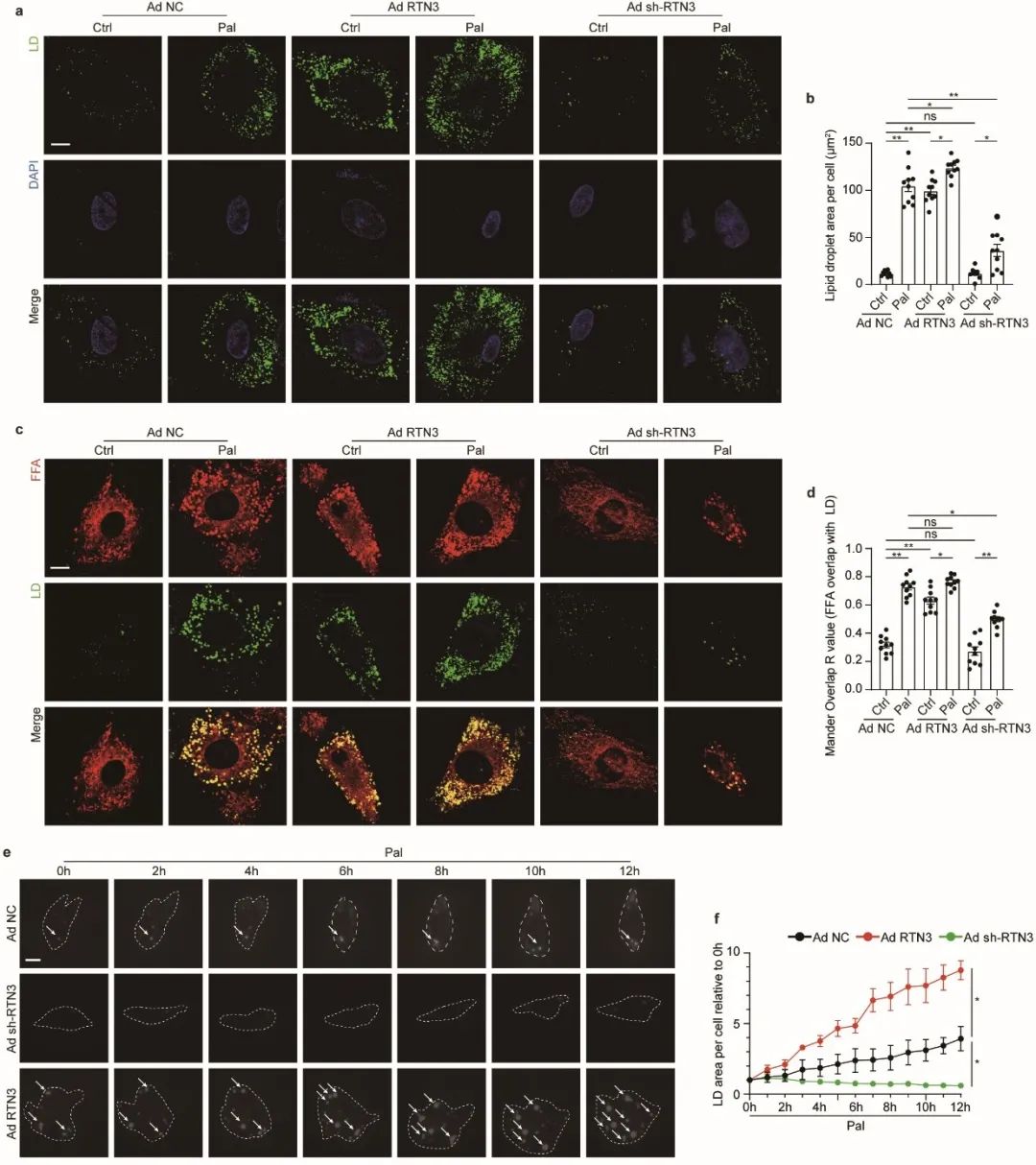
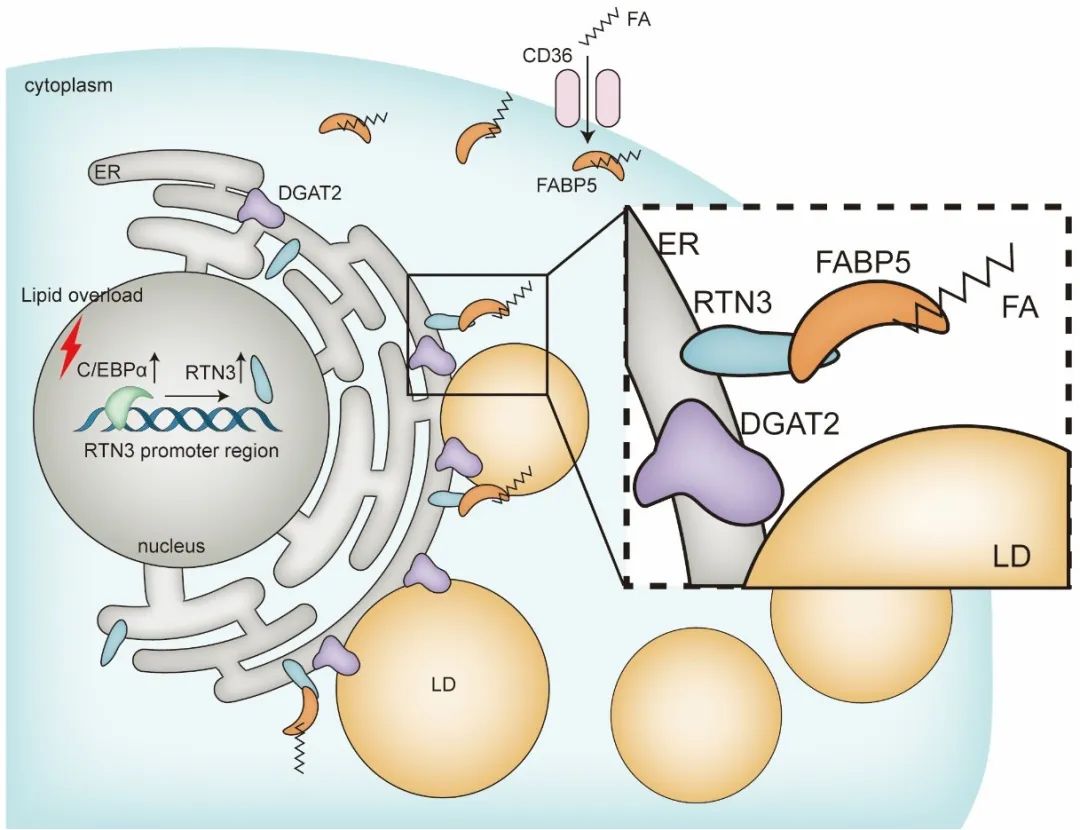
接下来,作者在体外实验中进一步探索RTN3参与心肌脂代谢的具体机制。作者发现过表达RTN3可加速心肌细胞脂滴生成,敲低RTN3可抑制棕榈酸诱导的心肌细胞脂滴生成。且干预RTN3并未影响心肌细胞对游离脂肪酸(FFA)的摄取,但过表达RTN3可显著增加FFA与脂滴共定位,降低其与线粒体共定位,提示RTN3通过影响FFA细胞亚定位参与脂滴生成。
下一步,作者通过CO-IP联合质谱的方法对RTN3互作蛋白进行了检测,发现RTN3与脂肪酸转运蛋白FABP5存在相互作用。FABP5是细胞内负责长链脂肪酸转运的关键伴侣分子,结合RTN3的内质网定位,作者猜想RTN3-FABP5复合体可能介导了FFA向内质网的靶向转运、为脂滴生成提供原料、进而参与了心肌细胞脂滴生成。为验证该猜想,作者通过敲低FABP5以干预RTN3-FABP5复合体的功能,发现敲低FABP5可显著抑制过表达RTN3引起的心肌细胞脂滴面积及FFA与脂滴的共定位。深入实验发现,RTN3的第1-65个氨基酸为其与FABP5的具体结合位点。
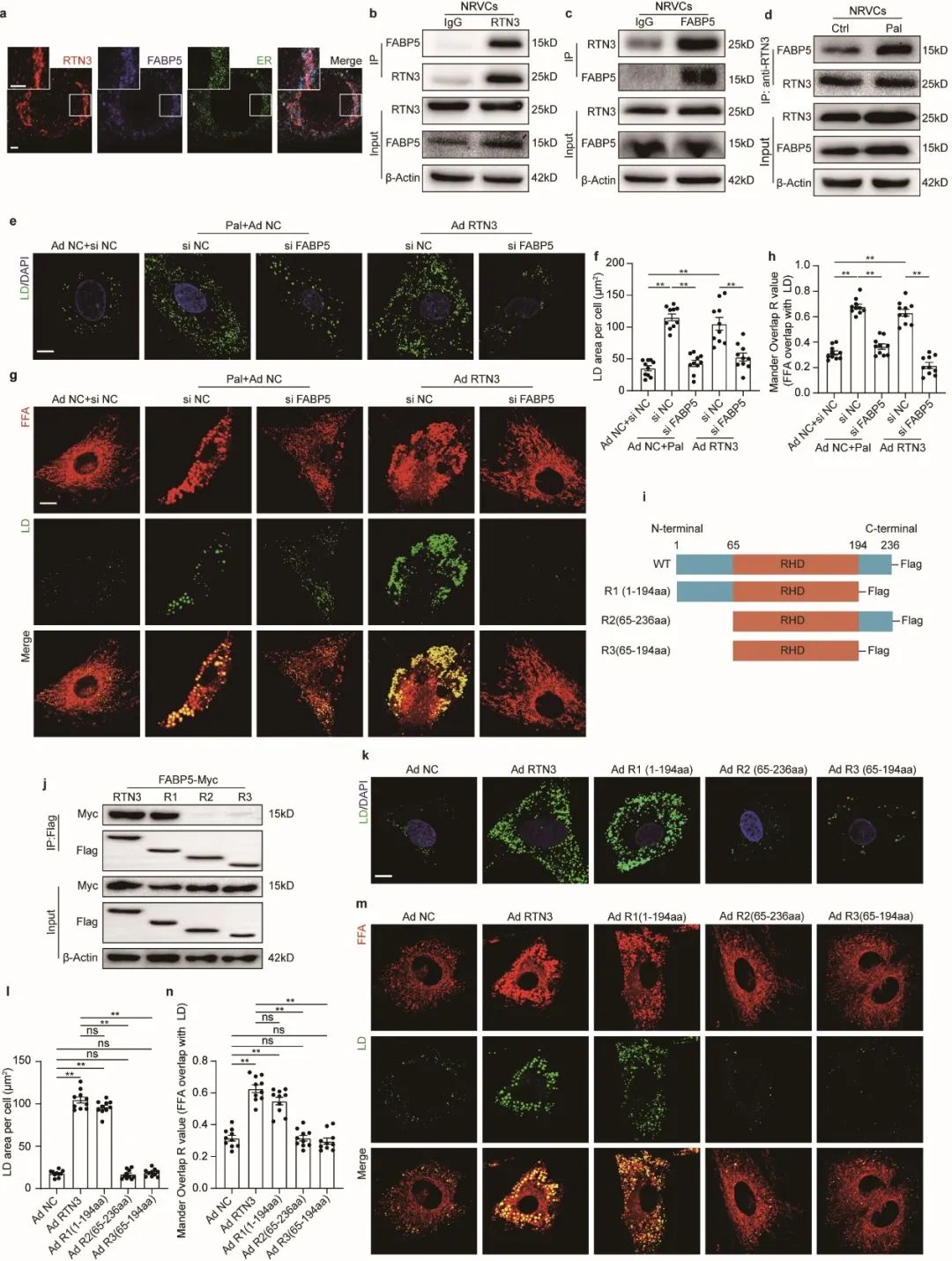
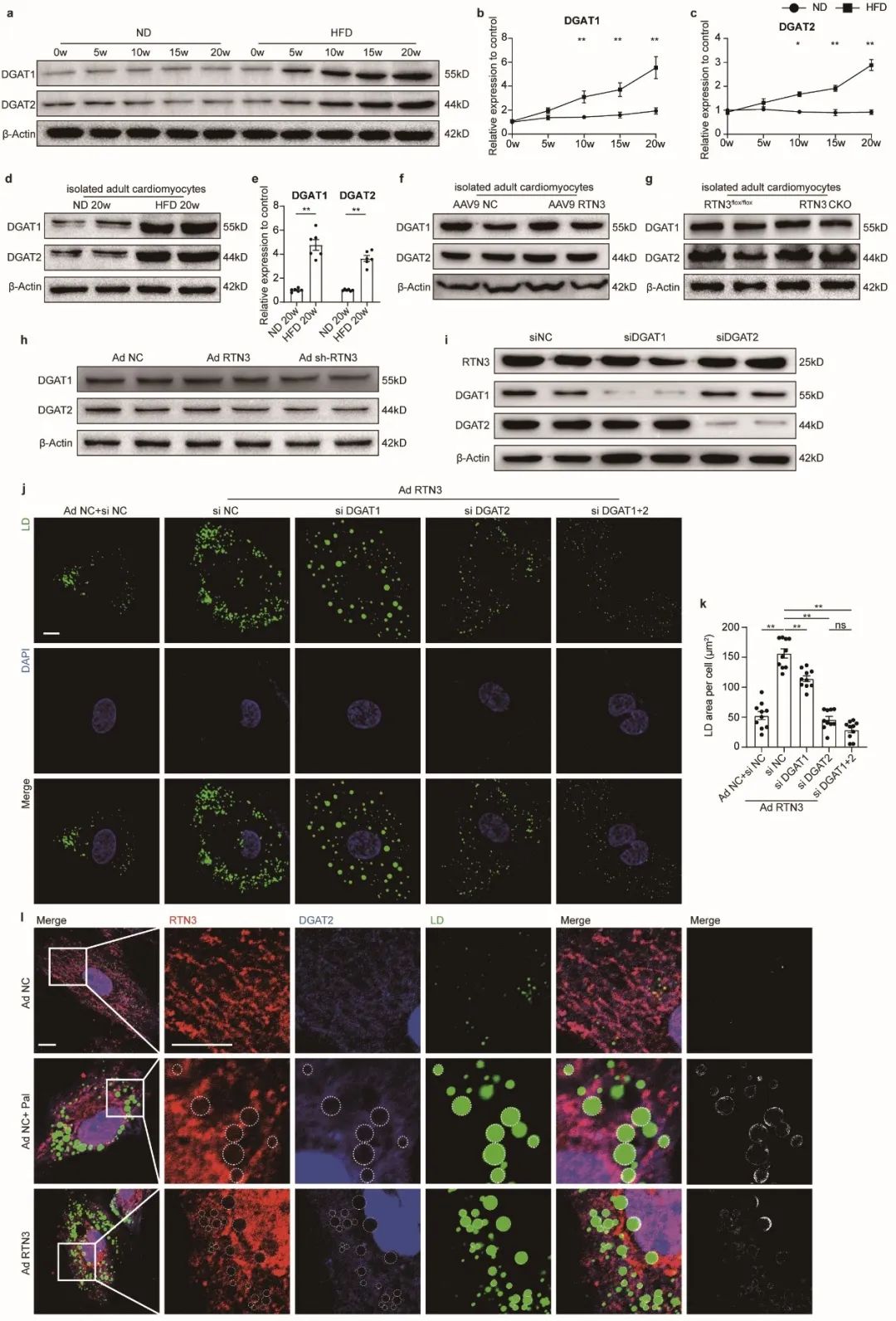
作者同时还探索了参与RTN3介导的脂滴生成的关键酶。二酰基转移酶(DGAT)家族为甘油三酯合成的关键限速酶,作者发现干预DGAT2可显著抑制RTN3介导的脂滴生成,且在脂质超载情况下,DGAT2与RTN3围绕脂滴形成显著的环状共定位,提示DGAT2为RTN3介导的脂滴生成中的关键限速酶。
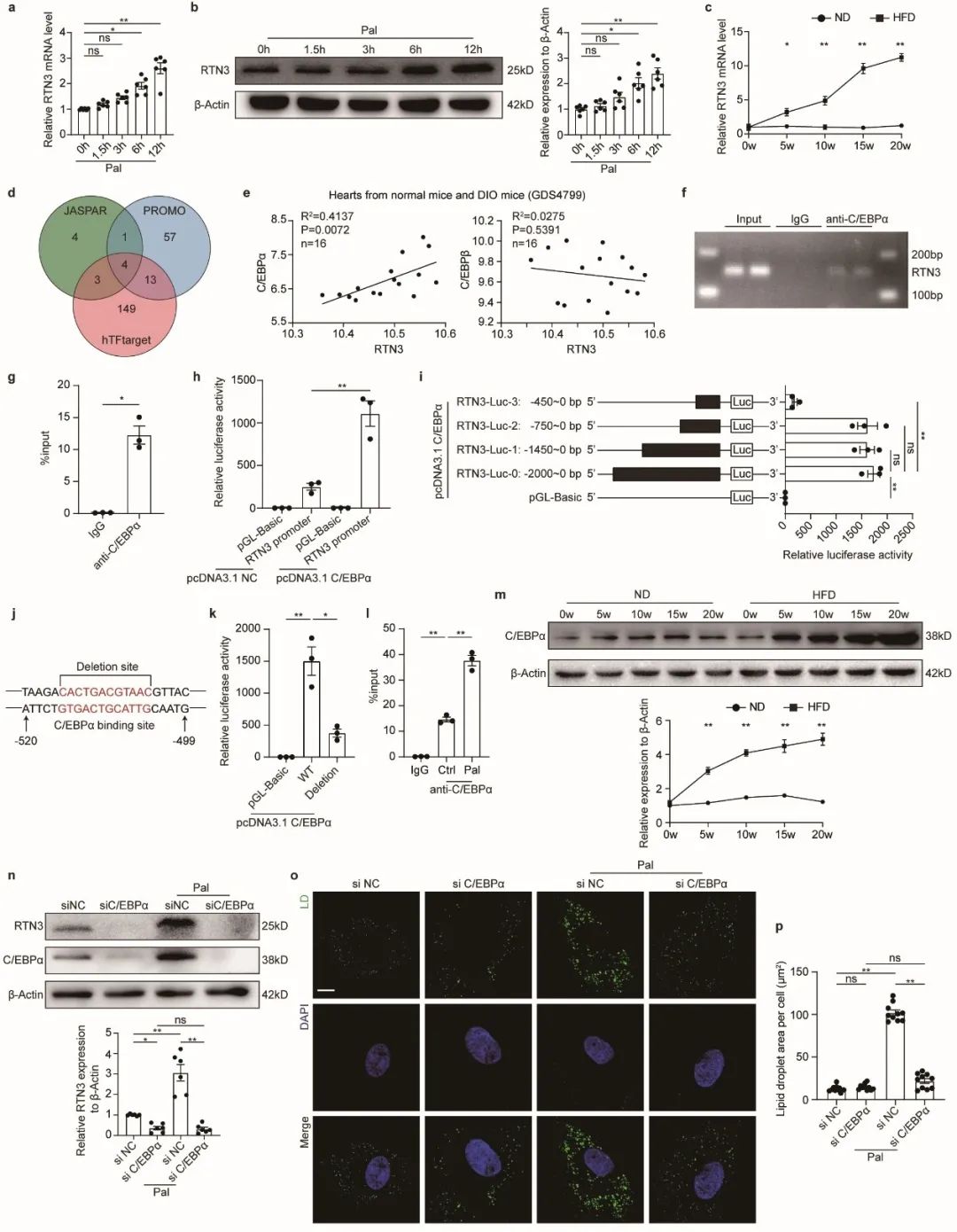
之后,作者希望探究肥胖如何影响心肌细胞脂滴生成与心肌脂质堆积。作者发现,在HFD小鼠模型及棕榈酸处理细胞模型中,RTN3的蛋白变化趋势与mRNA变化趋势相一致,提示RTN3表达量调控发生在转录层面。通过数据库预测及生信分析,作者发现C/EBPα可能为RTN3的转录因子。随后作者通过ChIP-PCR、双荧光素酶报告基因等多种方法明确C/EBPα通过结合在RTN3启动子区域的-504bp至-515bp正向调控RTN3转录,干预C/EBPα可显著影响RTN3表达量及其介导的脂滴生成。
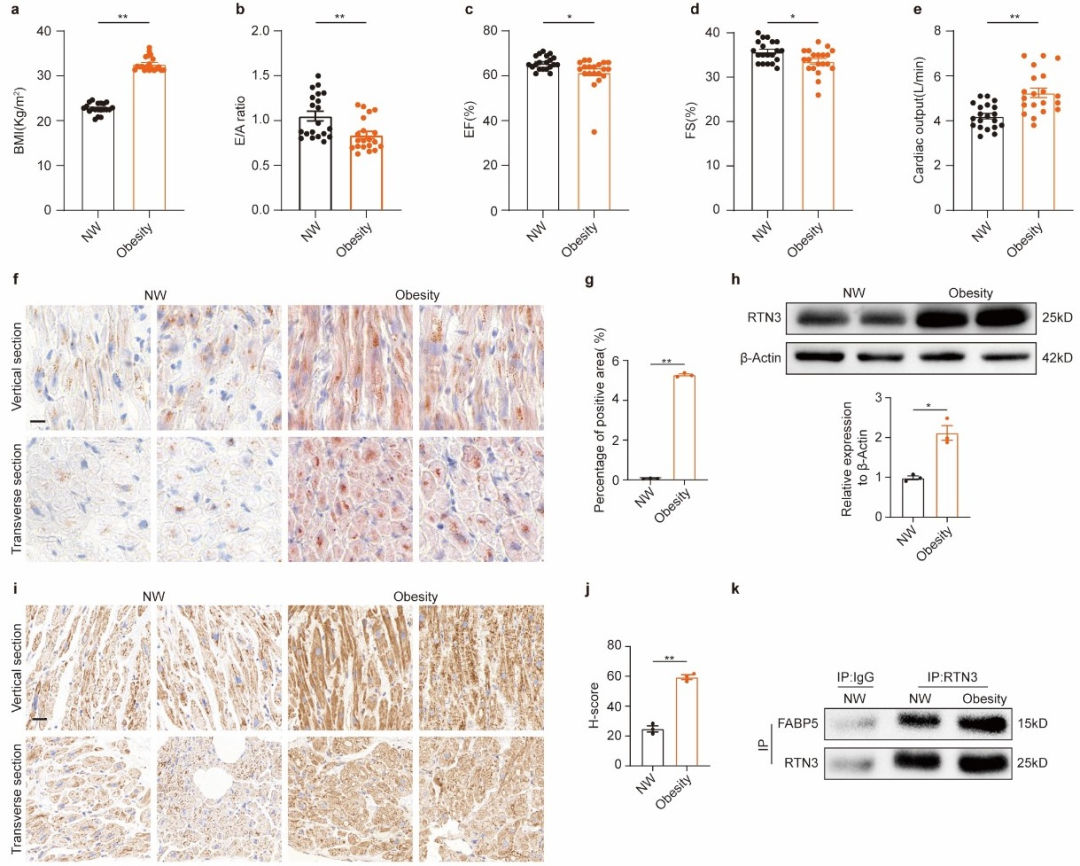
最后,作者收集了BMI>30kg/m2患者(肥胖患者)及18.5kg/m2<BMI≤24.9kg/m2人群(正常体重人群)的临床数据,进一步明确肥胖患者确实存在心脏收缩与舒张功能障碍,与既往文献报道相一致。作者还收集了上述两类人群的心房肌样本,发现肥胖患者心肌组织中存在显著脂质堆积,且RTN3表达量显著上调,与前述实验结论相一致。前述报道的RTN3与FABP5相互作用在人心肌组织中同样存在,进一步验证了本研究相关结论。
综上,本研究首次报道了心肌细胞中RTN3介导的脂滴生成的相关机制:RTN3通过与FABP5相结合,促进了FFA由胞浆至内质网的靶向转运,在DGAT2的作用下,完成了心肌细胞脂滴生成。肥胖患者心肌组织中,转录因子C/EBPα表达量显著上升,激活了RTN3的转录翻译,进而导致心肌细胞脂滴生成增加及心肌脂质堆积,最终引发心脏功能障碍。本研究通过多种研究手段阐明了RTN3在心肌细胞脂滴生成中的关键作用及机制,为干预肥胖相关心脏功能障碍提供了理论依据及潜在干预靶点,具有重要的临床转化意义及价值。
空军军医大学唐都医院李妍教授及胡朗讲师为共同通讯作者,博士研究生郭栋和张明明副教授为共同第一作者。该研究得到国家自然科学基金(No.82070385和No.82270366)、陕西省科技厅创新能力支撑计划科技创新团队以及唐都医院院课题(No.2019YXGJ003和No.2019GJHZ003)的资助。
本研究受邀在2023年欧洲心脏病学会年会上进行口头发言,并获第四届全国心血管研究生论坛一等奖、第24届中国南方国际心血管病学术会议优秀论文一等奖。
原文链接:
https://www.nature.com/articles/s41418-023-01241-x


