Autophagy:上海中医药大学贾立军团队发现抑制肝细胞癌细胞中自噬性细胞死亡的新机制
时间:2024-06-02 18:00:28 热度:37.1℃ 作者:网络
AQP3(aquaporin 3,水通道蛋白3,Gill血型抗原)是AQP家族的一员,是一种水甘油孔蛋白,能在细胞膜上运输水、甘油和小分子溶质。除了在液体运输中的作用外,AQP3在调节肿瘤细胞行为的多个方面也发挥着重要作用,包括细胞增殖、迁移和侵袭。然而,AQP3在肿瘤中的潜在调控机制仍不清楚。
2024年5月18日,上海中医药大学贾立军独立通讯在Autophagy 在线发表题为“SCFFBXW5-mediated degradation of AQP3 suppresses autophagic cell death through the PDPK1-AKT-MTOR axis in hepatocellular carcinoma cells”的研究论文。该研究首次报道了AQP3是SCFFBXW5复合物直接靶向的泛素化目标。该研究发现下调FBXW5显著诱导AQP3表达,从而促进肝细胞癌(HCC)细胞的自噬性细胞死亡。
机制上,FBXW5敲低导致的AQP3积累通过溶酶体依赖的方式降解PDPK1/PDK1,从而使AKT-MTOR通路失活,并在HCC细胞中引发自噬性细胞死亡。总之,该研究揭示了一种此前未发现的调控机制,即FBXW5通过降解AQP3来抑制自噬性细胞死亡,并通过PDPK1-AKT-MTOR轴在HCC细胞中发挥作用。

水通道蛋白(Aquaporins,AQPs)是一类广泛存在于各种生物系统组织中的跨膜水通道蛋白家族,不仅通过控制细胞水分运输来维持水稳态,还在促进多种分子如甘油和尿素的移动中发挥重要作用。AQPs自身在不同阶段也受到调控,如转录和降解。许多研究表明AQPs通过溶酶体系统降解。例如,SNX27(分拣连接蛋白27)调节肾集合管中AQP2蛋白的溶酶体降解。此外,VTA1(囊泡运输蛋白1)与AQP2相互作用并促进其在肾脏中的溶酶体降解。还有,压力诱导的激酶CSNK2(酪蛋白激酶2)磷酸化AQP4的Ser276,进而增强AQP4的溶酶体降解。然而,通过蛋白酶体系统降解AQPs蛋白的机制仍不清楚。
AQP3(水通道蛋白3)属于AQP家族,是一种水甘油孔蛋白,负责在细胞质膜上传输水、甘油和小分子溶质。除了在正常细胞中调节基本生物功能外,AQP3在肿瘤发生和进展中也发挥重要作用。AQP3在不同类型的癌症中可以表现为抑癌基因或癌基因。已有研究表明AQP3在多种肿瘤类型中具有癌基因的特性。例如,AQP3的上调加剧了胃癌细胞的增殖。在体内实验中,敲低AQP3能阻止乳腺原位异种移植瘤的肺转移。相反,在某些恶性肿瘤中,AQP3也被认为是抑癌基因。例如,CDH1/E-钙粘蛋白的上调和RALA的敲低导致前列腺癌细胞质膜上AQP3水平升高,显著抑制细胞增殖并增强细胞凋亡。5-氟尿嘧啶的应用诱导AQP3表达,从而在乳腺癌中引起细胞毒性和细胞周期停滞。此外,TCGA RNA-seq数据库分析显示,与邻近正常组织相比,AQP3在肝细胞癌(HCC)组织中表达水平较低。AQP3在肿瘤发生和癌症进展中的病理作用相当复杂,似乎与组织类型和细胞环境有关。因此,阐明AQP3的分子调控机制将有助于弄清HCC的发病机制,并可能为抗HCC策略提供基础。
SKP1-CUL1-F-box蛋白(SCF)E3泛素连接酶复合物是首个被发现的CUL-Ring E3泛素连接酶(CRL),由四个功能成分组成:SKP1(S期激酶相关蛋白1)、RBX1/ROC1(环盒1)、支架蛋白CUL1和底物受体F-box蛋白。根据其结构特点,F-box家族蛋白可分为三大亚家族:FBXW、FBXL和FBXO。FBXW蛋白靶向不同底物进行泛素化,在细胞增殖、细胞周期调控、细胞侵袭和免疫等众多重要生物功能中发挥作用。FBXW5(F-box和WD重复域蛋白5)是FBXW亚类F-box蛋白的成员,负责降解与一系列病理生理过程相关的蛋白质底物,包括炎症、有丝分裂进程和肿瘤发生。例如,CUL4AFBXW5介导的RHO GTP酶激活蛋白DLC1的降解促进了非小细胞肺癌细胞的增殖。此外,FBXW5通过调节人类骨肉瘤细胞中肌动蛋白重塑蛋白EPS8的降解,促进了有丝分裂的正常进程。然而,通过调节水通道蛋白影响癌症的FBXW5机制尚未揭示。
自噬是一种由饥饿或压力触发的细胞降解过程,主要承担四种角色:保护性、细胞毒性、细胞静止和非保护性。证据表明,自噬可能作为一种细胞死亡机制,并将这种自噬依赖的细胞死亡定义为“自噬性细胞死亡”。AKT-MTOR通路是细胞增殖和生存的关键信号轴,被证明是自噬的负面信号调节因子。然而,目前引发自噬性细胞死亡的AKT-MTOR通路的精确上游机制尚未彻底阐明。
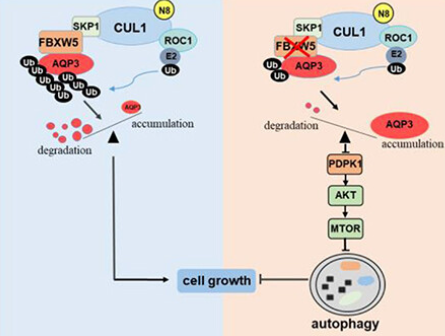
模式机理图(图片源自Autophagy )
在此,作者展示了SCFFBXW5 E3连接酶复合物特异性靶向AQP3进行泛素化并在HCC细胞中随后进行蛋白酶体依赖性降解。作者进一步阐明,FBXW5敲低诱导的AQP3积累抑制了PDPK1的表达,从而通过失活AKT-MTOR通路引发自噬。这项研究揭示了FBXW5通过泛素化和降解AQP3来调节PDPK1-AKT-MTOR通路,以抑制HCC细胞中自噬性细胞死亡的新机制。
原文链接:
https://doi.org/10.1080/15548627.2024.2353497


