好文推荐 | 神经血管耦联受损是2型糖尿病合并认知功能障碍的可能机制
时间:2023-12-10 12:37:19 热度:37.1℃ 作者:网络
摘要
目的 探讨2型糖尿病(type 2 diabetes mellitus,T2DM)患者神经血管耦联(neurovascular coupling,NVC)功能与认知损害的关系。方法 连续纳入2022年2月1日―2023年2月28日在海南医学院第二附属医院内分泌科住院的192例2型糖尿病患者和30例性别、年龄、受教育年限相匹配的健康对照(healthy control,HC),收集一般临床资料。所有受试者均进行蒙特利尔认知评估 (Montreal Cognitive Assessment,MoCA) 量表测试。应用功能经颅多普勒(fTCD)监测主动屈肘任务时脑血流速度曲线(cerebral blood flow velocity,CBFV)的动态变化来评估神经血管耦联功能。根据MoCA评分将T2DM患者分为T2DM认知正常(normal cognition,T2DM-NC)组和T2DM认知受损(impaired cognition,T2DM-IC)组。比较HC组、T2DM-NC组、T2DM-IC组3组间fTCD参数差异,分析fTCD参数与认MoCA评分的相关性。结果 共纳入T2DM患者81例,HC组21例。T2DM组患者中包括T2DM-NC组52例,T2DM-IC组29例。T2DM-IC组糖化血红蛋白高于T2DM-NC组及HC组,差异有统计学意义(均P<0.05)。T2DM组患者运动平均脑血流速度(mean velocity,Vm)较基线增加百分比(ΔVm)、归一化运动Vm曲线下面积(normalized area under the curve,nAUC)和Vm斜率均低于HC组(均P<0.05)。3组归一化处理后,T2DM-IC组的nAUC显著低于HC组和T2DM-NC组,HC组Vm上升斜率显著高于T2DM-NC组和T2DM-IC组,差异有统计学意义(均P<0.01)。相关性分析示:ΔVm(r=0.343,P=0.001)及nAUC(r=0.356,P=0.001)与MoCA评分均呈正相关。基线搏动指数(pulsatility index,PI)(r=-0.496,P<0.001)、基线阻力指数(resistance index,RI)(r=-0.475,P<0.001)、运动PI(r=-0.542,P<0.001)、运动RI(r=-0.523,P<0.001)与MoCA评分均呈负相关。结论 神经血管耦联功能受损是T2DM患者出现认知功能障碍的可能原因。
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种以胰岛素分泌不足或和胰岛素抵抗导致糖代谢紊乱的慢性代谢性疾病,在我国成年人中的患病率高达12.8%,70岁以上人群接近30%。近期越来越多证据表明T2DM是认知功能障碍及痴呆发生的独立危险因素。神经血管耦联(neurovascular coupling,NVC)是指神经元激活出现局部脑血流量同步增加的细胞机制。高血糖通过氧化应激导致内皮细胞受损及微血管功能障碍可导致神经血管耦联受损。研究表明神经血管耦联受损是T2DM出现认知功能障碍的原因之一,然而研究结果并不一致。
功能经颅多普勒超声(functional transcranial Doppler ultrasound,fTCD)通过监测运动任务中脑血流速度的动态变化可以用于评估神经血管耦联(neurovascular coupling,NVC)的功能。本研究拟应用fTCD监测中老年T2DM患者的主动屈肘任务中CBFV的动态变化来评估神经血管耦联功能,探讨T2DM)患者NVC功能与认知损害的关系。
1 资料与方法
1.1 研究对象
本研究连续纳入2022年2月1日―2023年2月28日在海南医学院第二附属医院内分泌科住院的T2DM患者共192例,同时招募30例性别、年龄相匹配的健康志愿者作为健康对照(health countrol,HC)组。根据入排标准,最终81例T2DM患者和21例健康志愿者纳入本研究。
纳入标准:年龄40~80岁;T2DM诊断符合中国2型糖尿病防治指南(2020版)诊断标准;小学以上受教育程度;能配合完成检查并签署知情同意书。本研究已获得海南医学院第二附属医院伦理委员会批准(2019R005-E02)。
排除标准:(1)合并有帕金森综合征、阿尔茨海默病等神经退行性疾病;(2)严重心、肺、肝、肾功能不全者;(3)严重代谢紊乱性状态,如糖尿病酮症酸中毒、高渗高血糖综合征等;(4)合并有甲亢、甲减等代谢性疾病;(5)中度贫血(Hb<90 g/L)及以上;(6)经超声或其他影像学检查发现颅内或颅外动脉狭窄的>50%;(7)颞骨声窗不良。
1.2 研究方法
1.2.1 临床资料的收集
收集一般临床资料:包括年龄、性别、受教育年限、糖尿病病程、吸烟史、饮酒史;既往疾病史:高血压病史;实验室结果:糖化血红蛋白(glycosylated hemoglobin,HbA1c)、总胆固醇(serum total cholesterol,TC)、甘油三酯(triglyceride,TG)、血肌酐、肾小球滤过滤(glomeruar filtration rate,GFR)。
1.2.2 神经心理学评估
利用蒙特利尔认知评估量表(Montreal Cognitive Assessment,MoCA)评估患者认知功能。评估方法如下:MoCA量表满分30分,以MoCA得分=13(未受教育)、MoCA得分=19(1~6年受教育年限)、MoCA得分=24(7年及以上受教育年限)为划界分值,MoCA评分结果大于对应教育水平划界分值为T2DM认知功能正常,小于或等于对应教育水平划界分值的为T2DM认知功能障碍。
1.2.3 fTCD试验方案及数据采集
本研究采用中国北京悦琦公司的超声经颅多普勒血流分析仪(TCD-2000s)。受试者取仰卧位,固定超声头架,使用2 MHz超声探头探及左侧大脑中动脉血流信号,深度在50~60 mm,获取到最佳信号后将探头固定在头架上。屈肘运动流程如下:受试者平卧休息10 mins,待血流平稳后记录90 s的基线脑血流,使用定制的频率为0.5 Hz(2 s)节拍录音,受试者根据录音执行两次屈肘任务,每次任务持续60 s(右肘部弯曲和肘部伸展,范围0°至90°,共30次),两次任务间隔5 min。试验开始前让受试者熟悉整个流程。期间记录大脑中动脉的平均血流速度(mean velocity,Vm),搏动指数(pulsatility index,PI),以及阻力指数(resistance index,RI)。所有受试者的量表测评及TCD操作分别由同一个相关专业人员完成以保证评估的均质性,且结果互不知情,以保证本研究的盲法。
1.2.4 NVC评估方案
fTCD的相关参数:ΔVm(%):运动Vm较基线Vm增加百分比;运动Vm曲线下面积(area under the curve,AUC);达峰时间(time to peak,TTP):指运动任务开始至血流速度上升到最大值所用时间;运动Vm的超调=(最大运动Vm-基线Vm)/基线Vm×100%;运动Vm斜率:指运动任务过程中Vm从开始上升到达到峰值段拟合曲线的斜率;由于本研究HC组和DM组两组受试者基线Vm存在明显差异,运动Vm相关参数不能直接比较,为使数据具有可比性,对Vm进行归一化处理(见图1)。
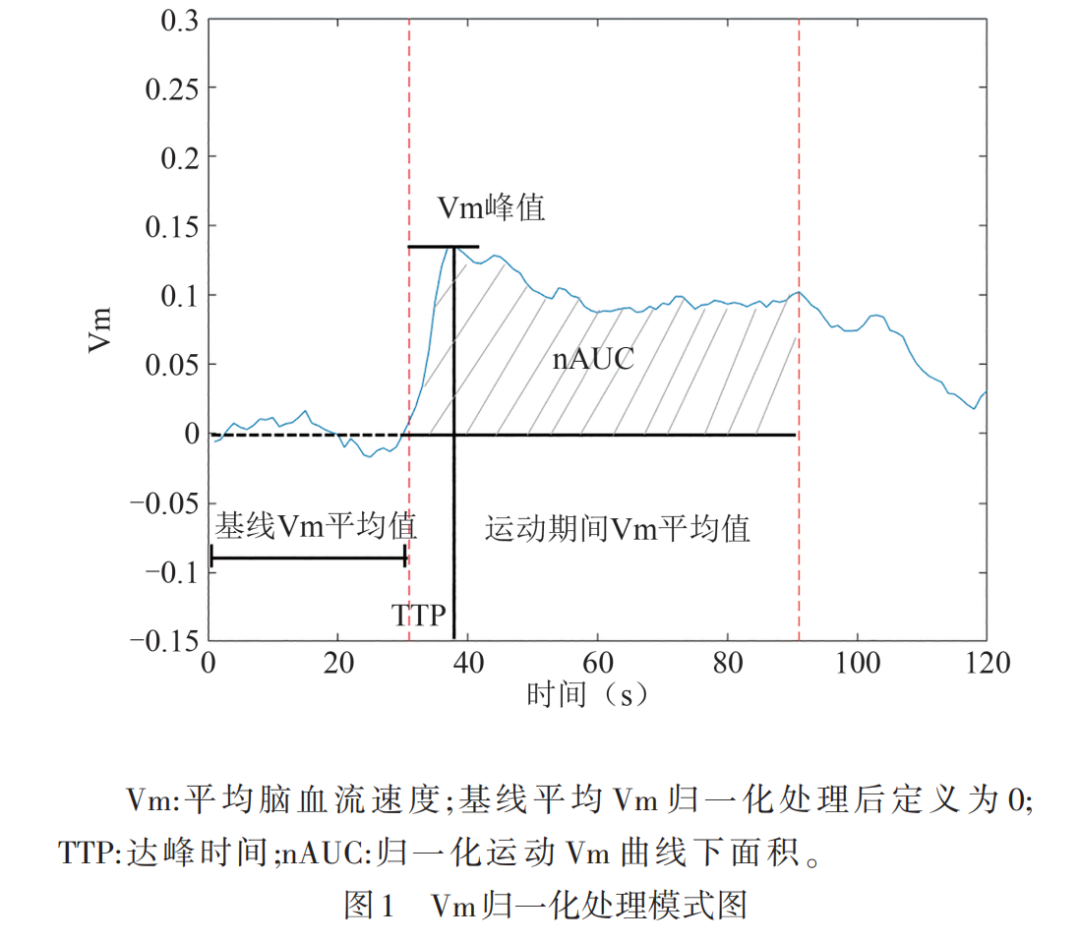
1.3 统计学处理
使用SPSS 26软件进行统计分析 正态分布数据以x±s表示,两组间比较采用t检验。偏态分布数据以中位数(四分位间距)[M(P25,P75)]表示,两组间比较采用Mann-Whitney U检验。计数资料用率及百分率表示,采用卡方检验或Fisher确切概率法进行分析。采用单因素方差分析或非参数Kruskal-Wallis H检验比较连续变量在HC组、T2DM认知正常(normal cognition,T2DM-NC)组和T2DM认知受损(impaired cognition,T2DM-IC)组3组间的分布,如果整体组有显著统计学差异,进一步两两比较则采用Bonferroni法校正P值。相关性分析采用Pearson相关分析或Spearman相关分析,P<0.05差异有统计学意义。
2 结果
2.1 一般临床资料比较
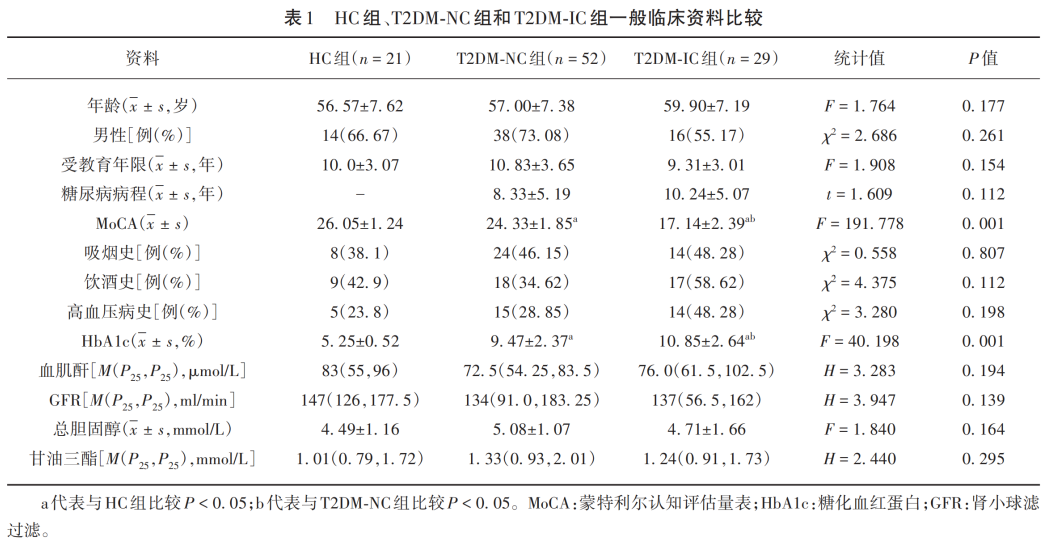
本研究共纳入102例受试者,其中T2DM患者81例,HC组受试者21例。依据MoCA评分,T2DM患者进一步分为T2DM-NC组52例,T2DM-IC组29例。3组间年龄、性别、受教育年限、吸烟史、饮酒史、高血压病史、血肌酐、GFR、总胆固醇、甘油三酯方面差异无统计学意义(均P>0.05)。T2DM-IC组HbA1c水平高于T2DM-NC组(10.85% vs 9.47%,P=0.001)差异有统计学意义。两组T2DM患者中糖尿病病程组间差异无统计学意义(均P>0.05)。详见表1。
2.2 HC组和T2DM组fTCD参数的组间比较
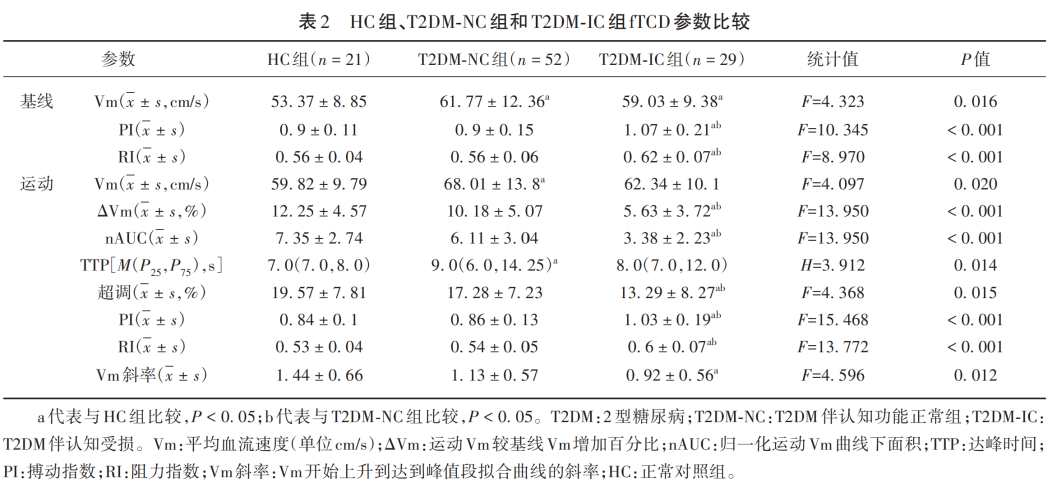
T2DM组基线Vm、运动Vm、运动PI、运动RI明显高于HC组[(60.79 ± 11.46)vs(53.37 ± 8.85);(65.98 ± 12.89)vs(59.82 ± 9.79);(0.92 ± 0.17)vs(0.84 ± 0.10);(0.56 ± 0.07)vs(0.53 ± 0.04)],差异有统计学意义(均P<0.05)。此外,T2DM组的ΔVm(%)、归一化的运动Vm曲线下面积(normalized area under the curve,nAUC)、Vm斜率均低于HC组[(8.55 ± 5.12)vs(12.25 ± 4.57);(5.13 ± 3.07)vs(7.35 ± 2.74);(1.05 ± 0.58)vs(1.44 ± 0.66)],差异有统计学意义(均P<0.05)。两组间基线PI、基线RI、TTP(达峰时间)、运动Vm的超调百分比差异无统计学意义(均P>0.05)(见表2)。
2.3 HC组、NC组和IC组3组间fTCD参数比较
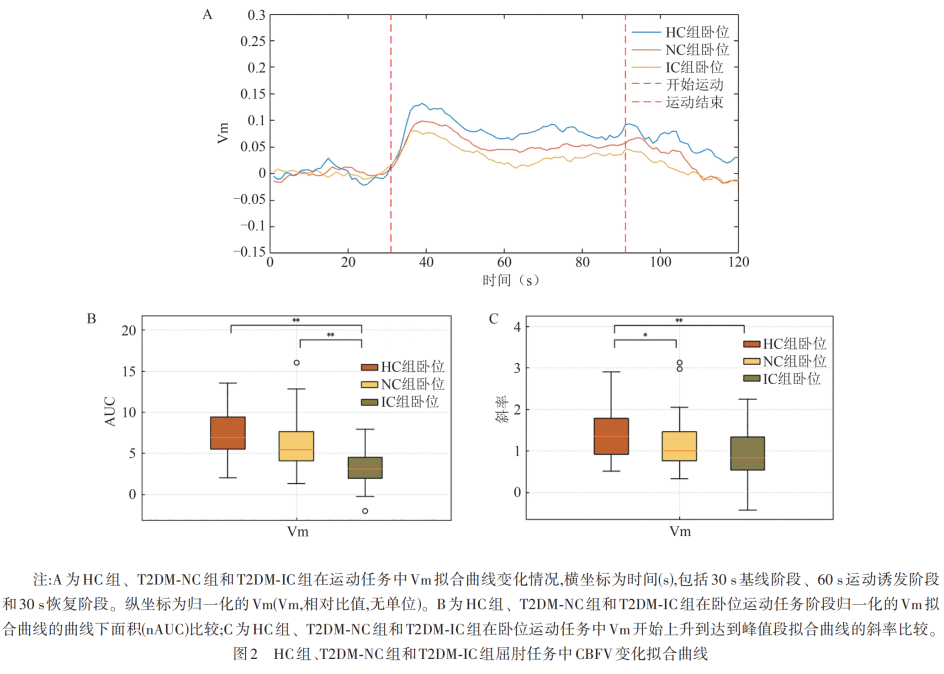
T2DM-NC组卧位基线Vm、运动Vm、TTP以及T2DM-IC组的基线Vm均高于HC组,差异均有统计学意义(P<0.05)。T2DM-IC组卧位基线PI、基线RI、运动PI、运动RI均显著高于HC组和T2DM-NC组,而ΔVm(%)、nAUC、运动Vm的超调百分比、Vm斜率显著低于HC组和T2DM-NC组,差异有统计学意义(均P< 0.05)。归一化处理后的Vm拟合曲线:T2DM-IC组的nAUC显著低于HC组和T2DM-NC组,HC组Vm上升斜率显著高于T2DM-NC组和T2DM-IC组,差异有统计学意义(均P<0.01)(见图2)。
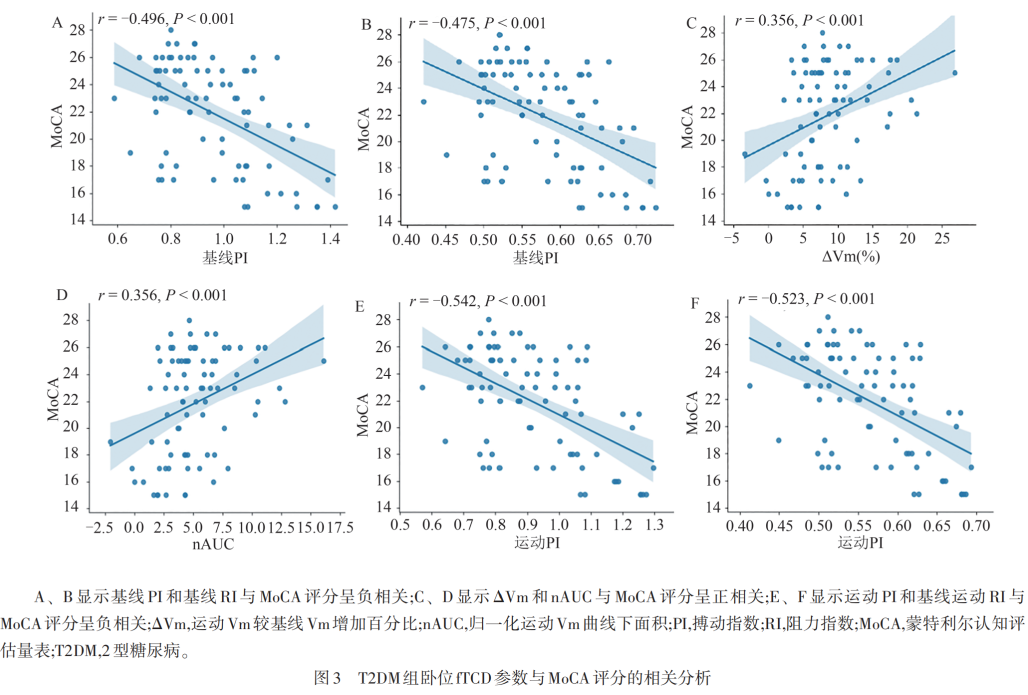
2.4 fTCD参数与MoCA评分的相关性分析
T2DM与HC组存在组间差异的fTCD参数与MoCA评分进行相关性分析:ΔVm(r=0.343,P=0.001)及nAUC(r=0.356,P=0.001)与MoCA评分均呈正相关。基线PI(r=-0.496,P<0.001)、基线RI(r=-0.475,P<0.001)、运动PI(r=-0.542,P<0.001)、运动RI(r=-0.523,P<0.001)与MoCA评分均呈负相关(见图3)。
3 讨论
既往研究显示2型糖尿病与认知功能障碍有关,血糖控制不佳,病程长及高龄是T2DM发生认知功能障碍的危险因素。本研究中合并认知功能减退的T2DM患者糖化血红蛋白水平更高,提示长期血糖控制欠佳与认知损害正相关。本研究未发现年龄及病程有统计学差异,考虑与样本量较小及认知功能障碍评估标准差异有关。
神经血管耦联(NVC)是一种基于神经血管单元的,反映了神经元激活引起局部脑血流变化的机制。T2DM可通过多种途径影响神经血管耦联,如影响脑血管舒张功能导致神经元激活与脑血管调节失匹配。ΔVm、nAUC反映运动任务中NVC对神经刺激的激活程度,参数值越大,提示NVC的反应性越强。本研究中,与正常受试者相比T2DM患者ΔVm、nAUC下降,显示T2DM患者神经血管耦联功能受损。T2DM亚组分析发现与健康对照组相比,在T2DM患者中即使认知功能正常,同样出现TTP延长及Vm上升斜率更低,提示T2DM患者NVC功能改变先于认知功能障碍的出现,与Yu等人的研究结果类似。
PI值和RI值反映颅内血管远端阻力的大小,体现了脑小血管的舒张功能。长期的高血糖及氧化应激容易引起血管内皮细胞受损,造成PI值增加。Park等人研究发现T2DM患者大脑中动脉的PI值显著高于HC组。Chung等人的在一项为期6年的纵向研究中发现大脑动脉PI值增加与认知功能障碍相关,并且可以独立预测AD的发生。本研究发现,在屈肘运动任务时T2DM组PI值升高更明显,相关性分析示PI值与MoCA评分呈负相关,反应了神经激活时血管舒张功能障碍。
神经血管耦联功能受损可能是T2DM患者认知功能障碍的原因之一,但T2DM、认知障碍与NVC三者之间的确切关系尚未明确,且研究结果存在差异。本研究发现IC组患者ΔVm、nAUC以及Vm超调百分比显著低于HC组和T2DM-NC组,表明T2DM-IC组患者较T2DM-NC组NVC功能受损更严重,与Rhenan等的研究结果一致。相关性分析发现T2DM组ΔVm、nAUC与MoCA评分均呈正相关,提示神经耦联功能与认知功能相关。以上结果提示神经血管耦联受损是T2DM患者认知功能障碍的可能原因,远端小血管舒张功能受损是NVC功能障碍的病理机制之一。
研究的不足包括,本研究为单中心横断面病例对照研究,纳入T2DM患者及HC组人数较少,且没有随访患者的认知功能和NVC变化,对NVC临床意义的判断有局限性。
综上所述,在2型糖尿病患者中NVC受损是认知功能障碍的可能机制,并可先于认知功能障碍的发生。因此,根据fTCD评估T2DM患者事件相关脑血流改变有助于这类患者认知功能障碍的早期识别从而进行及时干预值得进一步大样本临床队列研究。
参考文献
[1]Li Y,Teng D,Shi X,et al. Prevalence of diabetes recorded in Mainland China using 2018 diagnostic criteria from the American Diabetes Association:national cross pal study[J]. BMJ,2020,369:997.
[2]Harris MI,Klein R,Welborn TA,et al. Onset of NIDDM occurs at least 4-7 yr before clinical diagnosis[J]. Diabetes Care,1992,15(7):815-819.
[3]Xue M,Xu W,Ou YN,et al. Diabetes mellitus and risks of cognitive impairment and dementia:a systematic review and meta-analysis of 144 prospective studies[J]. Ageing Res Rev,2019,55:100944.
[4]Schaeffer S,Iadecola C. Revisiting the neurovascular unit[J]. Nat Neurosci,2021,24(9):1198-1209.
[5]Barloese MCJ,Bauer C,Petersen ET,et al. Neurovascular coupling in type 2 diabetes with cognitive decline. A narrative review of neuroimaging findings and their pathophysiological implications[J]. Front Endocrinol,2022,13:874007.
[6]中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 中华内分泌代谢杂志,2021,37(4):311-398.
[7]Lu J,Li D,Li F,et al. Montreal cognitive assessment in detecting cognitive impairment in Chinese elderly individuals:a population-based study[J]. J Geriatr Psychiatry Neurol,2011,24(4):184-190.
[8]Barnes Sam C,Panerai Ronney B,Beishon Lucy,et al. Cerebrovascular responses to somatomotor stimulation in Parkinson's disease:A multivariate analysis.[J].J Cereb Blood Flow Metab,2022,42:1547-1558.
[9]Salinet ASM,Robinson TG,Panerai RB. Reproducibility of cerebral and peripheral haemodynamic responses to active,passive and motor imagery paradigms in older healthy volunteers:a fTCD study[J]. J Neurosci Meth,2012,206(2):143-150.
[10]Salinet AS,Silva NC,Caldas J,et al. Impaired cerebral autoregulation and neurovascular coupling in middle cerebral artery stroke:influence of severity[J]. J Cereb Blood Flow Metab,2019,39(11):2277-2285.
[11]Deppe M,Knecht S,Henningsen H,et al. AVERAGE:a Windows program for automated analysis of event related cerebral blood flow[J]. J Neurosci Methods,1997,75(2):147-154.
[12]Yuan XY,Wang XG. Mild cognitive impairment in type 2 diabetes mellitus and related risk factors:a review[J]. Rev Neurosci,2017,28(7):715-723.
[13]Sun L,Diao X,Gang X,et al. Risk factors for cognitive impairment in patients with type 2 diabetes[J]. J Diabetes Res,2020,2020:4591938.
[14]Canna A,Esposito F,Tedeschi G,et al. Neurovascular coupling in patients with type 2 diabetes mellitus[J]. Front Aging Neurosci,2022,14:976340.
[15]Iadecola C. The neurovascular unit coming of age:a journey through neurovascular coupling in health and disease[J]. Neuron,2017,96(1):17-42.
[16]Smirl JD,Wright AD,Bryk K,et al. Where’s Waldo?The utility of a complicated visual search paradigm for transcranial Doppler-based assessments of neurovascular coupling[J]. J Neurosci Methods,2016,270:92-101.
[17]Yu Y,Yan LF,Sun Q,et al. Neurovascular decoupling in type 2 diabetes mellitus without mild cognitive impairment:potential biomarker for early cognitive impairment[J]. NeuroImage,2019,200:644-658.
[18]White H,Venkatesh B. Applications of transcranial Doppler in the ICU:a review[J]. Intensive Care Med,2006,32(7):981-994.
[19]Park JS,Cho MH,Lee KY,et al. Cerebral arterial pulsatility and insulin resistance in type 2 diabetic patients[J]. Diabetes Res Clin Pract,2008,79(2):237-242.
[20]Chung CP,Lee HY,Lin PC,et al. Cerebral artery pulsatility is associated with cognitive impairment and predicts dementia in individuals with subjective memory decline or mild cognitive impairment[J]. J Alzheimers Dis,2017,60(2):625-632.
[21]Zhang Y,Zhang X,Ma G,et al. Neurovascular coupling alterations in type 2 diabetes:a 5-year longitudinal MRI study[J]. BMJ Open Diabetes Res Care,2021,9(1):e001433.
[22]Nealon RS,Howe PRC,Jansen L,et al. Impaired cerebrovascular responsiveness and cognitive performance in adults with type 2 diabetes[J]. J Diabetes Complications,2017,31(2):462-467。
引证本文
张进伟,唐玮婷,刘佳欣,等.神经血管耦联受损是2型糖尿病合并认知功能障碍的可能机制[J].中风与神经疾病杂志,2023,40(10):871-876.



