厦门大学田华雨AFM:磁性聚合物微载体,可在大规模细胞培养中无酶收获和快速回收!
时间:2023-12-11 15:43:37 热度:37.1℃ 作者:网络
刺激响应型大规模细胞培养微载体是一种很有前途的大规模细胞生产生物材料。因此,厦门大学田华雨团队制备了由聚N-异丙基丙烯酰胺(PNIPAM)、聚赖氨酸(PLL)、明胶甲基丙烯酰基(GelMA)、聚乙二醇二丙烯酸酯(PEGDA)、N,N-亚甲基双丙烯酰胺(MBA)、Fe3O4和SiO2等组成的多功能热磁微载体(TMMs),不仅可以实现大规模的无酶细胞收获,还可以作为细胞立体生长支架模拟细胞悬浮状态,开发重组蛋白等新的应用。在TMMs中,NIPAM与其他材料混合,然后以2-羟基-2-甲基苯丙酮为引发剂,在紫外光照射下进行原位自由基聚合,其中GelMA提供细胞黏附场所,PLL提供以SiO2为填充物的正微环境。作为无酶的细胞微载体,PNIPAM可在25℃下通过涡流振荡在15min内实现对TMMs的细胞采集,并可通过磁回收至少回收TMMs四次。此外,TMMs还可以作为立体培养支架,使悬浮的细胞处于贴壁状态,从而提高基因的转染率。结合磁热效应,TMMs可以进一步促进基因转移,实现蛋白质表达的产业化。因此,TMMs具有发展细胞制造和扩大细胞立体生长应用于重组蛋白生产的潜力。该研究以题为“Magnetic Polymer Microcarriers for Cell Engineering Applications with Enzyme-Free Cell Harvesting and Rapid Recovery in Large-Scale Cell Culture”的论文发表在《Advanced Functional Materials》上。

本工作通过原位自由基聚合和微流控技术制备了结构稳定的多功能热磁微载体(图1),其优点如下:1)表面电位可控,为各种细胞类型的大规模立体培养提供了多个细胞黏附位点;2)通过温度控制,热磁微载体实现了无酶细胞分离,并可在细胞收获后通过磁场进行循环利用;3) TMMs可作为细胞立体培养支架,促进基因高效转染,未来生产重组蛋白;4) Fe3O4在TMMs中产生的磁热效应将进一步提高基因转染效率,促进蛋白质的表达。这些特点表明,基于TMMs的细胞培养技术可以为组织和细胞工程提供细胞制造,并为重组蛋白生产的发展提供新的动力。
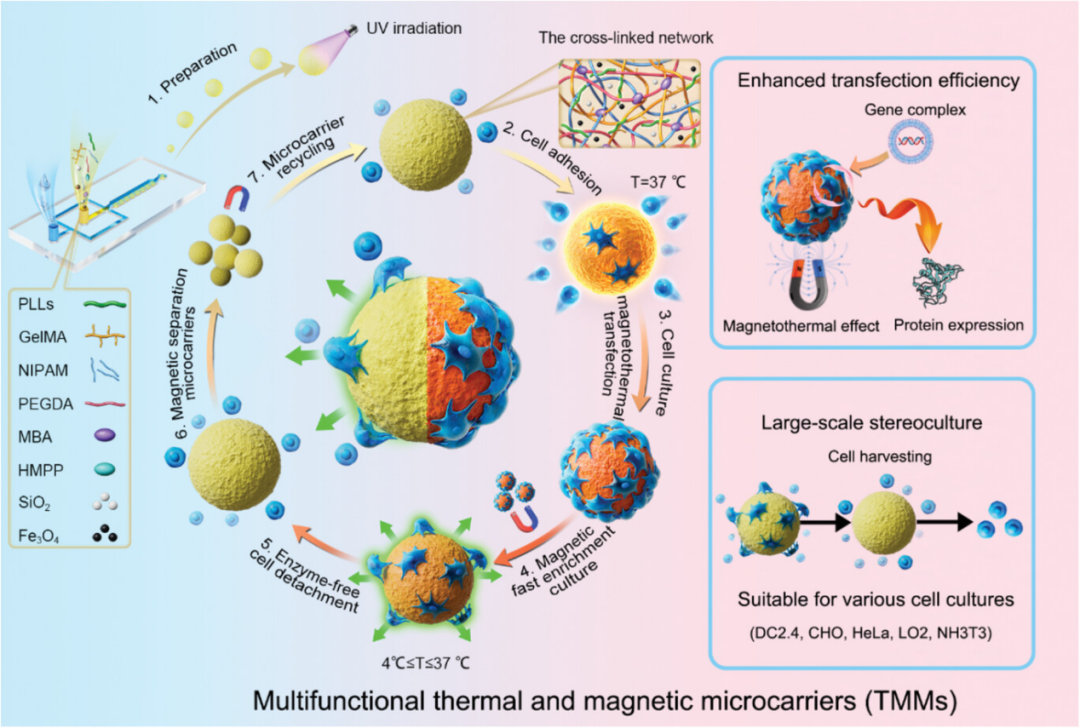
图1. 多功能TMMs及其应用示意图
【合成与表征】
FT-IR分析表明,已成功制备出具有明确元素含量和互穿网络的化学和物理掺杂TMMs。XPS光谱表明TMMs具有聚合物网络结构。TMMs的饱和磁化强度值约为0.36 emug−1,而不含 Fe3O4的TMMs没有磁响应。当TMMs分散在水中并受到磁场作用时,它们在5秒内分离,表明TMMs可以通过磁力分离来回收。与TMMs成分相同的散装材料的机械性能最初通过流变实验进行了研究。与不含SiO2的块状材料相比,块状材料表现出更高的抗应变性和更长的应力/应变线性区。在应变幅度低于1%时,两个块体样品的储能模量均大于相应的损耗模量,表明与TMMs具有相同网络组成的宏观材料主要是弹性变形且处于固态。填充SiO2 的TMMs的杨氏模量(20 GPa)略高于不含SiO2的TMMs(19.5 GPa),表明SiO2填料可以适当提高TMMs的刚度。
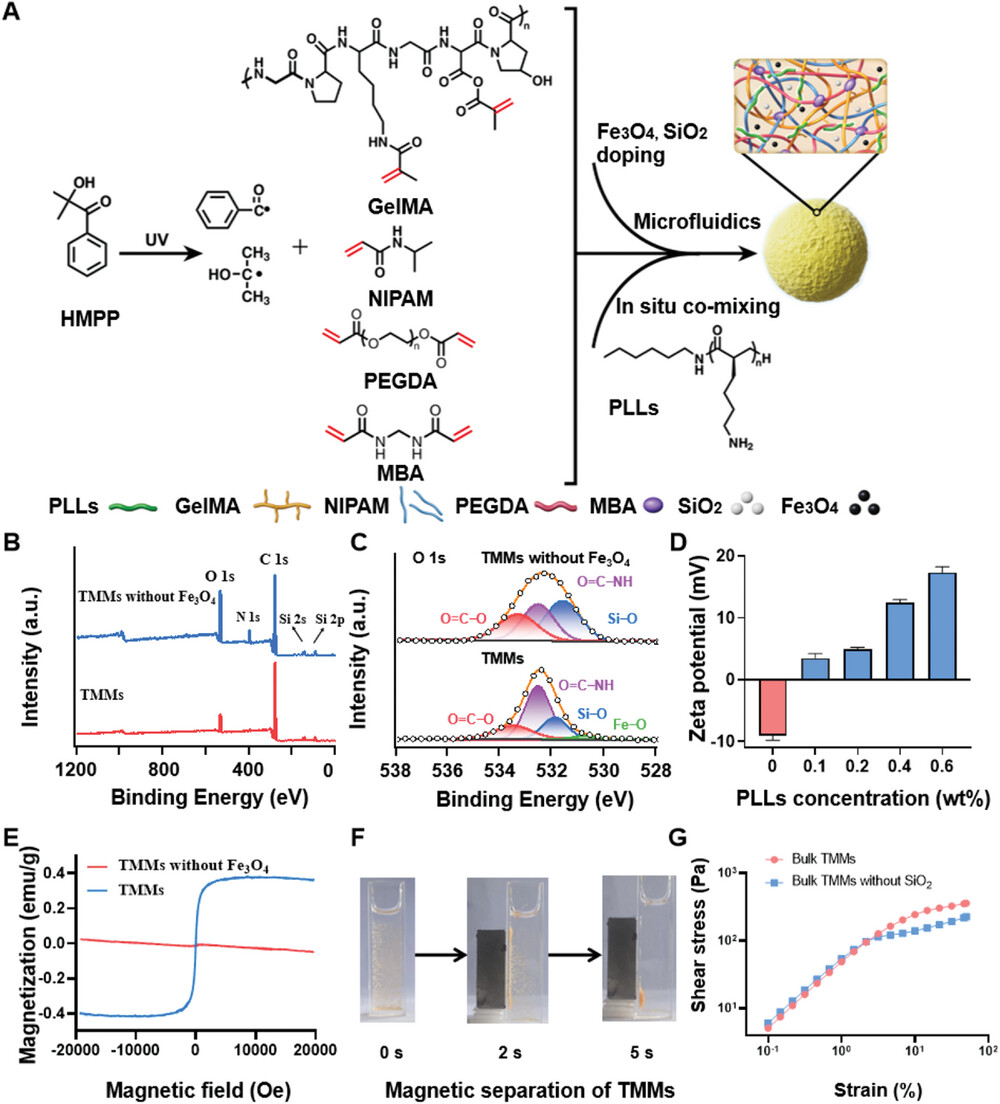
图2. 微流控TMMs的合成路线与表征
TMMs是使用流动聚焦微流体系统制备的。观察到所制备的预聚微球的尺寸均匀,约为220μm。图3A显示了通过改变光引发剂2-羟基-2-甲基苯丙酮(HMPP)的浓度和UV照射时间来交联的TMMs的形成。当HMPP含量高于0.86%且照射时间大于3 s时,TMMs就有可能形成。进一步研究了温度敏感的PNIPAM的量分别在25°C和37°C 下对TMMs尺寸的影响。结果表明,TMMs中PNIPAM含量较低时,温度变化对粒径影响很小。相反,当PNIPAM 含量超过5.0 wt.%时,TMMs 的尺寸随温度变化显着变化。此外,TMMs的尺寸可以通过流量聚焦微流体系统调节油相和水相之间的流量比来控制。当水相速度低于20 μL min−1时,TMMs可以形成,但当水相速度达到70 μL min−1时,TMMs不能在有限的微管中形成,即使当油相速度达到190 μL min−1。此外,TMMs还具有优异的稳定性。
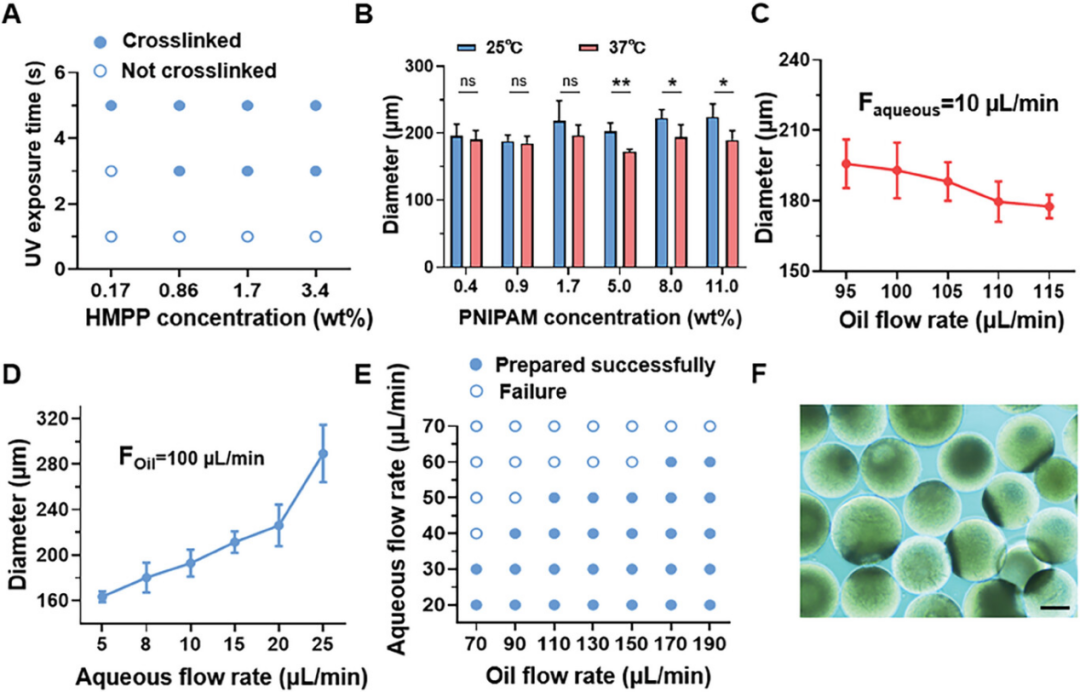
图3. TMMs在不同HMPP含量和紫外线照射时间下的交联
【PLL对TMMs的表面环境具有微调控作用】
另一方面,PLLs对TMMs的表面环境具有微观调节作用。为了验证PLLs对TMMs的作用,将TMMs中的PLLs替换为阳离子聚合物壳聚糖(CTS)、阴离子聚合物包括透明质酸(HA)和电中性聚合物右旋糖酐(Dex),并选择DC2.4细胞作为免疫治疗细胞。选择CHO细胞作为重组蛋白生产细胞来评估细胞扩增。结果表明,具有PLLs的TMMs在这些组中产生的培养细胞数量最多,含有PLLs的TMMs最适合细胞扩增。且TMMs无明显细胞毒性,适合细胞生长。
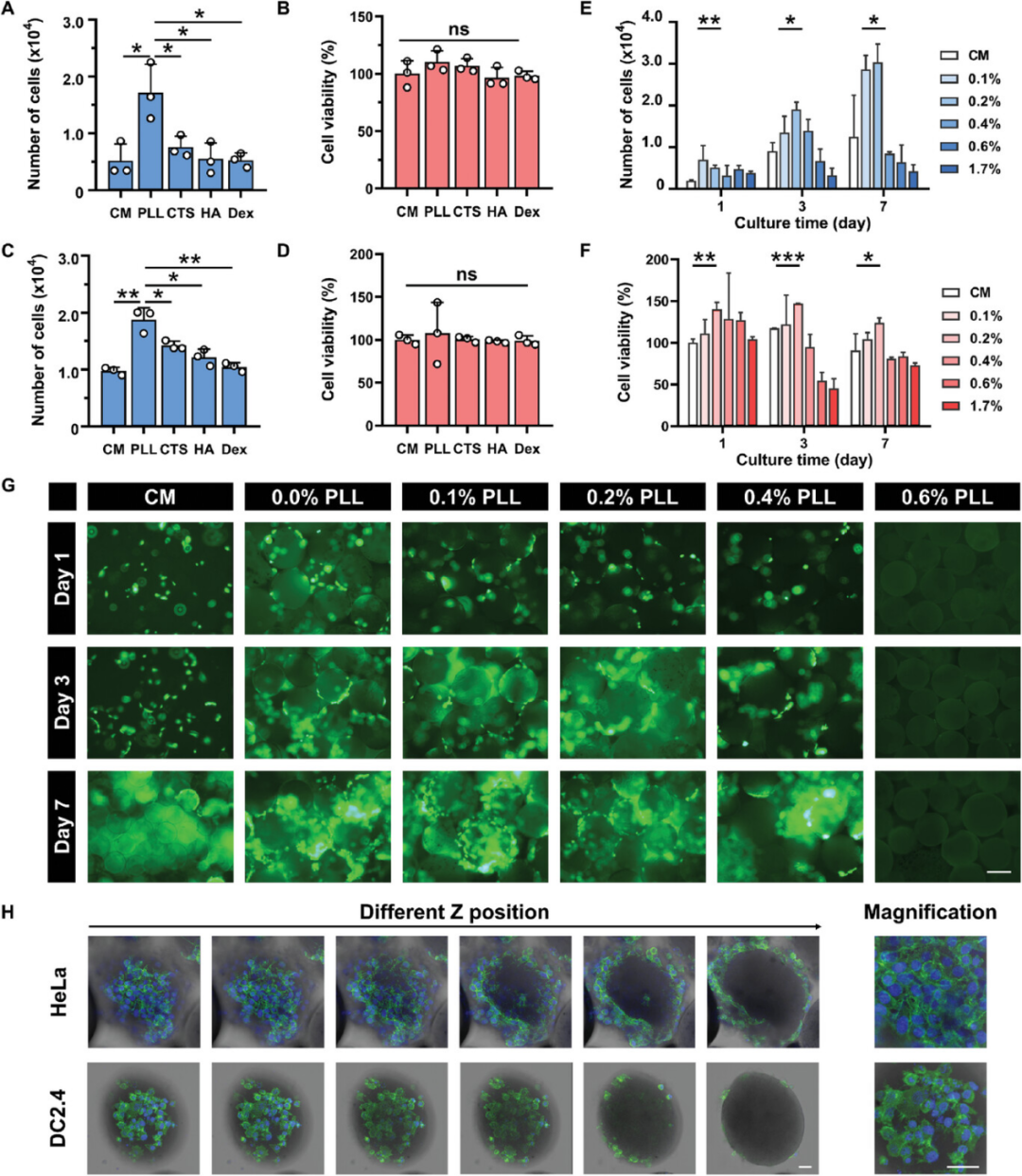
图4.PLLs对TMMs的表面环境具有微调控作用
【TMMs的细胞活性】
对于微载体来说,细胞脱离效率是评价其实际应用的重要参数。因此,使用HeLa-GFP细胞来研究TMMs的细胞培养和分离能力,并以CM作为对照。作为一种温度敏感材料,TMMs中PNIPAM的含量对收获细胞的数量和分离效率有显着影响。研究了25°C下不同 PNIPAM 含量对细胞数量、活性和附着效率的影响。结果表明,当TMMs作为微载体进行细胞培养时,收获的细胞表现出良好的CM活力,具有大规模和更高的分离效率。与CMs相比,在微载体用量相同的情况下,TMMs表现出良好的细胞培养效果,且没有明显的细胞毒性,且TMMs在广泛的细胞粘附和培养中表现出广泛的适用性。
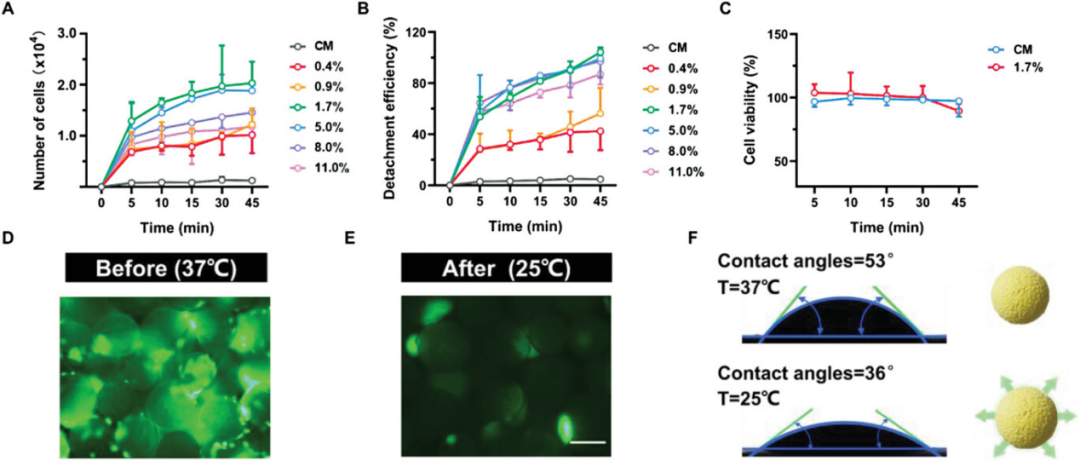
图5. 具有不同PNIPAM含量的TMMs对培养细胞数量的影响
【TMMs的稳定性】
为了研究TMMs在高压高温高压灭菌过程中的稳定性,每次灭菌后使用TMMs培养细胞,通过测量细胞数量和活力来评估稳定性。结果表明,TMMs稳定,可以在至少四次高压灭菌后存活,一次灭菌收获的细胞数为1.36×104,两次灭菌收获的细胞数为1.28×104,三次灭菌收获的细胞数为1.38×104,四次灭菌收获的细胞数为1.26×104。确定TMMs灭菌后的稳定性后,研究了TMMs的回收率和TMMs上细胞的再培养。TMMs和CM在重复细胞培养后均保持优异的细胞活力,证实了它们的安全性和稳定性。TMMs表现出比自然沉降分离的CM更高的磁循环效率,并且TMMs可以连续培养大规模细胞,优于CM。上述结果表明,TMMs是一种潜在的商业化微载体,用于大规模细胞培养,具有高效性和可回收性。
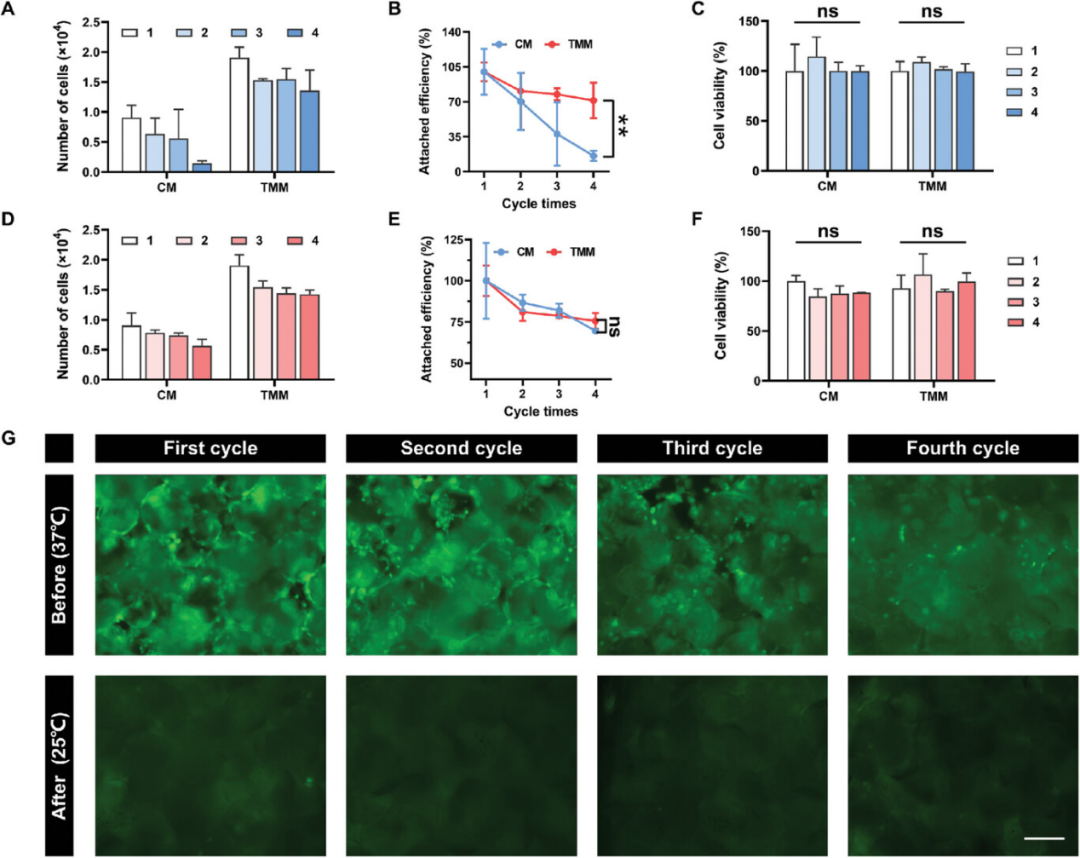
图6. TMMs在高压灭菌器中高压灭菌过程中的稳定性
【TMMs大规模培养和收获细胞的能力】
细胞的大规模立体培养有助于微载体的工业应用。因此,进一步探讨了TMMs大规模培养和收获细胞的能力,使用CM作为对照。结果表明,TMMs上培养的细胞数量较多,细胞状态良好,适合细胞工程的大规模细胞立体培养。另一方面,TMMs不仅可以作为细胞微载体,还可以进一步扩展其应用,例如通过基因转染生产重组蛋白,因为大量的细胞数量和最佳的细胞状态可以改善细胞的表达能力。TMMs不仅可以实现优异的大规模细胞扩增,而且有利于实现重组蛋白生产的增强基因转染。
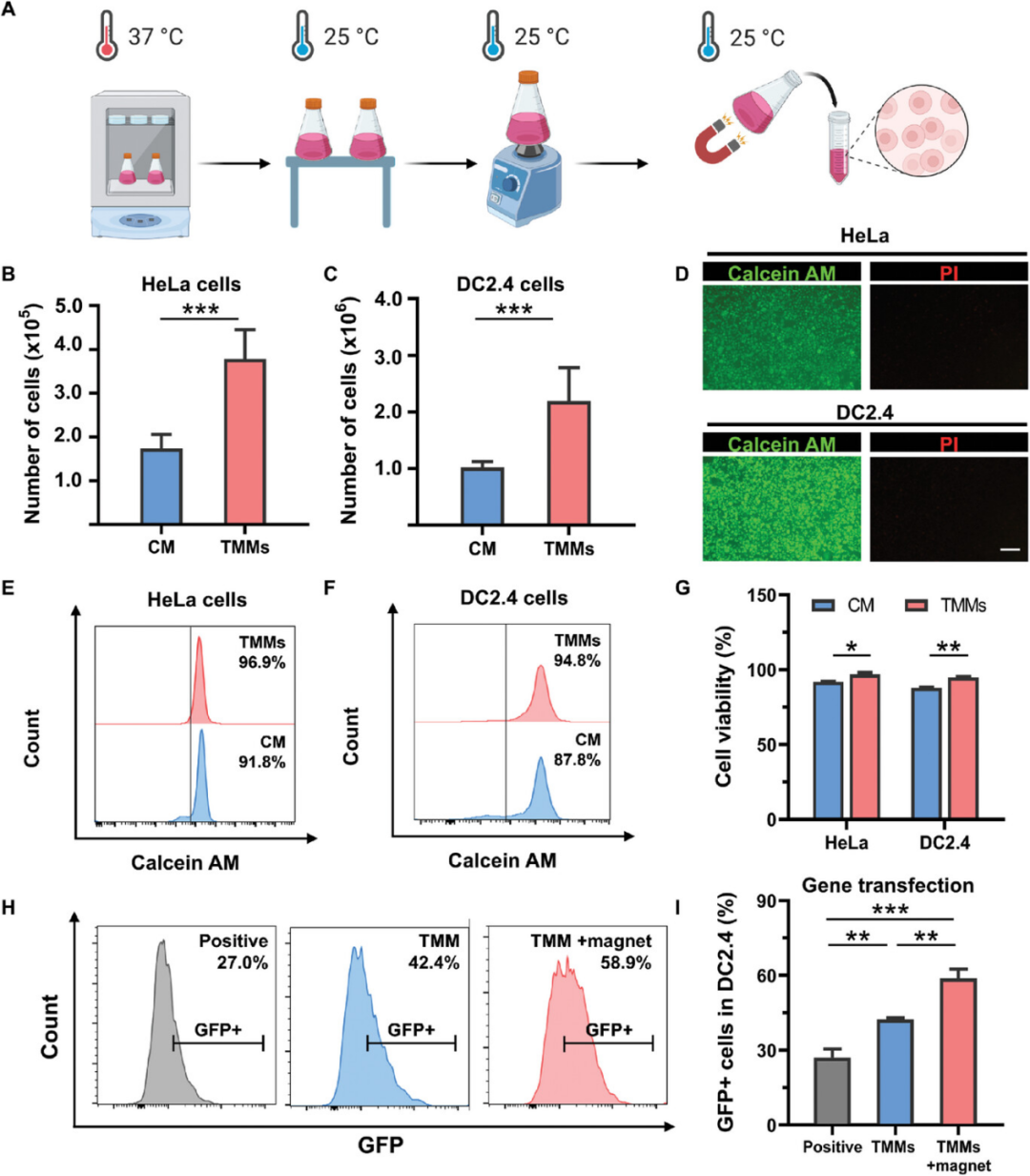
图7. TMMs大规模培养和收获细胞的能力
【小结】
该研究利用NIPAM、PLLs、GelMA、PEGDA、MBA、Fe3O4和SiO2在紫外照射下原位自由基聚合成功制备了刺激响应型多功能热磁 TMMs,作为具有智能细胞立体培养的大规模无酶细胞收获微载体。在这项工作中通过微流体技术。当PLLs含量为0.2 wt.%时,TMMs上收获的细胞数量最多,细胞毒性最低。TMMs还可用于无酶细胞收获,在PNIPAM的1.7 wt.%时具有最佳细胞分离效果。与CM相比,TMMs在DC2.4、HeLa、CHO、NIH3T3和LO2上表现出更好的细胞培养效果,可循环使用四次,稳定性高。作为允许细胞悬浮附着的立体培养支架,TMMs上收获的HeLa和DC2.4细胞数量分别是初始的2.5倍和4.4倍,分别是CM的2.1倍和2.2倍。此外,根据绿色荧光蛋白表达评估,DC2.4对TMMs的基因转染效率达到42.4%,磁热效应进一步将转染效率提高至58.9%,表明TMMs不仅能够实现优异的大规模细胞扩增,而且基因转染效率,尤其是在存在磁热效应的情况下。因此,这种多功能微载体有望为细胞产业化的发展和重组蛋白生产的细胞工程应用的扩展做出贡献。
原文链接:
https://doi.org/10.1002/adfm.202311454


