Nature:在神经退行性疾病中发现一种新的淀粉样蛋白形成蛋白
时间:2023-12-13 10:38:48 热度:37.1℃ 作者:网络
含有异常组装的TDP-43或tau的神经元夹杂物分别表征了大约50%和40%的FTLD病例。这些组件具有淀粉样结构。淀粉样蛋白是沿着长丝轴由分子间β片稳定下来的丝状蛋白质组件。虽然蛋白质在大多数疾病病例中是野生型,但编码TDP-43和tau的基因中引起淀粉样组装和FTLD的罕见突变显示出因果联系。此外,TDP-43和tau的不同淀粉样丝褶皱定义了FTLD的不同亚型,这些亚型与FTD的各种行为和语言变体以及运动障碍有关。
相比之下,其余约10%的FTLD病例的神经元内含物中淀粉样丝的存在、身份和结构尚不清楚。这些内含物最初被发现对FUS具有免疫反应,因此这些病例通常被称为FTLD-FUS。寻找FUS的动机是发现在没有FTLD的情况下,FUS的罕见突变会导致运动障碍肌萎缩侧索硬化症(ALS)。此外,FUS LCD的重组碎片可以在体外组装成淀粉样丝。然而,到目前为止,尚未发现与FTLD相关的FUS突变,患者大脑中FUS的淀粉样蛋白丝尚未被发现。
随后表明,FTLD-FUS的夹杂物对TAF15和转运蛋白1(也称为进口蛋白β-2和胡萝卜素β-2)也有免疫反应。对于这些研究中的一些病例,一部分夹杂物对尤因肉瘤(EWS)也有免疫反应。FUS、EWS和TAF15是同源RNA结合蛋白,统称为FET蛋白。由于FET蛋白的免疫反应性,FTLD-FUS也被称为FTLD-FET,因此,从现在开始使用一个更全面的术语。证据表明,与FUS一样,TAF15和EWS的LCD也可以在体外组装成灯丝。
在健康细胞中,FET蛋白主要位于细胞核中,并进行核细胞质穿梭。FET蛋白在RNA的转录以及剪接、处理和运输中发挥作用。它们的N端LCD富含甘氨酸、酪氨酸、谷氨酰胺和丝氨酸残基。它们还包含一个中间区域RNA识别基序,两侧是富含精氨酸-甘氨酸(RGG)基序的片段、锌指结构域和C端核定位信号(NLS)。Transportin 1与FET蛋白的NLS结合,以调解其核进口。

为了了解分子水平的神经退化,并为诊断和治疗策略提供基础,对病理蛋白质组装的结构理解至关重要。在这里,2023年12月12日发表在Nature的文章,调查了FTLD-FET患者大脑中淀粉样丝的存在、身份和结构。
本文使用低温电子显微镜(cryo-EM)来确定从四个FTLD-FUS个体的前额叶和颞叶皮层中提取的淀粉样丝的结构。研究结果显示,研究人员发现了FUS同系物TATA结合蛋白相关因子15(TAF15,也称为TATA结合蛋白相关因子2N)的大量淀粉样丝,而不是FUS本身。细丝褶皱由TAF15低复杂度域(LCD)中的残留物7-99形成,个体之间相同。
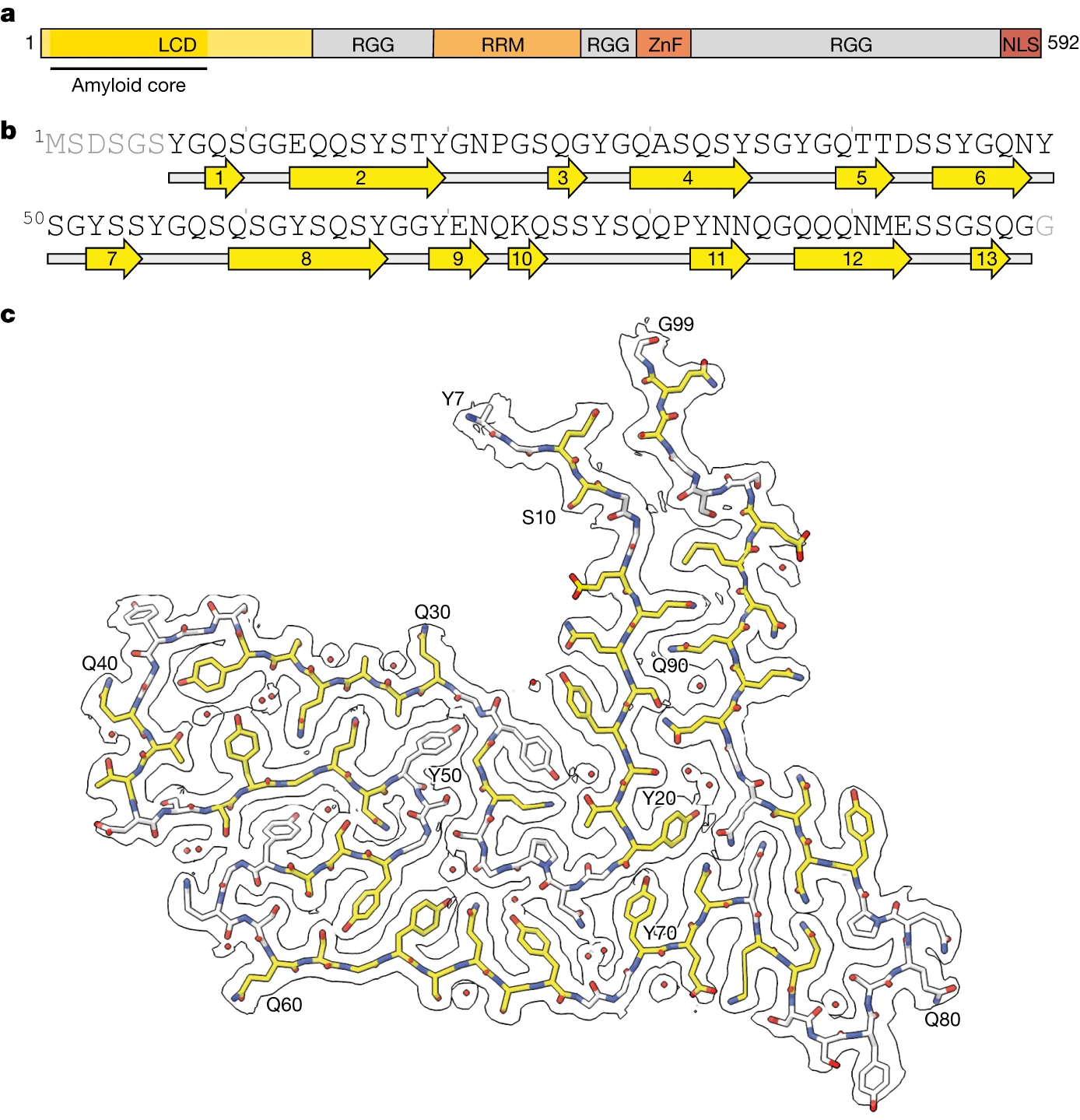
来自FTLD-FET的TAF15淀粉样丝的低温EM结构
此外,我们在两个人的运动皮层和脑干中发现了具有相同褶皱的TAF15细丝,都显示上下运动神经元病理学。FTLD中具有特征褶皱的TAF15淀粉样丝的形成建立了神经退行性疾病中的TAF15蛋白病。TAF15淀粉样丝的结构为神经退行性疾病模型系统的发展以及针对TAF15蛋白病的诊断和治疗工具的设计提供了基础。
综上所述,FTLD中具有特征褶皱的大量TAF15淀粉样丝的存在使TAF15成为已知形成神经退行性疾病相关淀粉样丝的一小群蛋白质的成员。这重点关注TAF15蛋白病在神经退行性疾病中的作用。根据对FTLD命名的共识建议,强烈主张放弃经常使用的术语FTLD-FUS,转而支持之前建议的FTLD-FET,甚至可能适合考虑使用FTLD-TAF术语。TAF15细丝的结构将指导模型系统的发展,以研究疾病机制,并将为设计针对神经退行性疾病中TAF15蛋白病的诊断和治疗工具提供基础。
原始出处
Tetter, S., Arseni, D., Murzin, A.G. et al. TAF15 amyloid filaments in frontotemporal lobar degeneration. Nature (2023). https://doi.org/10.1038/s41586-023-06801-2


