Exp Hematol Oncol:高危DLBCL的CNS预防新进展
时间:2024-01-12 20:59:19 热度:37.1℃ 作者:网络
弥漫性大B细胞淋巴瘤 (DLBCL) 的中枢神经系统 (CNS) 复发并不常见(2-10%),但预后较差(仅2-6个月)。在 DLBCL 中使用 CNS 预防在很大程度上是根据治疗高级别淋巴瘤(如 Burkitt 淋巴瘤和急性淋巴母细胞淋巴瘤)的经验外推,尽管 CNS 预防的价值缺乏前瞻性随机对照研究,但CNS预防仍广泛使用。
新加坡国家癌症中心Valerie Shiwen Yang教授等近日于《Experimental Hematology & Oncology》发表综述,阐述了以下内容:现有的建议和指南、CNS预防高危患者的选择、利妥昔单抗治疗前和利妥昔单抗时代 CNS 复发模式的差异、CNS治疗及强化全身治疗和新药的应用。

CNS预防的国际临床指南对比
在 DLBCL 患者中使用 CNS 预防的实践在全球范围内存在差异,不同国家或地区的指南之间的差异对比见表1。
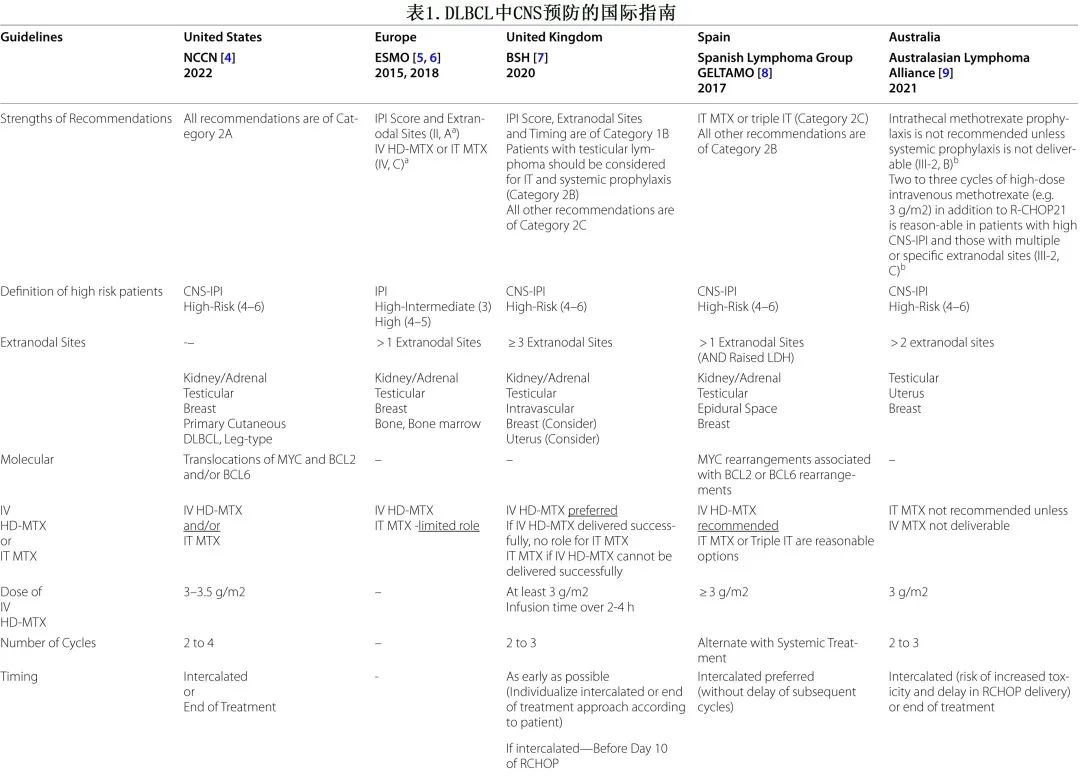
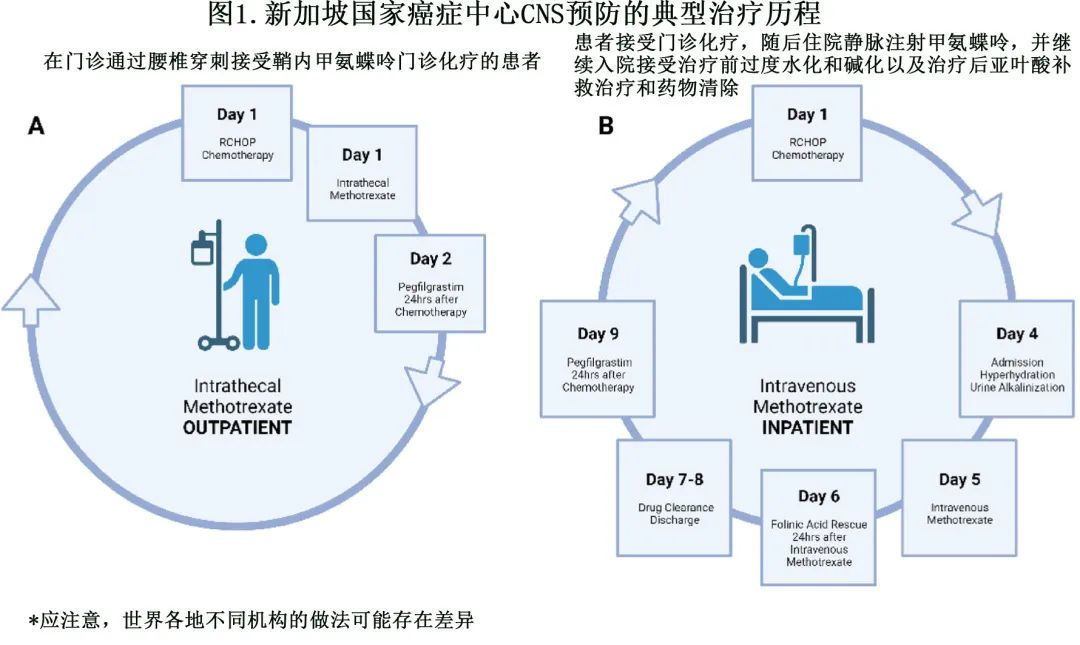
静脉注射大剂量甲氨蝶呤 (IV HD-MTX) 似乎是各种指南的首选,但其需要住院监测、水化、尿液碱化和药物清除,因此需要利用更多医疗资源(图1)。在资源有限或患者不适合 IV HD-MTX 的情况下,鞘内注射甲氨蝶呤 (IT MTX) 可作为替代方案。
哪些患者为CNS复发高风险?
鉴于在现有文献中尚未充分确定 CNS 预防的获益、风险和副作用,因此适当选择发生 CNS风险最高的患者以使获益最大化和损害最小化非常重要。
预后模型:CNS‑IPI和其他
关于确定与 CNS 复发相关的临床和生化风险因素的报道较多。Hollender等基于大样本高级别非霍奇金淋巴瘤,报告了利妥昔单抗前时代的结果(表2),将结外部位数量、年龄、血清乳酸脱氢酶水平、血清白蛋白水平和是否存在腹膜后淋巴结等因素纳入该风险分层模型,其中高危患者的 CNS 复发风险超过25%。
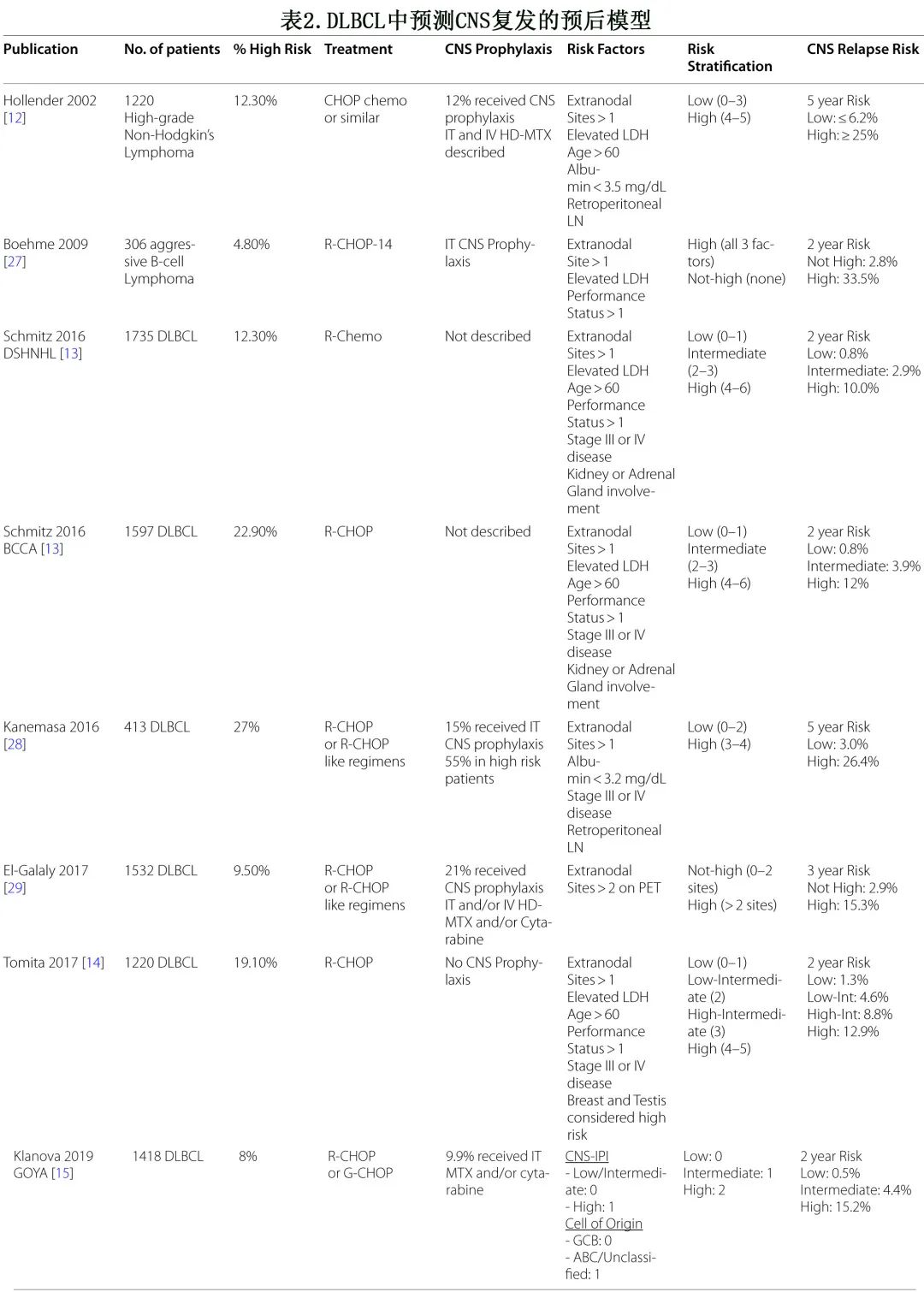
进入利妥昔单抗时代,Schmitz等根据德国高级别非霍奇金淋巴瘤研究组 (DSHNHL) 研究开发了CNS-IPI 评分,并在不列颠哥伦比亚省癌症机构 (BCCA) 的独立患者队列中进行验证。CNS-IPI评分包含IPI评分(年龄、血清 LDH 水平、体能状态、分期和结外部位)、肾脏和/或肾上腺受累。验证研究表明,CNS-IPI在接受RCHOP化疗方案治疗的 DLBCL 患者中估计CNS 复发或进展风险方面具有高度重现性。DSHNHL队列与 BCCA 队列相比,CNS复发的2年发生率分别为:低危0.6% vs 0.8%,中危3.4% vs 3.9%,高危10.2% vs 12.0%。但由于高危 CNS-IPI 组仅包括研究队列中55%的 CNS 复发患者,因此还需要考虑更多其他变量,以进一步完善 CNS 复发高危患者的选择。重要的是,高危解剖部位(如乳腺和睾丸受累)以及细胞来源对预测 CNS 复发具有显著影响,将在后续章节中讨论。
解剖部位
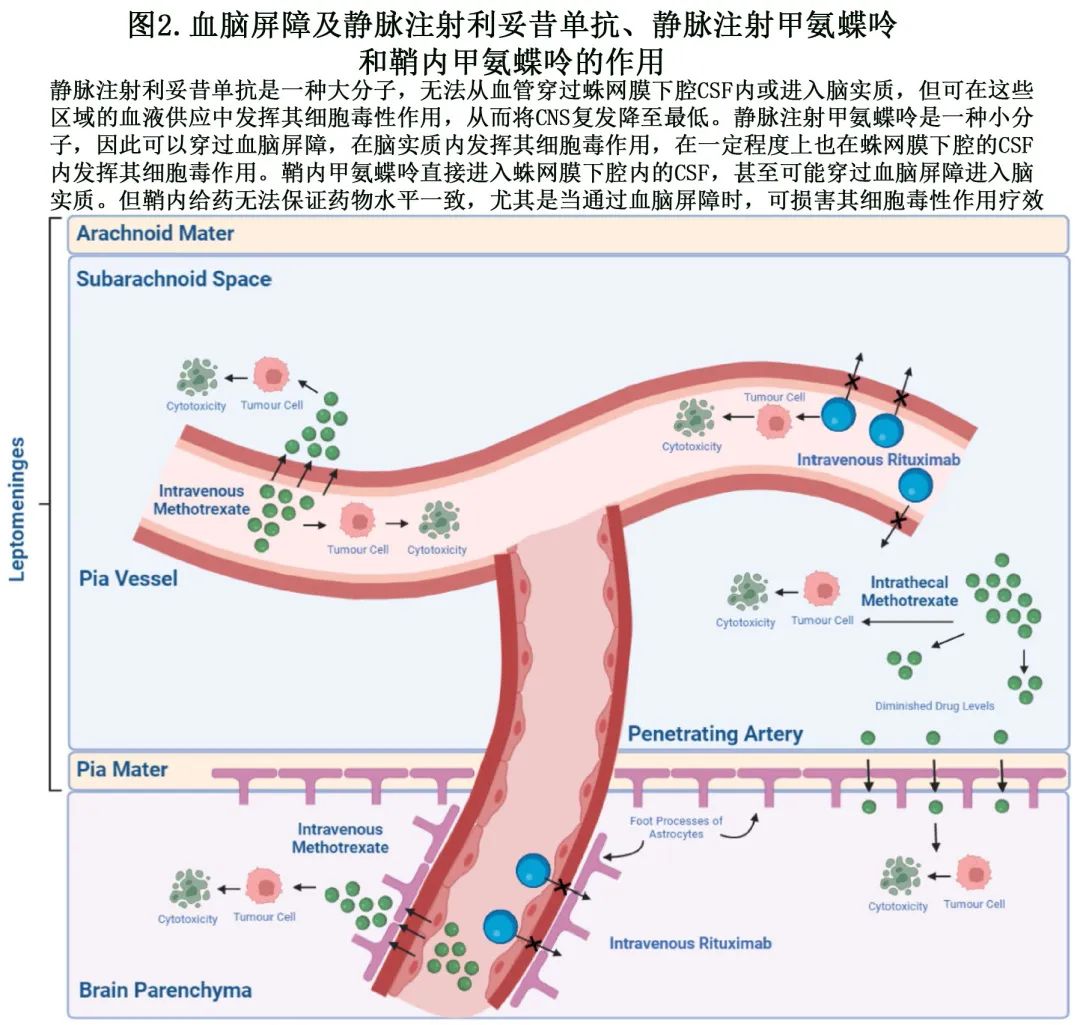
累及某些解剖部位也与 DLBCL 患者 CNS 复发风险较高相关,但并非所有的解剖部位都属于相同高的风险,其中肾脏和肾上腺受累最被认可,且已整合到广泛使用的 CNS-IPI 评分中。睾丸、骨髓和乳房受累也是 CNS 预防的重要考虑因素,并纳入大多数指南的建议中,如表1和2所示。在 Tomita 等的一项回顾性研究中,根据标准 IPI 评分,乳房受累的患者中只有29%认为是高危,而89%的肾上腺和/或肾脏受累患者处于高-中危或高危。最新的第5版WHO淋巴肿瘤分类中创建了一个新术语“免疫豁免部位的大 B 细胞淋巴瘤”,以区分免疫功能正常患者的CNS、玻璃体视网膜和睾丸原发性 B 细胞淋巴瘤与其他 B 细胞淋巴瘤。这是为了识别不同的解剖屏障,如血脑屏障 (BBB)(图2),相关屏障使这些位点成为免疫避难所。这些部位的原发性 B 细胞淋巴瘤具有独特的免疫调节系统,导致不同的发病机制以及免疫表型和分子特征,因此可以解释其CNS趋向性(Tropism)。具体在后面章节讨论。
解剖部位如头颈部(鼻窦、硬腭)、解剖学上接近 CNS 的区域(硬膜外、硬脑膜、椎旁、眼眶)和其他部位(如子宫和血管内)受累也有报告认为 CNS 复发的风险更高。但各研究中的报告并不一致,部分原因是发生率较低,因此强调了考虑 CNS 预防时医生判断的重要性。
细胞来源
除了使用 CNS-IPI 评分对患者进行风险分层外,还评价了其他生物标志物,以尝试进一步改善 CNS 复发高风险患者的选择。细胞起源 (COO) 亚型对 DLBCL 患者的结局具有预后影响,ABC亚型或non-GCB亚型的生存期比GCB亚型差。ABC亚型 DLBCL 的特征还包括 CDKN2A 基因异常,可影响NF-κB信号转导,可能有助于 CNS 趋向性。
Savage等报告 ABC 亚型 DLBCL 与 CNS 复发风险增加相关,随后 GOYA III 期研究评估了该结果,该研究是评估CD20 抗体奥妥珠单抗与利妥昔单抗在 DLBCL 患者中的疗效。高 CNS-IPI 评分和 ABC 或无法分类亚型 DLBCL 与 CNS 复发独立相关(分别为HR=4.0,p=0.02;HR=5.2;p=0.0004)。在拟定的 CNS-IPI-C 评分中合并两个参数,高危(定义为高 CNS-IPI 评分和 ABC/无法分类亚型)的2年 CNS 复发率为15.2%,而低危(定义为低 CNS-IPI 评分和 GCB 亚型)为0.5%。但解释结果时应谨慎,其排除了CHOP以外的细胞毒化疗,可能有高危患者已接受 IV HD-MTX 作为 CNS 预防但未纳入分析。
因此,DLBCL患者 CNS 复发的风险评估可能应结合 CNS-IPI 评分和COO,还需要在更大的前瞻性队列中进行进一步的验证研究来证实。
双打击和三打击DLBCL
存在涉及MYC、BCL2和/或 BCL6 癌基因的染色体易位的双打击或三打击淋巴瘤与 CNS 复发风险升高相关,该组患者约占所有新诊断侵袭性 B 细胞淋巴瘤的5%。在一项回顾性分析中,3年时 CNS 受累的累积发生率高达13%。在诊断时未记录 CNS 疾病的患者中,接受预防性鞘内治疗的患者最终 CNS 受累率低于未接受预防性鞘内治疗的患者(3年时5% vs 15%,p=0.017)。Petrich等的另一项分析也表明,对于诊断时无 CNS 受累的患者,含甲氨蝶呤的 CNS 预防(静脉或鞘内)的中位总生存期 (OS) 长于未接受 CNS 预防的患者(45 vs 14个月)。双打击或三打击淋巴瘤CNS复发风险增加,且可能从 CNS 预防治疗中获益。
双表达DLBCL
在双表达淋巴瘤患者中,在免疫组织化学中检测到 MYC 与 BCL2 共表达,而原位杂交中未发现相关易位,其CNS复发风险可高达9%,而非表达者为2%。双表达患者比双打击或三打击淋巴瘤更常见,DLBCL 病例中约有1/3。双表达淋巴瘤中 CNS 复发的风险增加似乎仅限于 DLBCL 的 ABC 亚型及中危至高危 CNS-IPI 评分患者,表明虽然免疫组化上的双表达可以帮助识别一组 CNS 复发风险较高的患者,但风险分层还应包括其他临床和分子因素。
基因组特征(Genomic signature)和CNS趋向性
可通过生物学标志物识别的 CNS 趋向性概念是一个新研究领域。在体内小鼠模型中,CDKN2A和 ATM 缺失为 CNS 趋向性的关键决定因素。NF-κB过度活化可促进 CNS 趋向性,此外ITGA10 和 PTEN 水平升高与 CNS 复发相关,而 CD44 和 cadherin-11 表达似乎具有保护作用。
在 Wang等的一项研究中,在超过20%的原发性 CNS 淋巴瘤 (PCNSL) 患者中发现BTG2、PIM1、DUSP2、ETV6和 CXCR4 的基因异常。在一组后来发生继发性 CNS 复发的高危 DLBCL 患者中进行评估,发现70%的患者中该5个基因发生多个异常。
MYD88、CD79B和 PIM1 突变好发于结外部位,包括CNS 和其他解剖部位(乳房和睾丸),这些通常考虑 CNS 预防。这些突变几乎仅见于 DLBCL 的 ABC 亚型,而后者是 CNS 预防的风险因素。
虽然仍需要在更大的队列中进一步研究和验证,但或许可以开发使用特定基因panel的基因组风险评估,以识别 CNS 复发高风险的患者,这些患者需要 CNS 预防。对 CNS 趋向性的进一步理解也可能有助于未来开发特异性靶向这些通路的诊断工具和治疗。
循环DNA和克隆型DNA
现有 CNS 受累的检测技术主要使用脑脊液 (CSF) 采样进行细胞学和流式细胞术来检测 CNS 病变,但不定期 CSF 采样可能无法提供足够的产量来确定 CNS 受累,此外CSF标本可能被血液污染,损害样本质量,已证明 CSF 细胞学检查的假阴性率为20-60%。流式细胞术可提高细胞学阴性患者恶性肿瘤细胞检测的灵敏度,但目前仍需要改善 CSF 标本中病变的检测。
近年来循环DNA (ctDNA)进展巨大,检测 CSF 中的 ctDNA 可能对识别 CNS 复发高危人群有价值。Bobillo等发现,CNS 复发前,在放射学和流式细胞术没有 CSF 疾病结果的情况下,即可检测到 CSF ctDNA。ctDNA可能有助于早期检测 CNS 复发,并及时提供适当治疗。
脑脊液游离 DNA(CSF cfDNA) 与 CNS-IPI 评分呈正相关,与 CNS-IPI 危(0–3) 组相比, CNS-IPI 高危组浓度较高,表明即使无疾病的临床、放射学或细胞学证据,存在CSF cfDNA仍可能是 CNS 受累的指征。
在利妥昔单抗时代,更多的 CNS 复发主要发生于脑实质,因此相对于孤立或同时累及软脑膜的患者,CSF分析在检测恶性肿瘤细胞方面的效用可能有限。从肿瘤组织源性基因组 DNA 中检测到的免疫球蛋白基因位点的可变区、多样性和连接区 (VDJ) 的克隆型、肿瘤特异性 DNA 重排可用作生物标志物,通过基于二代测序 (NGS) 检测 CSF 样本中的 CNS 受累情况。对于仅患有脑实质疾病的患者,即使其 CSF 细胞学和流式细胞术评价结果为阴性,也可鉴定出克隆型DNA;阳性患者诊断后12个月 CNS 复发的累积风险为29%,而阴性患者为0%(p=0.045)。
氟-18氟脱氧葡萄糖PET-CT
氟-18氟脱氧葡萄糖 (18FDG) PET-CT是 DLBCL 患者的重要诊断工具,可显示受累的疾病部位,并提供关于代谢活动的信息,以指导活检;重要的是亦可用于确定是否需要进行骨髓评估,因为骨髓评估通常不在 PET-CT 结果为阴性时进行。在一项韩国研究中,作者研究了治疗前18FDG PET-CT 在预测 CNS 复发方面的价值,表明总病灶糖酵解 (TLG) 对 DLBCL 具有预后价值。通过平均标准摄取值(平均SUV)和代谢性肿瘤体积 (MTV) 的乘积计算总病灶糖酵解,基于多变量分析,阈值定为 50% 的高 TLG (TLG50)作为预测复发的预后因素具有统计学显著性(p=0.04),且高和低 TLG50 组之间 CNS 无进展生存期 (PFS) 存在显著差异(43.9 vs 65.6个月)。表明通过 PET-CT 成像获得的代谢和体积参数可为 DLBCL 患者提供进一步的预后信息,并识别 CNS 复发高风险患者。
最近的一项研究表明,与仅包含临床变量的模型相比,包含临床变量和18FDG PET-CT 成像指标的基于人工智能 (AI) 的模型可改善预后效用。与低危患者相比,该 AI 模型高危患者CNS 复发风险显著增加(HR=5.42),将CNS-IPI 评分与该 AI 模型相结合时,高危患者的2年 CNS 复发概率高达17%。从而进一步显示出 PET-CT 影像学参数的预后价值,以及与AI 结合可便于其在临床实践中应用。
利妥昔单抗前时代和利妥昔单抗时代的CNS复发模式
在利妥昔单抗作为 DLBCL 全身治疗的治疗药物出现后,CNS 复发模式也发生变化。了解这些模式可为开发降低 DLBCL 患者 CNS 复发风险的新策略提供见解。
复发部位:软脑膜vs脑实质
利妥昔单抗治疗前时代大多数复发发生于软脑膜,但在利妥昔单抗时代,CNS复发更常发生于脑实质内,约占所有复发的60%,而软脑膜复发为15-20%。利妥昔单抗是一种分子量为145千道尔顿的大分子,尽管输注时可达到较高的全身剂量水平,但其对 CNS 的渗透性不佳。以标准剂量 375 mg/m2 给药时利妥昔单抗的 CSF 浓度仅达到血清浓度的约0.1%,主要是由于 BBB 的功能,其不仅代表血脑界面之间的单一屏障,还包括宏观和微观水平上的多个屏障水平。
通常只有低分子量(400–600道尔顿)的分子可以在微观水平穿过BBB。在环磷酰胺、多柔比星、长春新碱和泼尼松龙 (CHOP) 化疗基础上加用利妥昔单抗可改善细胞毒性,可能对软脑膜内(肿瘤细胞也存在)的脉管系统产生作用,从而减少软脑膜复发。单独的分子量不可能是促使药物通过 BBB 的唯一因素,未知的许多复杂的相互作用也可能会产生影响,例如存在外排泵(efflux pumps)。由于药物穿过 BBB 进入脑实质的渗透性随着与血管的距离增加呈指数下降,因此与脑实质相比,软脑膜可暴露于高水平的利妥昔单抗全身给药。由于软脑膜复发减少和利妥昔单抗脑实质穿透率较差,导致脑实质复发的比例反而增加,而改善全身控制可能会加重该模式,也强调了开发 CNS 穿透性药物的必要性。
利妥昔单抗时代IT MTX缺乏获益
在利妥昔单抗治疗前时代,DLBCL患者使用鞘内化疗预防 CNS 主要来自 Burkitt 淋巴瘤和 急性淋巴母细胞淋巴瘤的经验,可缓解脑膜 CNS 复发。对于Burkitt淋巴瘤,在利妥昔单抗给药前时代使用含 IT MTX 的方案进行 CNS 预防可使 CNS 复发率降低约6-11%。
但在利妥昔单抗时代,鞘内化疗未降低 DLBCL 患者的 CNS 复发率。此外如上所述,利妥昔单抗时代软脑膜复发的发生率降低也可能导致难以检测到获益。甲氨蝶呤是为数不多的可以鞘内给药的药物之一,其低分子量约为450道尔顿,使其能够穿透 BBB 进入脑实质。虽然鞘内给药允许在 CSF 微环境内进行良好的药物递送,但其疗效仍依赖于 CSF 循环,以在 CNS 内均匀分布。当药物进入腰椎区域的脊髓蛛网膜下腔时,药物水平会随着循环而降低,导致其对脑实质的作用进一步缩小。虽然鉴于甲氨蝶呤的 CNS 穿透性,其是一种有吸引力的治疗选择,但其治疗 DLBCL 的疗效可能不如其他药物(如利妥昔单抗)。
血液、脑和 CSF 之间的复杂作用,可能进一步阻碍鞘内给药通过CSF渗透到脑实质,且药物进入不仅受到扩散的限制,还受到外排转运蛋白和载体介导的转运系统的限制。
孤立性CNS复发 vs 并发CNS和全身复发
在利妥昔单抗时代,DLBCL患者的孤立性 CNS 复发约占所有 CNS 复发的70-75%,其余为并发 CNS 和全身复发。在一项研究中,接受RCHOP、CHOP或R-CHOEP化疗的患者之间孤立 CNS 复发的发生率无显著差异,但接受利妥昔单抗为基础化疗的患者中孤立性 CNS 复发的发生率在数值上高于接受 CHOP 而未接受利妥昔单抗的患者 (74.1% vs 69.2%)。RICOVER-60 研究中也观察到该情况。总体而言,可能表明全身控制有所改善,以及利妥昔单抗进入 CNS 的穿透率较差;这反过来进一步强调了需要考虑使用利妥昔单抗为基础的化疗进行 CNS 预防,以缓解该组患者的 CNS 复发。至于并发 CNS 和全身复发的患者,其可能是疾病生物学较差和总体预后较差的亚组,因此需要进一步完善当前高危疾病的选择标准,并在一线治疗中强化全身治疗。
CNS复发的时间:真的双峰分布?
多项研究报告认为 CNS 复发早期发生,从 DLBCL 诊断后6-8个月不等,但早期和晚期复发似乎呈双峰分布。在一项研究中,24%的患者发生早期 CNS 复发(包括在初始全身治疗期间),而76%的患者在诊断后约2年发生晚期 CNS 复发。Bobillo等还证明 CNS 预防可减少1年时的 CNS 复发,但该减少在5年时无统计学显著性。因此,早期复发可能代表基线时的隐匿性 CNS 病变,而给予 CNS 预防似乎可降低早期 CNS 复发率(如果其真正作用是早期治疗隐匿性 CNS 疾病)。
另一项研究考察了 CHOP 化疗方案中加用利妥昔单抗对 CNS 复发的影响,DLBCL诊断至 CNS 复发的中位间隔时间相似,约为6个月。这些早期复发可能代表未检测到的隐匿性 CNS 病变,加用 CNS 渗透性差的利妥昔单抗不太可能改变早期复发。但接受利妥昔单抗治疗的患者 CNS 复发后的中位生存期显著延长(365天 vs 75 天),表明即使在继发性 CNS 复发的情况下,改善的全身控制也确实可改善生存结局。Villa等表明,达到完全缓解的患者CNS复发显著减少。上述结果支持该观点:加用利妥昔单抗可能通过改善全身症状控制来减少晚期 CNS 复发。
CNS治疗
本节旨在比较不同路径CNS 预防的疗效。
IT MTX vs.无CNS预防
在 DLBCL 或侵袭性 B 细胞淋巴瘤患者中使用 IT MTX 作为 CNS 预防,在很大程度上是根据 Burkitt 淋巴瘤和急性淋巴母细胞淋巴瘤(标准组分)的治疗方案外推而来,但其作为 CNS 预防的实用性受到质疑,尤其是在利妥昔单抗时代。
Eyre 等人的系统综述表明,对于接受抗 CD20 抗体和蒽环类药物免疫化疗的 DLBCL 患者,无报道明确证实单独鞘内化疗(以甲氨蝶呤为主)作为 CNS 预防有明确获益,即使在 DLBCL 一般人群中校正混杂因素后仍是如此。但作者也认为,表明缺乏获益的现有证据质量也很差,因此无法完全排除其效用。考虑到与脑实质相比,软脑膜中发生 CNS 复发的比例降低,IT MTX作为 CNS 预防在利妥昔单抗时代的获益也可能降低。
是否应考虑将 IT MTX 作为CNS 预防的备选方案,尤其是禁忌IV HD-MTX 的患者中?此类患者可能包括器官功能不全的患者和发生显著骨髓抑制的患者。老年患者的器官功能储备往往较差,有研究单独审查了 IT MTX 在≥70岁患者中的应用,未观察到 IT MTX 的明显获益,且在使用鞘内 CNS 预防的全身性治疗期间感染相关入院的独立风险增加。虽然在一些指南中,IT MTX仍是无法接受或耐受 IV HD-MTX 的患者的建议,但应谨慎考虑其风险。
IV HD‑MTX vs.无CNS预防
在利妥昔单抗时代,与软脑膜相比,脑实质 CNS 复发的比例更高,IT MTX不太可能提供显著的脑实质内浓度以达到充分的 CNS 预防,因此IV HD-MTX旨在在脑实质内提供更好的浓度。因此如前所述,它是主要指南中 CNS 预防的首选途径。然而IV HD-MTX是否对 CNS 复发有效?作者对文献进行了如下评估。
在一个意大利中心,未接受 IV HD-MTX 的患者 CNS 复发率为12%,而接受预防的患者为2.5%(p=0.03),但这项研究人群存在不平衡,表现为晚期、LDH水平升高和高危解剖位置。另一项多中心研究中,未接受 IV HD-MTX 的患者中孤立性 CNS 复发的3年累积发生率为14.6%,而接受 IV HD-MTX 的患者为3.1%,具有统计学显著性 (p=0.032)。倾向评分匹配人群的进一步分析也产生相似结果,但队列相对较短的20个月随访时间可能低估晚期复发的数量。
另一方面,Puckrin等表明,在加拿大艾伯塔省接受治疗的 CNS 复发高危患者组中,IV HD-MTX作为 CNS 预防治疗无显著获益,IV HD-MTX组的 CNS 复发风险为11.2%,而非 IV HD-MTX 组为12.2%;即使在通过多变量分析和倾向评分分析解释混杂因素后,IV HD-MTX与 CNS 复发之间仍无相关性。另一项韩国研究的结果相似(12.4% vs 13.9%),进行倾向评分匹配和逆概率治疗加权 (IPTW) 分析以克服治疗组之间的潜在偏倚,结果得出的结论保持不变。
最近Lewis等介绍了一项大型回顾性研究的结果,纳入2400多例随访5年以上的高危侵袭性 B 细胞淋巴瘤患者,虽然CNS 进展的5年风险从8.5%显著地降至6.9%(下降1.6%,HR=0.59,p=0.014),但降幅不具有临床意义,转换需要为63例患者接受 CNS 预防才能预防1次 CNS 复发。在一线治疗结束时达到完全缓解的患者(即在获得良好的全身控制后可以明确检查 HD-MTX CNS 预防的直接作用的患者组)中进行分析时,也没有发现统计学显著性。亚组分析还表明,与未接受 CNS 预防的患者相比,接受 IT MTX 的患者 CNS 进展风险未降低(IT MTX的5年 CNS 进展风险为8.0%,而无 CNS 预防的患者为8.5%)。接受嵌入(intercalated) HD-MTX 对比全身治疗后接受 HD-MTX 的患者 CNS 进展风险之间也无差异。作者也认可,确定回顾性研究的确切结论时面临挑战,但仍努力通过合理的统计方法将偏倚降至最低。虽然这项单一研究无法明确回答带问题,但在目前可用的文献中,它越来越多地将矛头转向 IV HD-MTX 作为 CNS 预防的获益有限。
鉴于上述情况,IV HD-MTX在 CNS 预防中的应用受到质疑。虽然无法排除在具有 CNS 复发最高风险的一组经过充分选择的患者中具有明确获益的可能性,但大多数接受 IV HD-MTX 作为 CNS 预防的患者的获益界值似乎较小(如果有),且获益可能不足以证明对医疗保健系统造成的毒性和负担的合理性。随机对照研究仍是最终证明 IV HD-MTX 疗效的金标准,但考虑到 CNS 复发的发生率较低,这极具挑战性,因此对大量人群进行多中心和多国回顾性分析可能是指导治疗实践的更现实和可行的方法。
IT MTX vs IV HD‑MTX
对比鞘内和静脉甲氨蝶呤预防 CNS 的比较多为回顾性。在纪念斯隆-凯特琳癌症中心的一项回顾性单中心研究,纳入接受RCHOP 或 RCHOP 样化疗的CNS 复发高风险(因素包括CNS-IPI 评分、高危解剖部位以及有 MYC 和 BCL2重排)DLBCL患者,多数患者 (86%) 接受 IT MTX 治疗,两种给药途径的 CNS 复发风险似乎相似,IT MTX的5年 CNS 复发风险为5.6%,而 IV HD-MTX 为5.2%。
美国另一项多中心研究审查了21家学术中心的1162例患者,结果显示大多数 (77%) 患者接受 CNS 鞘内预防,IT MTX和 IV HD-MTX之间未观察到 CNS 复发的显著差异(5.4% vs 6.8%,p=0.40)。进行统计策略(如倾向评分匹配,校正CNS-IPI、接受的给药次数和基础化疗方案)以解释两组之间的差异,结果仍相似;由于死亡可能代表 CNS 复发的竞争风险,作者进行了竞争风险分析,也未发现给药途径之间的差异。
目前文献中的证据表明,IT MTX和 IV HD-MTX 的 CNS 复发无显著差异,但如果单纯 IT MTX 或 IV HD-MTX 作为 CNS 预防均无显著获益,则该临床问题仍存在缺陷且无根据。大多数指南中 IV HD-MTX 的建议,仍是基于利妥昔单抗时代脑实质复发增加的观察结果,以及 IV HD-MTX 可能提供更高 CNS 脑实质渗透性的理论理解。仅当 IV HD-MTX 禁忌时才考虑IT MTX。即使可以明确证实 CNS 预防的获益,首选给药途径的研究也将面临至少相同的挑战(如果没有其他更多挑战)。
是否需要IT MTX联合IV HD‑MTX?
IT MTX 可提供较高的 CSF 药物水平,主要在软脑膜内发挥作用,而 IV HD-MTX 可提供较高的脑实质渗透性,因此Faqah等巴基斯坦的单中心回顾性研究中提出联合方案,尽管没有统计学意义,但接受IT MTX 和 IV HD-MTX 的患者在给予 CHOP 化疗±利妥昔单抗给药时,3年 CNS 复发率数值最低,3年总生存率最高。值得注意的是,鉴于药物获取问题,本研究中未强制要求给予利妥昔单抗。鉴于利妥昔单抗目前是 DLBCL 治疗的标准治疗,省略利妥昔单抗将导致全身控制欠佳,并导致相关的CNS 复发增加。因此,联合使用 IT MTX 和 IV HD-MTX 可能更有效,因其可补偿未接受利妥昔单抗治疗的患者较差的总体结局。这与利妥昔单抗前时代的观点一致,即IT MTX和 IV HD-MTX 联合给药作为 CNS 预防,可减少高危患者(根据 IPI 评分)的 CNS 复发。
原发性睾丸淋巴瘤(PTL)涉及免疫豁免部位,与具有许多共同临床病理学和生物学特征的原发性 CNS 淋巴瘤相似,因此具有高达30%的 CNS 复发风险。对于 CNS 复发风险较高的这组患者,IT MTX和 IV HD-MTX 预防给药无法为多数患者提供充分的保护,表明联合给药可能过度治疗而未改善保护性获益。然而,最近在54例患者中进行的一项 II 期研究表明,鞘内脂质体阿糖胞苷联合IV HD-MTX的5年 CNS 复发率为0%,而仅使用 IT MTX 的既往研究中为6%。
总体而言,鉴于IT MTX 或 IV HD-MTX 的效用还尚不明确,联合方案的风险(包括药物毒性和腰椎穿刺额外操作风险方面)可能并不适当。
HD‑MTX IV给药的方案
为了克服 IV HD-MTX 给药的挑战,部分中心调整 IV HD-MTX 常规给药方式方面。IV HD-MTX用于 CNS 预防,可在 RCHOP 化疗周期之间(嵌入,intercalated)或治疗结束时给药。具体做法因机构而异,但确实观察到 DLBCL 患者发生早期 CNS 复发,且在诊断后6-8个月内报告。因此可以假定,与RCHOP治疗结束时给药相比,通过将 IV HD-MTX 嵌入RCHOP 化疗周期来尽早给予 CNS 预防,可及时预防 CNS 复发。在 RCHOP 周期内嵌入IV HD-MTX可能增加毒性,例如骨髓抑制和急性肾损伤 (AKI),导致延迟给予全身免疫化疗,从而影响治疗强度。Wil-son等开展了一项回顾性多中心研究以比较两种方法,但未观察到 CNS 复发率的差异;但采用嵌入给药时毒性增加,导致RCHOP延迟。
如果选择嵌入给药,必须注意的是,在 RCHOP 化疗后超过10天接受 IV HD-MTX 的患者与较高的治疗延迟率相关。研究还表明,IV HD-MTX可早在 RCHOP 第1天给药,而不会延迟治疗方案。在第2周期或之后开始 IV HD-MTX 治疗时,发热性中性粒细胞减少和 AKI 的发生率较低。
HD-MTX IV 给药通常需要伴随补液管理和尿碱化,以及密切监测液体平衡和尿PH,还需要亚叶酸解救和血浆甲氨蝶呤清除监测。虽然接受 IV HD-MTX 的患者通常需要住院,但更有动力将其转移到门诊环境中,据描述,在适当的患者选择下是安全可行的。
阿糖胞苷
静脉注射阿糖胞苷
阿糖胞苷是一种 CNS 渗透性药物,高危 DLBCL 患者中联合强化免疫化疗方案时CNS复发率较低。当以约 3 g/m2 的高剂量给药时,阿糖胞苷可在 CNS 内达到细胞毒性水平,但高剂量阿糖胞苷的CSF 浓度仅有鞘内阿糖胞苷给药时的1%左右。高剂量阿糖胞苷也有显著的副作用,如骨髓抑制、神经毒性和眼毒性,如结膜炎。其作为 CNS 预防药物的作用仍有待研究。
鞘内阿糖胞苷
阿糖胞苷也是为数不多的可鞘内给药的药物之一。阿糖胞苷脂质体制剂可在给药后2周内维持 CSF 水平,具有相似的抗肿瘤活性和安全性特征。但阿糖胞苷多为三联鞘内联合给药(联合甲氨蝶呤和类固醇),而非单独给药,该方案来自急性淋巴母细胞淋巴瘤和 Bur-kitt 淋巴瘤治疗的既定方案,虽然是 DLBCL 患者的合理 CNS 预防治疗,但尚未与IT MTX 单药治疗进行比较,以证明加用阿糖胞苷是否可降低 CNS 复发率。一项前瞻性单组研究显示,在中位随访40个月时,在接受鞘内阿糖胞苷脂质体的患者中未观察到 CNS 复发。一项回顾性研究发现,在中位随访3年时,接受鞘内阿糖胞苷脂质体作为 CNS 预防的高危 DLBCL 患者无CNS复发。II 期 IELSG 30 研究中,CNS 复发高风险的原发性睾丸淋巴瘤患者在6年内未发生 CNS 复发(具体研究结果见本公众号同日发表的文章),基于此也可考虑鞘内阿糖胞苷联合 IV HD-MTX。
鞘内注射利妥昔单抗
如前所述,由于利妥昔单抗分子较大,其全身给药无法达到显著的 CSF 浓度,因此,尽管生存结局显著改善,但全身给药时作为活性 CNS 药物的作用并不重要。
相比之下,活动性软脑膜疾病患者的 BBB 可能被破坏,当全身给药时,利妥昔单抗的 CSF 浓度可能更高,据报告 CSF 浓度增加至血清浓度的3-4%。
已有病例系列和报告表明,鞘内注射利妥昔单抗在 CNS患者中显示出良好的疗效。此外据报告,即使鞘内联合静脉使用利妥昔单抗,软脑膜和脑实质均受累的患者也最有可能进展,而孤立性软脑膜疾病患者鞘内联合静脉利妥昔单抗的完全缓解率较高,约为50%。
期待关于 DLBCL 患者中使用鞘内利妥昔单抗作为 CNS 预防的进一步研究 [NCT03688451]。
强化全身治疗以减轻CNS病变
如前所述,DLBCL的有效全身治疗是预防 CNS 复发的基本因素。在此讨论了可添加至 CHOP 方案中的特定药物,以及添加这些药物是否可缓解 CNS 病变。
依托泊苷
在利妥昔单抗治疗前时代,CHOP化疗是标准治疗,加用依托泊苷是无 CNS 复发的独立预后因素,环磷酰胺、多柔比星、长春新碱、依托泊苷和泼尼松龙 (CHOEP) 化疗后 CNS 复发的风险显著降低,风险比为0.4(p=0.017),但该分析还包括其他组织学亚型如 Burkitt 淋巴瘤和其他淋巴母细胞淋巴瘤患者。
利妥昔单抗
在 CHOP 化疗方案中添加利妥昔单抗可将 CNS 复发的发生率从6.9%降至4.1%。在对 RICOVER-60 研究的患者进行的分析中,如果患者未接受利妥昔单抗治疗,未接受 IT MTX 治疗时 CNS 复发风险增加,但如果接受过利妥昔单抗,则联用或不联用 IT MTX 时 CNS 复发的风险显著降低。
利妥昔单抗和依托泊苷
有趣的是,未观察到加用利妥昔单抗和依托泊苷的化疗强化治疗可进一步降低 CNS 复发率。一项单中心回顾性研究显示,利妥昔单抗、依托泊苷、泼尼松、长春新碱、环磷酰胺和多柔比星 (R-EPOCH) 组的 CNS 复发率为6.2%,RCHOP组为2.4%,但差异不显著 (p=0.301)。III 期 CALGB 50303研究中,RCHOP 组 CNS 复发率为4.0%,R-EPOCH组为3.3%。这些结果可能表明,在 CNS 控制方面,单纯多药化疗强化全身治疗存在局限性,联合全身和鞘内化疗以及可实现更好全身控制的其他方案可以更有效地减少 CNS 复发。
ACVBP化疗
在高危侵袭性非霍奇金淋巴瘤患者中与标准 CHOP 化疗相比,进一步强化的多柔比星、环磷酰胺、长春地辛、博来霉素、泼尼松 (ACVBP) 化疗可改善无事件生存期 (EFS) 和OS。在该方案中,除诱导 ACVBP 外,还包括含 CNS 活性药物的序贯巩固治疗,如IV HD-MTX、依托泊苷、异环磷酰胺和阿糖胞苷。接受 ACVBP 方案的患者 CNS 进展或复发少于 CHOP (RR=2.99;p=0.002)。在利妥昔单抗时代,R-ACVBP治疗低中危DLBCL 的生存期也优于R-CHOP,且R-ACVBP组未观察到 CNS 复发,而 R-CHOP 组有2例患者。多中心临床试验数据的联合分析显示,R-ACVBP组的 CNS 复发率在数值上低于 R-CHOP 样方案组(1.6% vs 3.9%),但无统计学显著性 (HR=2.4;p=0.118)。
强化免疫化疗和自体干细胞移植
在 Puckrin 等开展的一项回顾性研究中,接受巩固性自体移植或强化免疫化疗方案(如利妥昔单抗、环磷酰胺、多柔比星、长春新碱和大剂量甲氨蝶呤[R-CODOX-M]、利妥昔单抗、异环磷酰胺、依托泊苷和阿糖胞苷[R-IVAC]或 R-EPOCH)的患者表现出 CNS 复发风险降低的趋势,两组患者的 CNS 复发率均为6.0%,而接受标准RCHOP治疗的患者为14.6% (p=0.09)。这些患者代表高危者,超过60%为CNS-IPI 4-6,超过40%为双打击淋巴瘤。在 CNS 复发患者中,59%并发全身性疾病,可能表明大多数 CNS 复发发生于全身控制不佳的情况下。另一项回顾性研究也观察到强化免疫化疗方案有降低 CNS 复发风险的趋势。
虽然这些结果很有前景,但其在一线治疗中的应用仍存在争议。除了一项荟萃分析发现HDC和自体 HSCT 的前期巩固治疗无法改善生存率,一项回顾性日本多中心研究也报告相似的 CNS 复发率。必须在随机试验中证明有较强获益,以证明使用 HDC 和自体 HSCT 减少 CNS 复发的合理性,尤其是考虑到其毒性和显著的死亡风险,即使证明其是减少 CNS 复发的有效方法,其使用也仅限于年轻和医学上fit的患者。
CAR‑T细胞疗法
近年来,CD19 CAR-T 细胞疗法在 DLBCL 治疗方面取得了重大进展,III期研究显示,axicabtagene ciloleucel和lisocabtagene maraleucel在二线治疗中的 EFS 获益大于 HDC 和自体HSCT。考虑到 CAR-T 细胞治疗相关免疫效应细胞相关神经毒性综合征 (ICANS) 的已知不良事件,在纳入 CNS 受累 DLBCL 患者方面存在重大担心。据推测,ICANS的机制与毛细血管壁周围内皮细胞(构成血脑屏障的一部分)周围的周皮细胞有关,周皮细胞也可能表达CD19的一种亚型(CAR-T细胞可靶向)。但根据回顾性研究报道,CAR-T细胞治疗 CNS 复发患者的 ICANS 没有增加,不应排除于这些研究。在1例患者中还描述,与匹配的血清样本相比,CSF中白细胞介素-6水平升高7倍。在探索 CAR-T 细胞治疗在高危患者一线治疗中作用的 ZUMA-12 研究中,中位随访16个月后未观察到 CNS 复发。CAR-T有望作为 CNS 活性治疗选择,值得进一步研究。
其他注意事项
CNS 是许多全身性抗癌药物无法渗透的庇护所,但随着分子尺寸较小的新型药物的开发,可以获得具有 CNS 活性的更好的治疗药物,可能会改变当前 DLBCL 患者 CNS 预防的前景。病例报告显示,伴 CNS 复发的 DLBCL 患者对免疫疗法单药或联合利妥昔单抗治疗有反应,未来研究的其他可能候选药物包括来那度胺或 BTK抑制剂。来那度胺是一种具有 CNS 活性的免疫调节剂,可穿透BBB,其CSF/血浆比值高达50%,CSF渗透率呈剂量依赖性增加,在复发/难治性 DLBCL 中也表现出单药活性,且耐受性良好。已在 DLBCL 患者中研究了泽布替尼单药治疗或联合RCHOP 的治疗方案,观察到适度的肿瘤缓解,其具有良好的 BBB 穿透性,蛋白结合的平均 CSF/血浆比值为94.0%。
讨论
除了更好地检测 CNS 病变和治疗进展外,该临床问题还有其他障碍。
首先,关于 CNS 预防在 DLBCL 患者中的作用存在混合观点的一个主要原因,在于缺乏研究该临床问题的随机对照研究,但考虑到 CNS 疾病的低发生率,一些实际的挑战会阻碍效力良好的研究的成功实施。例如,为了检测到 CNS 疾病从10%显著降低至6%,需要治疗的数量 (NNT) 为25,α为0.05,效力为80%,必须招募1400–1500例高危患者来回答该问题。根据CNS IPI,高危组仅占 DLBCL 的12%,则需要筛查超过10000例患者,这是几乎不可能实现的。因此,通过对大型数据集的回顾性分析来解决该临床问题可能更实际,这些数据集可能最终纳入荟萃分析,以在考虑每项研究的相对权重后提供更普遍的结论。
其次,考虑到缺乏随机对照试验,在现有证据分析方面存在显著的统计学挑战。现有数据主要包括回顾性研究,其中研究人群存在非对照固有差异,研究人群中的不平衡妨碍得出有力结论的能力,仅用于确定假设生成模式,而倾向评分匹配分析和 IPTW 允许对人群特征进行部分调整,以帮助确定干预的可能影响。回顾性研究也可能存在选择偏倚,例如在比较甲氨蝶呤的给药途径时,接受 IT MTX 的患者可能更衰弱,因为他们可能unfit或不适合IV HD-MTX。
最后,临床问题不仅是一个科学问题,也是一个伦理问题。虽然破译了确定最佳治疗时间、患者选择或最佳给药途径的现有证据,但更根本的问题在于是否有必要进行 CNS 预防。为了在研究中回答这个问题,需要一个未接受 CNS 预防的对照组患者,且这种“省略”需要以随机方式进行,而不仅仅是由医生或患者因素决定,随机化还应纳入 CNS 复发风险较高的患者。这可能导致医生面临伦理困境,因为在该组患者中省略 CNS 预防可能代表违反医生对患者的治疗职责。然而也必须记住,给予 CNS 预防并非没有副作用,如肾毒性和全身治疗延迟。即使应用“首先不伤害(first do no harm)”的规则,也不清楚省略或给予 CNS 预防是否意味着伤害。
未来方向和结论
文献中的现有证据虽然在很大程度上是回顾性的,但越来越多地表明 CNS 预防在高危DLBCL 患者中缺乏获益。如果可以证明有明确获益,则患者的相关风险和伴随的医疗费用是合理和微不足道的。通过分子学、组织病理学和形态学特征进一步完善患者选择,可能还会确定一组从 CNS 预防中获益的患者。还必须开发毒性更低的有效 CNS 穿透性治疗。同时还应努力改善高危 DLBCL 患者中隐匿性 CNS 疾病的检测能力,从而考虑将其用于 CNS 预防。
参考文献
Chua BJG, et al. Recent updates on central nervous system prophylaxis in patients with high‑risk diffuse large B‑cell lymphoma.Exp Hematol Oncol . 2024 Jan 3;13(1):1. doi: 10.1186/s40164-023-00467-2.


