Nat Rev Cancer:重磅综述癌症起源理论
时间:2024-03-15 16:00:26 热度:37.1℃ 作者:网络
2023年7月24日,英国剑桥大学的研究人员在《自然》子刊(Nature Reviews Cancer)上发表了题为:“癌症自招祸:癌症起源理论”的综述论文。
治疗任何疾病都需要深入了解疾病组织中的生物学机制。在19世纪和20世纪初,传染病是主要的致命原因,然而,20世纪上半叶癌症已经成为一个重要的杀手。随着对可以杀死快速分裂细胞的化学物质的发现,癌症化疗和分子靶向治疗等领域得以发展。对癌症与免疫系统相互作用的理解也催生了免疫治疗领域的发展。
尽管取得了这些进展,癌症仍然是导致疾病死亡的主要原因。因此,早期检测和治疗癌症或其前体对提高患者的生存率至关重要,同时也能降低治疗的侵入性、成本和副作用。
在这篇综述中,我们将讨论癌症起源的主要理论以及内外因素在恶性转变中的相对贡献。更好地理解这些过程将提高早期诊断癌症的能力,并在疾病较容易控制且治疗相对廉价且相对无害的阶段进行更精确的治疗。
一、癌症起源的理论
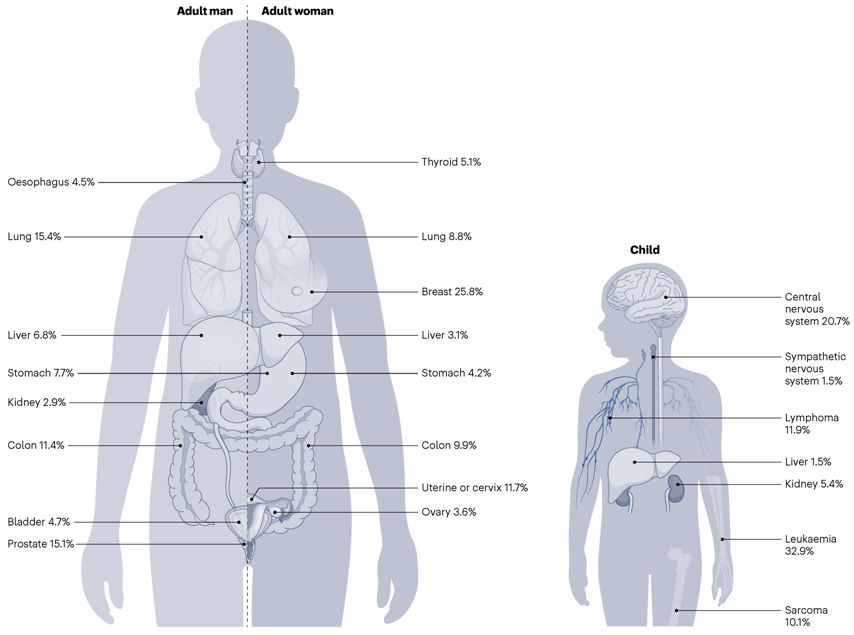
全球癌症类型的异质性源于不同的风险因素暴露和预期寿命差异,但是癌症并非随机发生,而是受到发育和衰老组织中可复现的决定因素的支配,尤其在儿童和成年人恶性肿瘤的比较中最为明显。
1、体细胞突变理论
癌症发病率随着年龄的增加而增加,这一观察结果可以用体细胞突变理论来解释。然而,一些观察结果与该理论不符,例如儿童和成年人肿瘤的自发性或激素驱动的退缩,以及注入囊胚的恶性畸胎瘤的正常化。这导致了对癌症组织结构域理论的提出。
2、组织结构域理论
组织结构域理论强调整个组织作为致癌物的靶点,扰乱了实质和间质或基质之间的生物物理和生物力学交流。这导致了正常组织结构的增殖和运动限制丧失,从而引发了进行性的上皮变质、异型增生和癌变。
3、“坏运气”理论
该理论主张,干细胞DNA复制过程中发生的随机错误(R突变)导致了癌症的发生。虽然与体细胞突变理论相似,但它提供了一个概念框架来理解遗传性和环境因素对癌症风险的相对贡献。
4、“基态”理论
该理论侧重于细胞的功能状态,即其“基态”,而不是细胞的分类。这个概念容纳了细胞可塑性的概念,即发育、衰老和损伤因素可以在不依赖细胞分裂的情况下改变细胞对转化的敏感性。
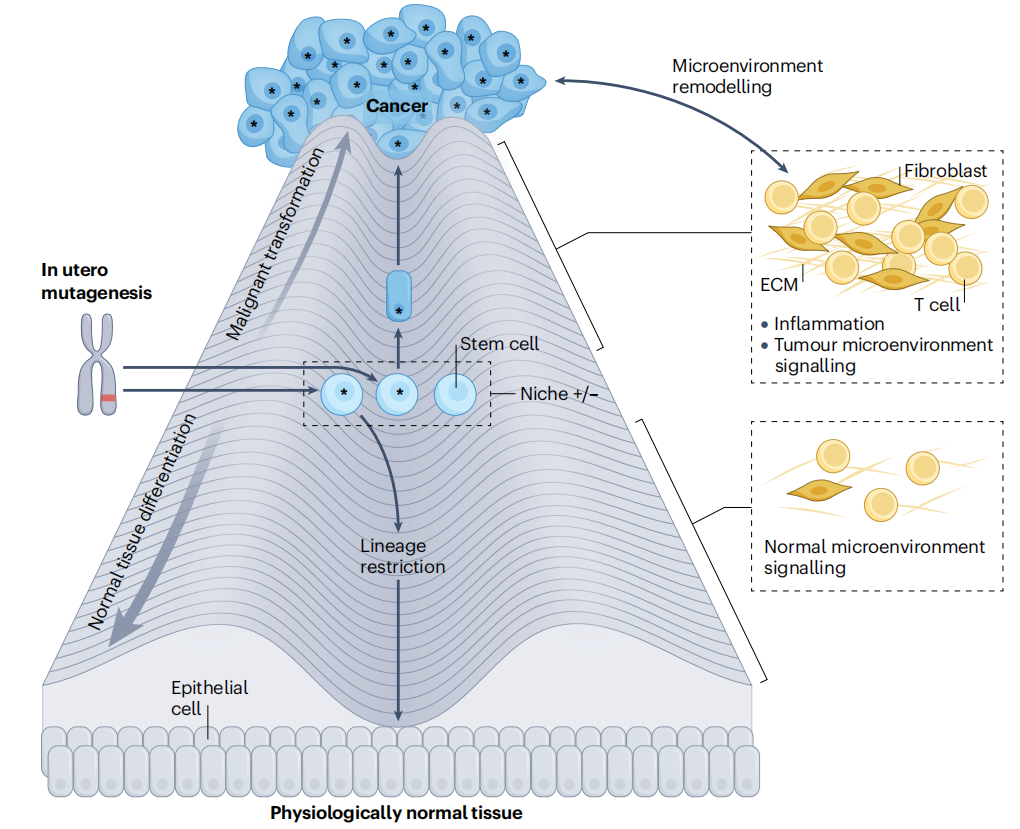
各种癌症起源理论强调了组织转化所需的不同要素。现有证据表明,每个要素都对癌症起源有所贡献,尽管它们的相对重要性可能因细胞环境和癌症类型而异。这些要素包括细胞易感状态、DNA异常和细胞外因素。

三、 细胞内在因素
1、细胞身份
了解癌症起源的一个基本要素是确定每种组织中可以发生恶性转化的细胞的身份。由于许多白血病和实体肿瘤都具有分层组织结构,并由一部分自我更新的细胞亚群维持,因此干细胞(或已获得干细胞样功能的细胞,例如,在组织损伤后)被认为是大多数组织中癌症的起源。
然而,流行病学和功能研究表明,癌症并不仅仅是干细胞随机突变的结果。散发性癌症中特定组织的突变模式以及遗传性癌症综合征中特定器官的肿瘤形成模式表明,细胞对转化的敏感性不同,不同的组织被不同的致癌突变转化。
最清晰的例子是细胞环境如何决定患某些癌症的风险,这些例子可在儿童恶性肿瘤中找到。儿童肿瘤通常在成年人中不常见,因为它们起源于仅存在于胚胎中的祖细胞,并且其中一些无法在小鼠模型中建立,因为它们起源于人类特有的祖细胞。
细胞系谱限制性癌症易感性不仅限于儿童脑肿瘤,而且很可能决定了大多数儿童白血病和实体肿瘤,以及某些成人癌症类型的形成。
结合新生儿干细胞本质上对癌症的抵抗性的证据,强调起始细胞的身份是癌症风险的关键决定因素。这并不排除肿瘤可能是干细胞的随机突变导致的可能性,如“坏运气”理论所阐述的。
2、表观遗传组
在细胞内部因素中,表观基因组是癌症风险的主要决定因素,它在发育和衰老的组织中不断重塑。事实上,调控因子的启动子过甲基化是体外转化细胞的特征性表观遗传变化,而重编程因子的短暂表达驱动转基因小鼠中DNA甲基化和肿瘤发生的全局变化。
至少有两种广泛类型的表观遗传变化会影响细胞状态和癌症易感性。
第一种类型涉及到在发育和衰老过程中发生的染色质和组蛋白标记的正常重塑。在胚胎中,特定的表观基因组构型在时间和位置受限的祖细胞中准备形成多样化的后代细胞,这些细胞分布在每个器官的每个解剖环境中。与年龄相关的表观基因组重塑也可能导致老龄化期间癌症风险增加。在正常组织中,DNA甲基化的变化与年龄强烈相关。衰老造血干细胞的表观遗传变化强化了自我更新能力,阻碍了分化,形成了易于转化的基因组。
第二组包括组蛋白和表观遗传调控因子的突变,以及肿瘤抑制基因的转录沉默。组蛋白经常发生的突变改变了神经胶质瘤、肉瘤和淋巴瘤内的表观基因组模式,从而破坏了基本的DNA模板相关过程,包括基因转录和DNA损伤修复。表观遗传修饰因子的突变本身可能创造了一个适合转化的表观遗传状态。关于肿瘤抑制基因的表观遗传沉默,这可能包括模仿大片染色体缺失的抑制染色质广泛区域。
因此,为发育和衰老的组织提供生成和维持组织可塑性的表观遗传重塑,可能会使这些组织有诱导肿瘤发生的风险。
3、DNA突变
从数千个人类癌症中获取的大规模并行测序数据表明,肿瘤平均有四到五个“驱动”突变,并且这种突变负荷随年龄增加而增加。
然而,现在可用的大量序列数据揭示了突变与癌症风险之间一个更为复杂的关系,除了突变和干细胞增殖之外,其他因素很可能决定一个细胞是否易于转化为癌细胞。
大量癌基因突变在生理正常组织中可以被耐受的观察结果进一步支持了这一论点。尽管眼睑的皮肤很少形成癌症,但这种表面上正常的组织中有许多驱动突变的克隆,同样,老化的肺、食管和结肠等常见的癌症发病部位也是如此。这种突变体克隆的积累很可能是老化上皮组织的一种有益甚至是“正常”的特征。食管中这种克隆的出现通过细胞竞争对早期肿瘤进行清除,在保持组织完整性的同时具有抗肿瘤作用。
因此,癌症风险比以前所认识到的要复杂得多:在这个过程中,发育、衰老和受损的干细胞的不断变化决定了它们对转化突变的易感性,这一过程与癌症的组织结构域和基态理论相一致。这并不意味着撑持“坏运气”理论的观察是错误的,因为干细胞的增殖能力可能与其身份的其他方面密切相关。
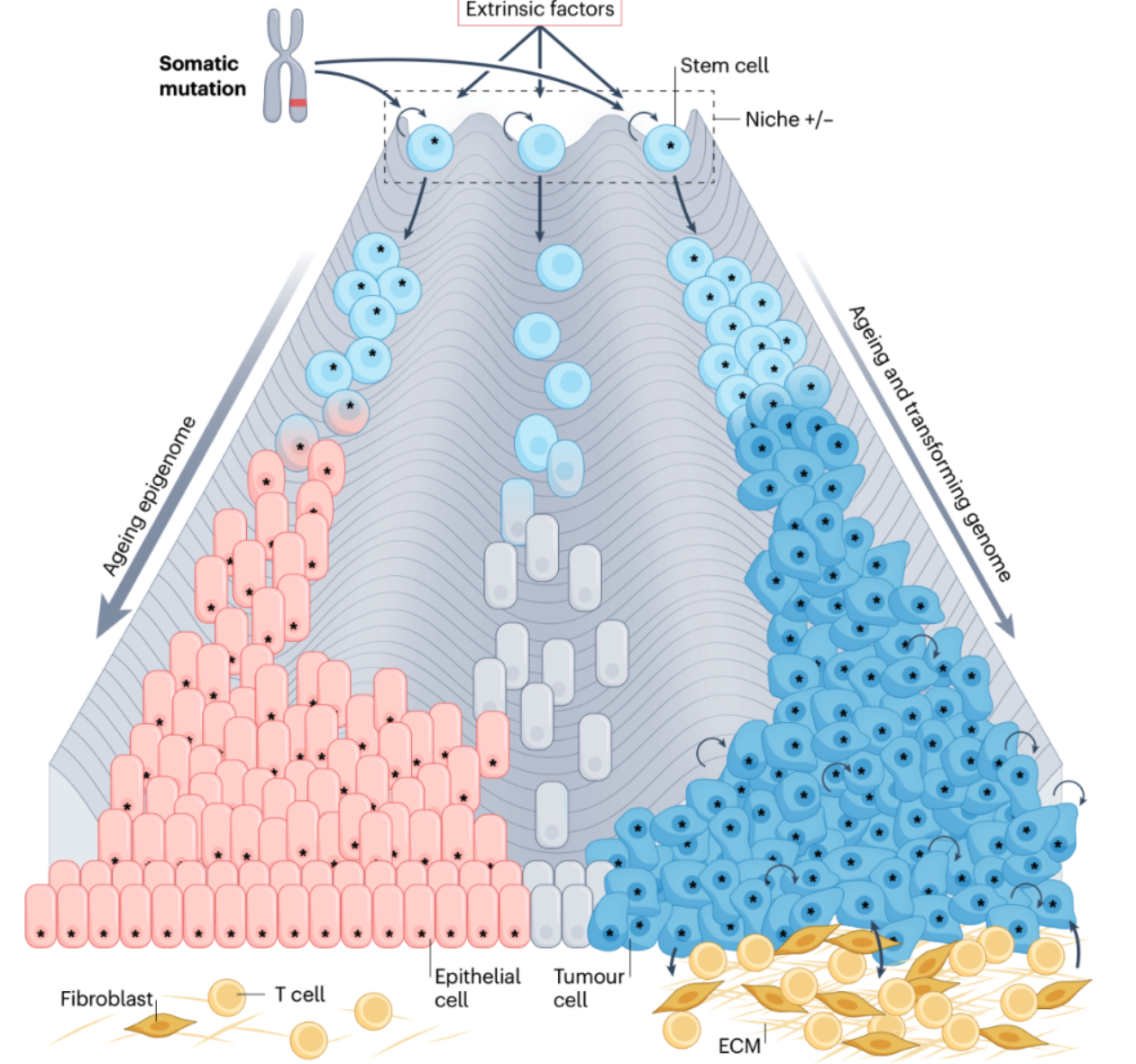
四、细胞外在因素
1、肿瘤微环境
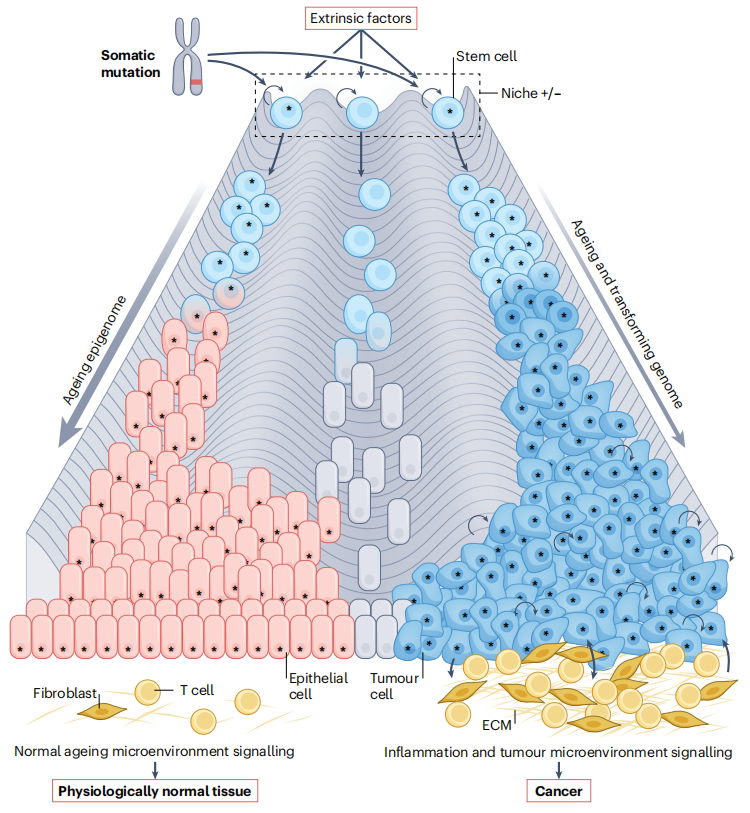
由于干细胞或已经获得自我更新能力的细胞很可能是许多癌症的起源细胞,因此特定的微环境可能是癌症风险的重要调节因素。
微环境可能抑制干细胞转化。包裹着干细胞微环境的细胞外基质(ECM)中的胶原蛋白、蛋白聚糖和糖蛋白的平衡限制了它们的转化。肿瘤间质与恶性细胞之间的相互作用可以重塑ECM,决定癌症是否进展。因此,胚胎和新生儿干细胞对癌症的相对抵抗力可能涉及细胞内外特性之间复杂的相互作用。
监测并清除组织中的病变和感染细胞的免疫细胞,也是癌症风险的重要调节因子。这一观点得到了以下证据支持:免疫抑制患者癌症的发病率增加;侵袭性癌症具有特定免疫细胞亚群浸润;缺乏细胞毒性CD8+、辅助1型CD4+ T(T H 1)细胞和/或自然杀伤细胞的小鼠更易发展肿瘤;通过激活免疫系统杀伤癌细胞的治疗方法取得了成功。研究表明,肠道、卵巢和乳腺的成年干细胞会被活化的T细胞清除,而其他组织中的静止干细胞则抵抗T细胞杀伤。这似乎是静止干细胞的内在特性,其下调抗原呈递机制,而当干细胞重新进入细胞周期时,这种特性会逆转。
因此,转化细胞与其微环境之间的通讯很可能调节表观遗传激活和突变干细胞生成癌症的能力。这包括与癌症可能破坏和/或创造的微环境之间的复杂关系,以及与宿主免疫系统的相互作用。
2、感染与微生物
侵袭组织的微生物被认为是癌症风险的重要外在决定因素。幽门螺杆菌是与感染相关的最常见的癌症诱因,其他四种最常见诱发因素是病毒,包括人乳头瘤病毒(HPV)、乙型肝炎病毒(HBV)、丙型肝炎病毒和EB病毒。这些感染可以创建一个易于转化的表观基因组,引发基因组不稳定导致致癌突变,或者重塑微环境以促进癌症形成。
HBV通过诱导宿主基因组不稳定和病毒整合后的表观基因组重塑,激活癌症相关信号通路,并诱导慢性炎症,改变免疫微环境,促进肝细胞癌发生。EB病毒是首个分离出的人类肿瘤病毒,重塑宿主细胞基因组,甲基化和下调肿瘤抑制基因。HPV编码多种蛋白,尤其是E6和E7,这些蛋白降解或干扰肿瘤抑制蛋白的功能。
对人类癌症的下一代测序进一步揭示了病毒介导的转化机制。除了导致传染病的细菌和病毒外,越来越多的证据表明共生微生物(总称为微生物群)影响癌症风险。这一点在肠道菌群中得到了最有力的证明。在考虑癌症起源时,确定组织中所有细胞or只有罕见的亚群细胞(例如干细胞)容易受到共生和/或感染介导的转化是很重要的。
3、突变原
大规模并行测序不仅确定了癌症中发生突变的基因及其频率,而且还能将这些突变划分为40多个特定的突变,这可能是由不同突变过程引起的。其中包括与化疗药物、紫外线(UV)照射、职业致癌物质或内源性酶致癌突变相关的单碱基替代的突变。这些突变可以用来预测特定癌症类型中可能的致癌物质。
证据显示,其中两个被称为“钟表样”的突变在从受精卵到癌细胞的整个生命过程中持续积累。这种突变的必然性与癌症起源的“坏运气”理论一致。但是,“钟表样”的突变并不一定通过终身干细胞增殖来传播。它们在不同癌症类型中的发生率差异明显,并不总是与终身增殖能力相关。
在发育中的神经系统中,两种不同的胚胎性肿瘤分别是这些突变发生率最高(神经母细胞瘤)和最低(髓母细胞瘤)的例子。因此,至少在某些情况下,可能存在与增殖无关的替代机制来支撑这些突变的产生。
突变原对癌症风险的影响也可以被细胞的基态所改变。干细胞的内在特性,包括基因组稳定性、DNA修复和细胞死亡途径,可能会改变外源因素对癌症风险的最终影响。
五、 癌症风险因素的汇聚
特定细胞在特定位置、特定时间脱离其正常谱系产生恶性组织的可能性很可能取决于特定背景中细胞内在和外在风险因素的汇聚。
这个过程通过适应性表观遗传、可塑的细胞状态实现,这些细胞状态在进化过程中发展出来,以支持正常发育和衰老过程。这种易感性可能表现为现有的或获得的自我更新。通过酶、感染源、化学物质或物理突变原获得的DNA突变呈现出异常多样但可预测的模式,这些突变对自我更新能力进行了强化和破坏。细胞在向恶性状态演变并与其周围微环境之间的通讯重塑推动了肿瘤的进展。
1、细胞内外风险因素的相互作用
重新分化是组织损伤反应的关键特征。虽然在不同的组织中重新分化可以采取不同的形式,但它的特点是细胞可塑性的显著变化。重新分化甚至可能涉及到在正常组织中看不到的新细胞类型的出现。重新分化对于通过具有干细胞样性质的细胞群的扩张修复受损组织非常重要;但它也带来了增加转化机会的风险。
微环境的变化也可能促进这种癌症风险因素的“完美风暴”。在肺部,只有免疫系统功能正常的动物中,组织损伤会增加癌症风险。表观遗传模式的变化可能影响细胞亚群在组织中的位置和行为。尽管有突变原,肝细胞在破坏性创伤后没有导致肝细胞癌发生,这可能与它们与其他细胞相互作用的方式有关,例如肝星状细胞和再生细胞的活化。
2、重塑细胞身份和状态
大多数转化癌细胞与其正常对应物之间存在差异。这可能反映了细胞内和细胞外风险因素的复杂汇聚,导致了正常细胞在癌症微环境中的不同反应。
在许多癌症中,可能存在多个独特的细胞状态。在白血病和淋巴瘤中,多克隆病变通常是可见的。在颅咽管神经胶质瘤中,可能存在多种成熟和幼稚神经系统细胞类型。在乳腺和前列腺癌症中,可能同时存在多种细胞状态,这些状态可能相互作用,以支持肿瘤的进展。
这种差异可能代表了肿瘤内癌细胞群的组织结构、功能和化学异质性,或者反映了它们在微环境中的多样性和变化。
3、肿瘤演变的持续监测
研究表明,肿瘤的进展与组织可塑性相关。肿瘤中的细胞群可能根据它们在组织中的位置和环境而发生演变。
单细胞研究揭示了肿瘤内细胞群的动态变化。肿瘤细胞的空间排列、表型和功能可能发生变化,以适应其在微环境中的位置和变化。
这种动态性可能解释了肿瘤对治疗的适应性。肿瘤中可能存在不同亚群的细胞,这些细胞对治疗具有不同的敏感性和抵抗性。治疗可能导致一些亚群的消失,但留下了其他更具抵抗力的亚群。因此,单细胞研究提供了更好地理解肿瘤进展和治疗反应的机会。
最后,肿瘤演变的持续监测可以指导个体化治疗的发展。通过监测肿瘤内细胞群的动态变化,可以更好地了解肿瘤对治疗的反应,并开发更有效的治疗策略。
结论
肿瘤的起源是一个复杂的过程,涉及多个细胞内外因素的相互作用。肿瘤的发生取决于干细胞或已获得自我更新能力的细胞的转化,以及其与微环境之间的相互作用。这些相互作用可能包括细胞的遗传和表观遗传状态的改变,以及微环境中的化学、物理和生物学变化。肿瘤的演变是一个动态过程,涉及肿瘤细胞群的动态变化和适应。通过了解这些相互作用,我们可以更好地理解肿瘤的发生和发展,并开发更有效的治疗策略。
参考文献:
Jassim A, Rahrmann EP, Simons BD, Gilbertson RJ. Cancers make their own luck: theories of cancer origins. Nat Rev Cancer. 2023 Jul 24. doi: 10.1038/s41568-023-00602-5.


