复旦大学王作云、梁春敏团队STTT:发现表观调控基因CBX4在肺腺癌增殖和进展中的调控新机制
时间:2023-09-19 11:07:33 热度:37.1℃ 作者:网络
肿瘤的发生仍然是现代癌症生物学中最重要的问题之一。表观遗传的变化,包括DNA甲基化、染色质修饰、核小体定位和非编码RNA的改变,均可能导致基因功能改变和细胞转化为肿瘤[1]。在肺癌,结肠癌和胰腺癌等多种癌症中都存在致癌Kras突变,阐明基因的功能改变如何导致肿瘤发生,并寻找可抑制肿瘤发生的药物靶点,尝试开发针对KrasG12D的治疗新策略具有重要的临床意义[2]。
2023年9月12日,复旦大学基础医学院人体解剖与组织胚胎学系王作云和梁春敏团队于《Signal Transduction and Targeted Therapy》杂志在线发表了题为“CBX4 deletion promotes tumorigenesis under KrasG12D background by inducing genomic instability”的工作。该研究揭示了PRC1家族重要成员CBX4的缺失会影响基因组稳定性,并在KrasG12D突变背景下通过调节P15,P16等凋亡相关基因的表达,使大部分细胞在初始阶段凋亡,而存活细胞的多种肿瘤相关基因和信号通路改变,最终诱导肿瘤产生的现象。该研究为未来肺腺癌相关精准靶向治疗的研究提供了新的线索。
CBX4是一种参与染色质修饰和基因表达调控的蛋白质,属于多梳抑制复合物1(PRC1)的一个组成部分[3]。PRC1是一种能够在染色质上添加特定化学修饰从而影响基因表达的复合物,它在细胞增殖、分化、衰老、凋亡等多个生理过程中发挥重要作用[4]。虽然CBX4已在多种类型的癌症中进行了广泛的研究,但CBX4在不同类型的组织和恶性肿瘤中具有不同甚至相反的功能,而且其在肺腺癌中的作用也尚不清楚[5, 6]。
为了探索CBX4在肺腺癌增殖和进展中的作用,复旦大学基础医学院研究人员采用LSL-KrasG12D激活诱导肺腺癌小鼠模型,并发现CBX4缺失的LSL-KrasG12D突变小鼠更易出现肺腺癌,同时肿瘤体积更大、增殖能力更强、细胞凋亡更少(图1)。然而后续的体外验证实验发现:在使用Adeno-Cre病毒处理最初几天内,超50%的Primary Cbx4-/-,KrasG12D呈现细胞凋亡。而长期的体外成克隆实验表明Cbx4-/-,KrasG12D细胞的集落形成能力增强(图2a、b)。这可能意味着Cbx4会在长期培养中产生与短期培养相反的效应。之后的实验也证明的确存在一小部分细胞在长期培养中存活,即Selected Cbx4-/-, KrasG12D 细胞(图2c)。这些Selected Cbx4-/-, KrasG12D 细胞相较KrasG12D细胞或Primary Cbx4-/-, KrasG12D 细胞有更强的增殖和转化能力(图 2c-f)。
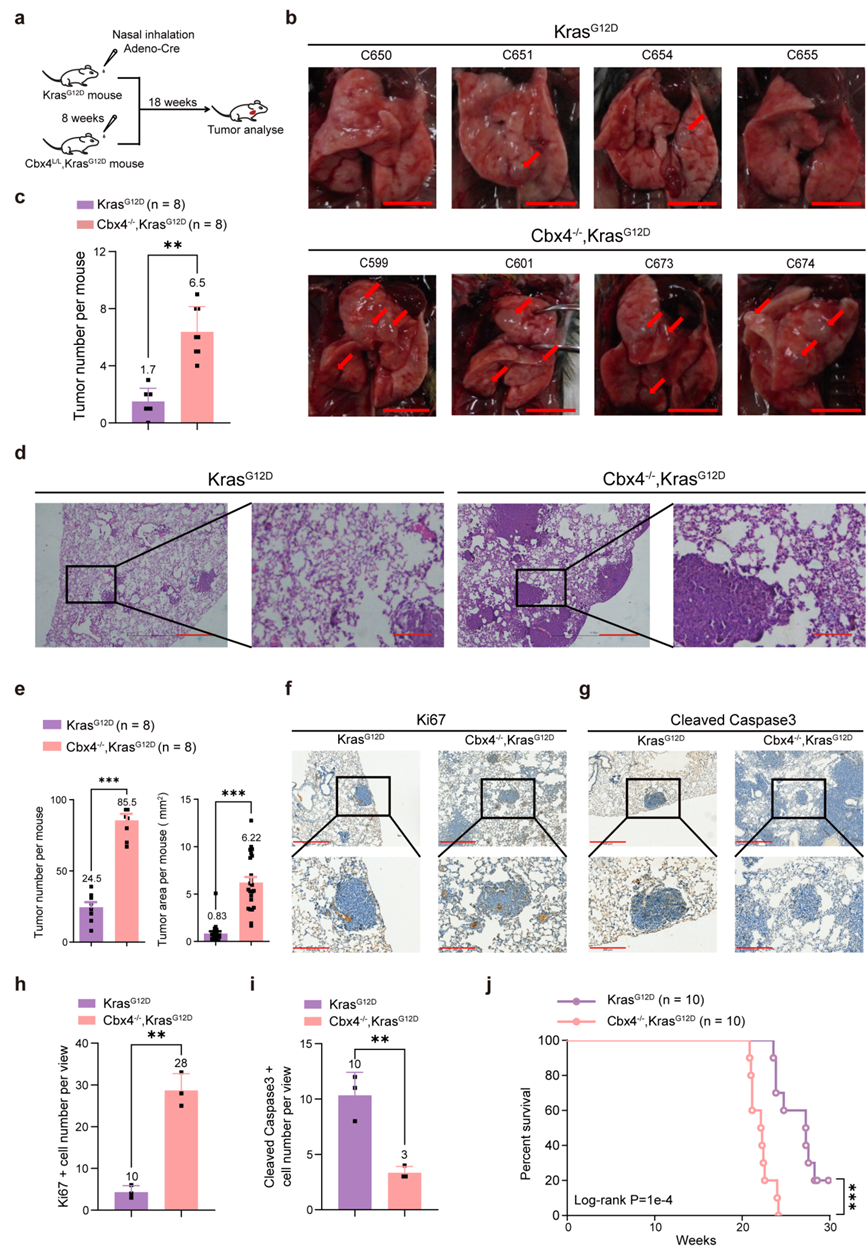
图1.CBX4在KrasG12D突变背景下促进肺腺癌的进展,较单纯KrasG12D突变小鼠生存周期更差。 图源:Chen et al., Signal Transduction and Targeted Therapy. 2023)
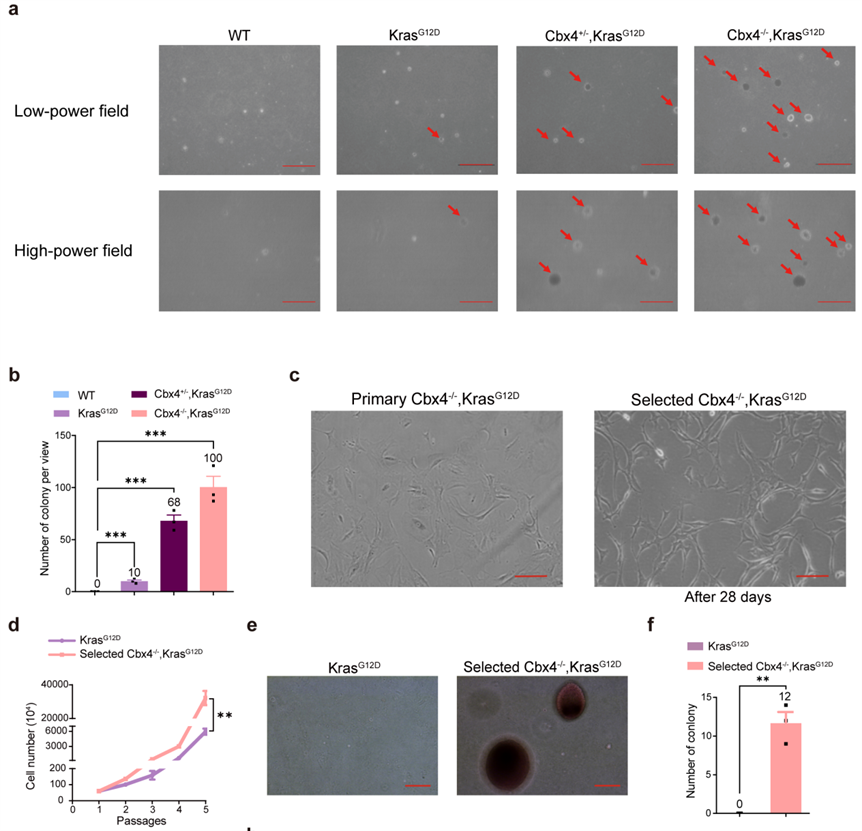
图2 CBX4的缺失在长期细胞培养后最终促进了细胞增殖和转化能力。
(图源:Chen et al., Signal Transduction and Targeted Therapy. 2023)
流式分选和核型分析结果显示Selected Cbx4-/-, KrasG12D 细胞存在更多的非整倍体染色体的细胞(图3a-c)。进一步的RNA-seq结果和机制研究还发现CBX4缺失会导致基因组不稳定性升高,在初始阶段引起P15、P16的上调并诱发凋亡相关基因高表达,而导致大部分细胞走向死亡(图3d-g和图4a-d)。只有少数细胞因Hippo信号通路在内的多种信号通路发生改变,从而获得更强的增殖和转化能力,而这些细胞能够在基因组不稳定的环境中存活,并最终诱导肿瘤发生(图3d-g和图4e-h)。
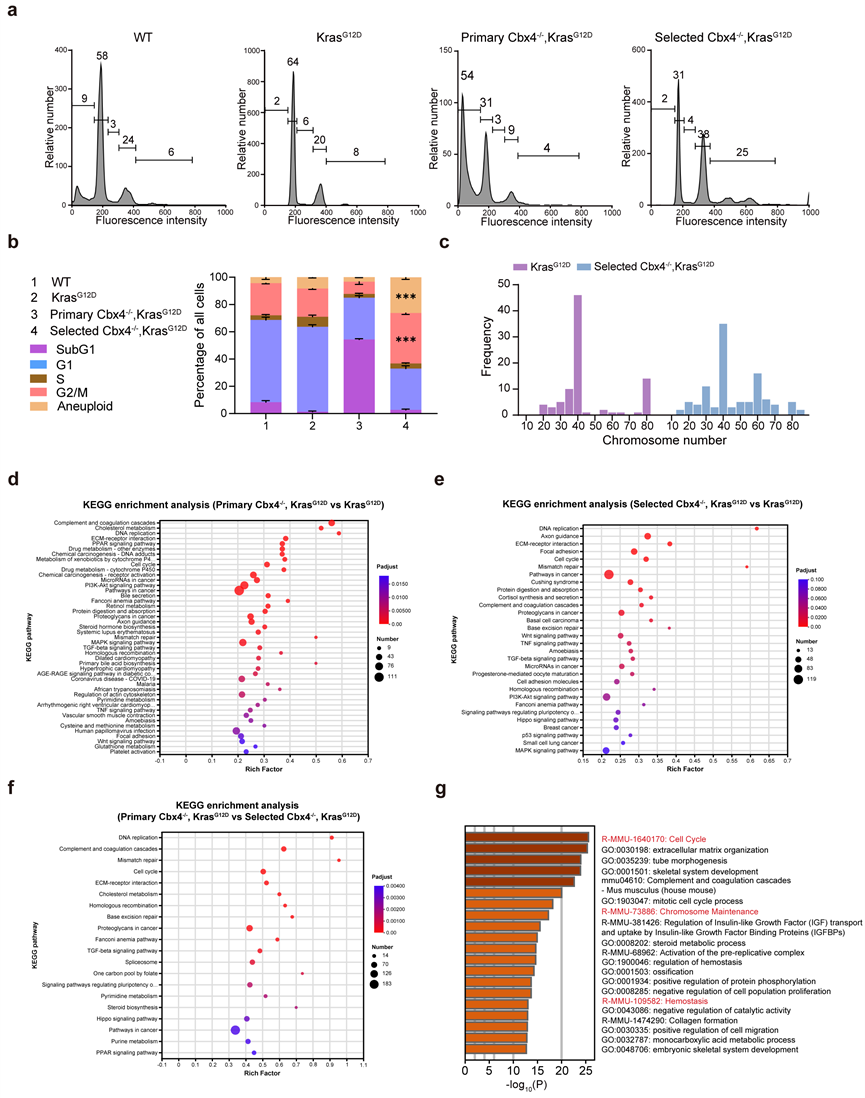
图3 与KrasG12D、Primary Cbx4-/-, KrasG12D细胞相比,Selected Cbx4-/-, KrasG12D基因组稳定性更差。 (图源:Chen et al., Signal Transduction and Targeted Therapy. 2023)
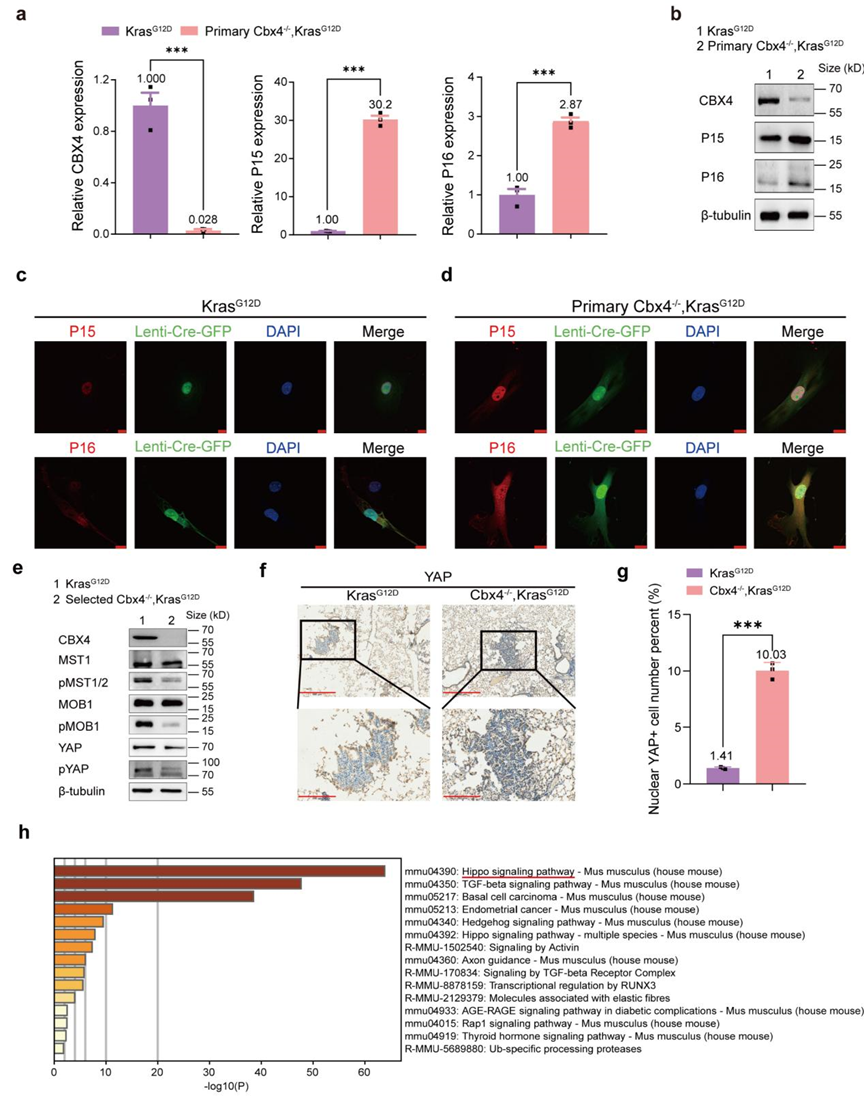
图4 CBX4的缺失在初期上调了P15、P16、凋亡相关基因的表达,并影响包括Hippo信号通路在内的多种信号通路最终促进KrasG12D背景下的肿瘤发生。 (图源:Chen et al., Signal Transduction and Targeted Therapy. 2023)
综上所述,研究人员发现在KrasG12D突变背景下,CBX4的缺失会影响染色体的稳定性。染色体不稳定性影响凋亡相关基因的表达,并导致大部分细胞在CBX4缺失的初始阶段发生凋亡。CBX4的缺失还会改变多种肿瘤相关基因和Hippo信号通路在内的多种信号通路,使少数获得了更强增殖与转化能力的细胞从基因组不稳定中存活下来,最终诱导肿瘤发生(图5)。该研究提供了低CBX4水平肺癌发生的可能机制,并为CBX4精准靶向癌症治疗提供了新线索。
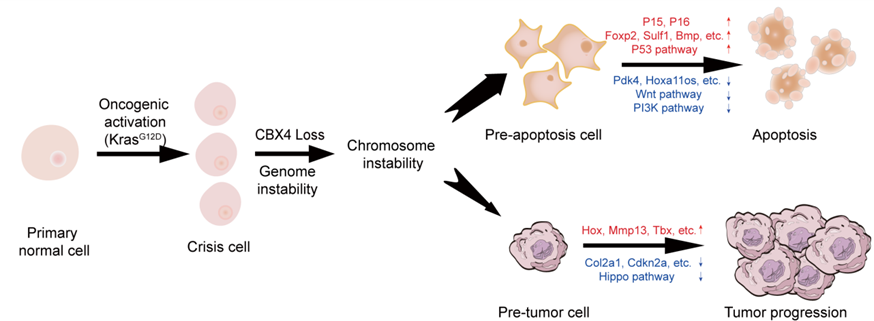
图 5 CBX4缺失在KrasG12D突变背景下促进肺腺癌进展的模式图。
(图源:Chen et al., Signal Transduction and Targeted Therapy. 2023)
复旦大学基础医学院人体解剖与组织胚胎学系王作云青年研究员和梁春敏教授为该论文的共同通讯作者,复旦大学上海医学院2018级临床医学八年制学生陈方桢、博士研究生后武雷和上海交通大学第六人民医院副研究员于祥田副研究员为该论文的共同第一作者。该研究受到国家重点研发计划、国家自然科学基金、上海市自然科学基金等项目资助。该研究特别感谢复旦大学生物医学研究院徐国良院士、上海交通大学生命科学技术学院张雷教授、中国科学院分子细胞科学卓越创新中心季红斌研究员等老师的帮助和支持。
参考文献
[1] Dawson M A, Kouzarides T. Cancer epigenetics: from mechanism to therapy[J]. Cell, 2012,150(1):12-27.
[2] Hofmann M H, Gerlach D, Misale S, et al. Expanding the Reach of Precision Oncology by Drugging All KRAS Mutants[J]. Cancer Discov, 2022,12(4):924-937.
[3] Naqvi A, Rizvi S, Hassan M I. Pan-cancer analysis of Chromobox (CBX) genes for prognostic significance and cancer classification[J]. Biochim Biophys Acta Mol Basis Dis, 2023,1869(1):166561.
[4] Piunti A, Shilatifard A. The roles of Polycomb repressive complexes in mammalian development and cancer[J]. Nat Rev Mol Cell Biol, 2021,22(5):326-345.
[5] Wang Z, Fang Z, Chen G, et al. Chromobox 4 facilitates tumorigenesis of lung adenocarcinoma through the Wnt/β-catenin pathway[J]. Neoplasia, 2021,23(2):222-233.
[6] Li J, Xu Y, Long X D, et al. Cbx4 governs HIF-1α to potentiate angiogenesis of hepatocellular carcinoma by its SUMO E3 ligase activity[J]. Cancer Cell, 2014,25(1):118-131.


