陆翠华教授:慢性萎缩性胃炎的癌变预防及治疗
时间:2024-05-21 15:00:30 热度:37.1℃ 作者:网络
慢性萎缩性胃炎(Chronic Atrophic Gastritis,CAG)是一种常见的消化系统疾病,其主要特征是胃黏膜的萎缩和变薄。研究表明,萎缩性胃炎与胃癌关系密切,有超过90%的肠型胃癌,是萎缩性胃炎发展而来;因此,控制萎缩性胃炎继续进展,是预防胃癌重要的手段。本期“消化界”特邀南通大学附属医院消化内科陆翠华教授介绍“慢性萎缩性胃炎的癌变预防及治疗”。
慢性萎缩性胃炎的癌病预防
自1863年Rudolph Virchow教授提出癌症和慢性炎症的关系以来,炎症与癌症之间的关系已得到广泛认可。慢性持续性炎症被认为是癌症的触发因素之一。众多临床实验证明,炎性肠病、Barrett食管、食管炎症、幽门螺杆菌(Hp)感染以及CAG等,均与相应的癌症有密切关联,即炎癌转化现象。
CAG目前被公认为胃癌的癌前病变。统计数据显示,若患者在5年内被诊断为萎缩性胃炎,其胃癌的年发病率高达0.1%,表明这一病症具有较高的癌变风险。慢性萎缩性胃炎若持续发展,可能通过肠化异型增生转化为肠型胃癌,或因胃泌素增高导致ECL细胞生长和增生异常,进而发展为Ⅰ型胃内癌。
研究显示,CAG患者发生胃癌的风险是正常人群的4.5倍。瑞典一项研究分析了1979年至2011年期间进行的405,172例非恶性胃活检标本,结果显示CAG患者发生胃癌的风险是正常人群的4.5倍。这一风险随着正常黏膜向浅表萎缩、肠化、异型增生的病理过程逐渐升高。CAG癌变的高危因素则包括Hp感染、年龄增长、长期饮酒、恶性贫血、胃黏膜萎缩程度较高以及伴有肠化等。
CAG癌变的经典过程是Correa模式,即从正常胃黏膜逐渐发展为浅表性胃炎,再进一步发展为CAG、肠化异型增生,最终可能导致胃癌。一项回顾性研究显示,病程超过10年的CAG患者中,异型增生的发生率高达40%以上。该研究对2001年至2011年间某医院消化内镜中心的234例CAG患者进行了半年、1年、2年、5年和10年的随访。结果表明,CAG随着病程的延长,异型增生的风险逐渐增加。重度异型增生是癌变的标志,其逆转难度极大,而轻中度异型增生的癌变率相对较低,低于20%。因此,CAG的早期诊断、早期干预和定期随访对于胃癌的积极预防具有重要的临床意义。
慢性CAG癌变概述及预防策略
为有效预防慢性CAG癌变,可以通过采取一系列预防措施。首先是定期进行内镜检查,这对于监测CAG的进展和及时发现癌变具有重要意义。同时,消除或减弱攻击因子同样关键,例如控制Hp感染、减少酒精摄入和谨慎使用阿司匹林等药物。此外,增强胃黏膜的防御功能同样重要。还包括补充抗氧化作用的营养元素以及改善不良饮食习惯。长期补充抗氧化剂,如维生素C已被证实能有效预防和阻断慢性CAG的进展,通过清除突变细胞来降低胃癌风险。
定期内镜检查是防止CAG癌变的重要措施,不伴有肠化生或上皮内瘤变的CAG可酌情行内镜和病理随访;活检有中-重度萎缩并伴有肠化生的CAG 1 年左右随访一次;伴有低级别上皮内瘤变并证明此标本并非来于癌旁者,根据内镜和临床情况缩短至每 6 个月左右随访一次;高级别上皮内瘤变需立即确认,证实后行内镜下治疗或手术治疗。对于慢性CAG患者,内镜下可见黏膜红白相间,白色区域随萎缩程度加重而增多,可能呈现地图样花斑样改变或粗颗粒样黏膜。一旦确认高级别上皮内瘤变,需进行内镜治疗或手术治疗以早期干预。
早期胃癌的内镜分型目前多采用日本内镜学会分类法,即根据CAG癌变后的内镜下特点分为Ⅰ型、Ⅱ型和Ⅲ型,Ⅰ型即隆起型,局部病变在胃腔内隆起高度>5mm;Ⅱ型即平坦型,又分为三个亚型,Ⅱa型:浅表隆起型,局部病变隆起高度<5mm;Ⅱb型:局部病变平坦仅有色泽改变;Ⅱc型:局部病变轻度浅凹陷,相当于浅糜烂;Ⅲ型即凹陷型,相当于浅溃疡。此类型常仅侵犯黏膜层,是胃镜下切除的最佳时期。由于病灶微小,病变平坦,极易疏漏。如有局部充血现象,最好完善超声胃镜检查,病灶不超过黏膜肌层时,可行胃镜下黏膜切除术。
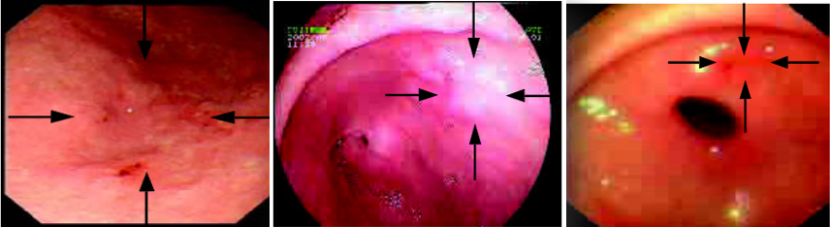
早期胃癌的日本内镜学会分型,图片来自《胃肠镜下常见病形态学诊断与病理(图谱)》
进展期胃癌内镜下采用Borrmann氏分型,BorrmannⅠ型为息肉状隆起型——癌肿呈息肉样明显突出于黏膜表面,向胃腔内生长,边界与周围正常黏膜组织分界清楚;BorrmannⅡ型为局限溃疡型——癌肿中心部为溃疡,周围有明显隆起的环堤,边界与周围的正常黏膜组织分界清楚,无明显浸润现象;Borrmann Ⅲ型为浸润溃疡型——癌肿呈伴有溃疡的浸润型肿块,溃疡边缘界限不清,延入周围黏膜;BorrmannⅣ型为弥漫浸润型——癌肿在胃壁内广泛弥漫性浸润,难于肉眼确认,胃腔扩张度下降,蠕动波消失,即所谓的“皮革胃”。内镜诊断与组织学检查结果也具有良好的相关性,一项纳入2,558例行Hp检查的胃肠道疾病患者旨在评估内镜诊断与组织学检查在诊断CAG方面的一致性和相关性研究结果也与上述结论一致。
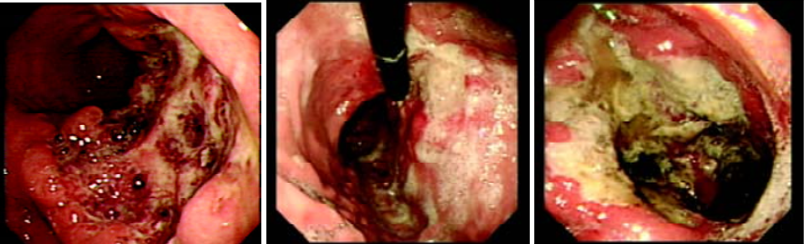
进展期胃癌胃镜下Borrmann 氏分型,图片来自《胃肠镜下常见病形态学诊断与病理(图谱)》
Hp感染对胃黏膜构成显著损害,多项国内外共识意见和指南均强烈推荐根除Hp以显著降低胃癌发生风险。最佳干预时机为胃癌前病变阶段,如萎缩、肠化和上皮瘤变发生前进行根除,可大幅度降低胃癌发生风险。因此,对于此类患者,应尽早进行根除治疗。除了降低胃癌风险,Hp根除后还能显著增加胃萎缩消退率,改善胃黏膜萎缩,从而降低癌变风险。在预防癌变方面,除了消除攻击因子Hp外,增强胃黏膜防御功能同样重要。萎缩性胃炎患者胃黏膜分泌功能大幅下降,增加癌变风险。因此,在胃黏膜保护方面,增加分泌功能同样关键;临床和基础研究表明,长期补充抗氧化剂能有效预防和阻断萎缩性胃炎进展。其机制在于通过体内凋亡途径清除突变细胞,预防胃癌发生和发展。维生素C作为一种优秀的抗氧化剂,能显著提高胃黏膜萎缩消退率,阻断胃癌进展。
在胃癌预防方面,改变饮食习惯同样有效。建议分次饮食,减少高盐食物摄入,增加易消化食物摄入,避免食用辛辣食物和高脂肪食物,如咸鱼等。这些不良饮食习惯可能加重胃黏膜损害,促进萎缩性胃炎向胃癌发展。
慢性CAG癌变后的治疗策略
胃癌的预后与其治疗时机紧密相关。若能在早期发现并通过内镜或手术治疗,其5年生存率可超过90%。然而,若病情进展至晚期,接受了以外科手术为主的综合治疗后5年生存率仍低于30%。因此,强调早期发现与治疗对于改善患者预后具有重要意义。
对于早期胃癌患者,内镜下切除是首选的治疗方法。同时,根据患者需求,外科手术也是一种治疗选择。对于高危人群,进行胃癌筛查有助于早期识别胃癌,从而及时进行内镜治疗。
内镜黏膜下剥离术(ESD)已成为治疗消化道表浅肿瘤的标准化手段,得到了广泛认可。对于分化型肿瘤,若其大小≤2cm,ESD是绝对适应症;若>2cm但仍为分化型,则属于相对适应症。然而,ESD治疗也存在一定的并发症风险,如出血、穿孔和狭窄等。因此,在出现并发症时,需要及时采取内镜下的补救措施,如药物使用、扩张和机械开等。
对于高危患者,在质子泵抑制剂(PPI)治疗基础上,加用胃黏膜保护剂可更有效地预防ESD术后的并发症。对于ESD伴有延迟愈合及Hp感染的患者,胃黏膜保护剂在提高愈合率和Hp根除率方面也具有重要的临床价值。
值得一提的是,聚普瑞锌作为一种胃黏膜保护剂,自1994年在日本上市后已有近30年的临床经验。多项临床研究证实其在保护胃黏膜、促进愈合以及提高Hp根除率方面的疗效和安全性。例如,一项临床研究显示,兰索拉唑联合聚普瑞锌在黏膜愈合方面优于单用兰索拉唑,可显著增加黏膜的愈合质量;在中国11个城市进行了的一项随机、平行、开放标签、对照、前瞻性的多中心临床研究则对比了聚普瑞锌联合克拉霉素的三联疗法在治疗Hp相关性胃炎的疗效,结果表明聚普瑞锌联合克拉霉素的三联疗法在Hp根除率方面优于单纯的三联疗法。
总结
CAG作为胃癌的癌前病变,预防其癌变具有重要意义。对于CAG癌变的治疗,应尽早进行。ESD作为治疗消化道表浅肿瘤的重要手段,联合胃黏膜保护剂如聚普瑞锌,可增强胃黏膜的防御和修复作用,有效逆转CAG的癌变过程。同时,联合PPI治疗可减少胃癌ESD术后的并发症。聚普瑞锌联合常规三联疗法可显著提高Hp的根除率达19.7%,从而降低胃癌的发生风险。临床基础实验显示,聚普瑞锌对CAG胃泌素和胃蛋白酶的降低有升高作用。


