EHA 2024:血液系统肿瘤重点研究摘要速览!
时间:2024-05-21 15:00:36 热度:37.1℃ 作者:网络
前言
2024年欧洲血液学协会(EHA)年会将于中欧夏令时6月13日至16日在西班牙马德里召开,届时将汇集全球专家学者,共同讨论血液学领域前沿诊疗技术和临床实践成果。
目前EHA官网在线公布了部分入选研究的摘要信息(最新突破性摘要[LBA]、全体会议摘要、即将在2024 ASCO年会上发布的摘要暂未公布),小编第一时间整理了血液系统肿瘤药物治疗重点研究,包括的报告类型有:口头汇报(Oral,S)、壁报(Poster,P),以飨读者。
B细胞淋巴瘤
一线治疗
摘要号:S239
epcoritamab+维泊妥珠单抗、利妥昔单抗、环磷酰胺、多柔比星和泼尼松(pola-R-CHP)在新诊断DLBCL患者的所有亚组中均显示出高ORR和CR率
题目:来自皮下注射epcoritamab+维泊妥珠单抗、利妥昔单抗、环磷酰胺、多柔比星和泼尼松(pola-R-CHP)一线治疗弥漫大B细胞淋巴瘤(DLBCL)的首个数据:EPCORE NHL-5
报告人:David Lavie
背景
与作为DLBCL的一线(1L)治疗(tx)的利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松(R-CHOP)相比,pola-R-CHP提高了缓解率和PFS。然而,在DLBCL的1L治疗中仍有一个未被满足的需求,即改善预后,达到治愈。epcoritamab(epcor)是一种皮下注射的CD3xCD20双特异性抗体,在联合R-CHOP 1L治疗DLBCL中已经证明了其安全性和有效性,并在美国、欧洲、日本和其他地区被批准单药用于经过≥2线治疗后复发或难治DLBCL的全身治疗。epcor与不同作用机制(MOA)的抗肿瘤药物联合使用可提高患者(pts)的临床获益。在此报告了EPCORE NHL-5(NCT05283720)Ⅰb/Ⅱ期研究中epcor + pola-R-CHP治疗新诊断的DLBCL患者的安全性和抗肿瘤活性。
方法
EPCORE NHL-5是一项正在进行的、多臂、开放标签的全球研究。在第3组中,患者入选标准包括新诊断的CD20+ DLBCL(非特指DLBCL、高级别B细胞淋巴瘤[HGBL]伴有MYC和BCL-2和/或BCL-6易位[双/三打击]或滤泡性淋巴瘤[FL] 3B级),ECOG PS 0-2,IPI评分2-5。所有患者接受epcor + pola-R-CHP治疗直至6个周期(C),每周期21天,然后接受epcor单药治疗2个周期。epcor在C1以递增剂量给药,随后在C2-4 QW和C5-8 Q3W分别给予全剂量(48 mg)。另外缓解CRS的药物包括泼尼松(n=17)或地塞米松(n=20)。C1-6期间,在接受多柔比星、环磷酰胺和pola治疗后1-2天给予G-CSF或聚乙二醇G-CSF。允许CNS预防性治疗。关键终点包括DLT、研究者评估的缓解(ORR/CR)、至缓解时间(TTR)和安全性。
结果
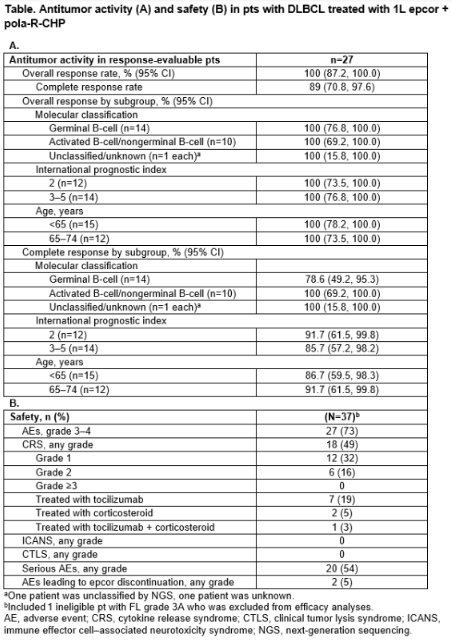
截至2023年11月28日,37例患者接受了epcor + pola-R-CHP治疗:51%为女性;中位年龄64岁;DLBCL,n=34;HGBL,n=1;3B级FL,n=1。未观察到DLT。在27例可评估缓解的患者中,ORR为100%,89%的患者达到CR(n=24;表1)。中位随访时间为5.8个月(95% CI:4.8,8.6)。中位TTR和达到CR的时间分别为2.7个月(范围:1.3-3.3)和2.8个月(范围:1.3-6.7)。总结了治疗期间出现的不良事件(TEAE)(表1)。2例(5%)患者因AE而停用epcor;3例(8%)患者因AE而停用pola-R-CHP。最常见的3-4级AE是中性粒细胞减少症(65%)、贫血(14%)和白细胞减少症(11%)。1例患者发生与epcor无关的致命性TEAE(感染性休克)。CRS为低级别(32%为1级,16%为2级),主要发生在第一次全剂量后(C1D15)。6/17例(35%;3例为2级)发生CRS事件和12/20例(60%;3例为2级)分别接受地塞米松或泼尼松预防性治疗。所有CRS均得到缓解,中位缓解时间为2天(范围:1-6)。未观察到ICANS。1例患者患有G4噬血细胞性淋巴组织细胞增多症(HLH),该疾病得以缓解,并且完成了治疗。生物标志物分析显示药效学特征与epcor的MOA一致,包括第一次全剂量后可预测的细胞因子水平升高(IFN-γ、IL-2、IL-6)。初步的药代动力学特征和epcor暴露与其他联合治疗和单药治疗具有可比性。随访正在进行中。之后将提供额外的数据。
表1 疗效(A)和安全性(B)结果
结论
epcor + pola-R-CHP在新诊断DLBCL的所有亚组中均显示出高ORR和CR率,并且具有可控的安全性。在这种情况下,与pola-R-CHP方案和其他治疗方案相比,epcor + pola-R-CHP方案数据更具有优势,并支持进一步研究该联合方案。之后将展示包括MRD在内的其他数据。
摘要号:P1171
泽贝妥单抗联合CHOP方案治疗CD20阳性初治DLBCL中国患者的ORR非劣效于利妥昔单抗联合CHOP方案,但其具有较高的CR率、较低的疾病进展和死亡风险趋势,尤其是在GCB亚型中
题目:比较泽贝妥单抗+CHOP与利妥昔单抗+CHOP治疗新诊断CD20阳性弥漫大B细胞淋巴瘤患者:一项Ⅲ期试验
报告人:李志铭 教授(中山大学肿瘤防治中心)
背景
泽贝妥单抗是一种重组人鼠嵌合抗CD20单抗,结合不同的CD20表位,与利妥昔单抗相比,可产生更强的抗体依赖性细胞毒性作用。目前的试验是为了对比泽贝妥单抗联合CHOP(Hi-CHOP)与利妥昔单抗联合CHOP(R-CHOP)在未经治疗的CD20阳性弥漫大B细胞淋巴瘤患者(DLBCL)中的疗效和安全性。
方法
符合入组条件的患者以2:1的比例随机分配,接受6个周期375 mg/m2 泽贝妥单抗或利妥昔单抗联合常规CHOP化疗治疗。以C6D50时的客观缓解率(ORR)为主要终点,建立了10%的非劣效性界值。次要终点包括缓解持续时间(DOR)、无进展生存期(PFS)、无事件生存期(EFS)、总生存期(OS)、由盲法独立审查委员会(BIRC)评估的C6D50时的完全缓解率(CR)以及安全性结果。
结果
在被随机分至Hi-CHOP组(n=327)和R-CHOP组(n=156)的483例患者中,有423例患者(Hi-CHOP组287例,R-CHOP组136例)完成了C6D50评估。在全分析集(FAS,n=483)和符合方案集(PPS,n=407)中,在C6D50时,Hi-CHOP组和R-CHOP组的ORR分别为83.5% vs. 81.4%和95.3% vs. 93.7%。非劣效性被确认为组间差异的双侧95% CI下限分别为-5.2%和-3.3%;在FAS和PPS中均>-10%。在PPS中,Hi-CHOP组患者的CR率显著高于对照组(85.66% vs. 77.34%,P=0.038);在FAS中,两组患者的CR率无显著差异(75.2% vs. 67.9%,P=0.092)。随访29.4个月(中位)后,Hi-CHOP组患者在DOR(HR 0.74,P=0.173)、PFS(HR 0.67,P=0.057)、EFS(HR 0.90,P=0.517)和OS(HR 0.60,P=0.059)方面有轻微优势。值得注意的是,生发中心B细胞样(GCB)亚型患者在C6D50时的ORR和CR率Hi-CHOP组均显著高于对照组(P=0.034,P=0.038)。此外,接受Hi-CHOP治疗的GCB亚型患者在EFS(HR 0.51;95% CI:0.27-1.00;P=0.046)和OS(HR 0.25;95% CI:0.07-0.85;P=0.014)方面的改善具有统计学意义。治疗期间出现的不良事件的发生率在各组间具有可比性(所有P>0.05)。Hi-CHOP组输液相关反应发生率更高(32.1% vs. 19.9%,P=0.006),严重程度均为1-3级(主要为1/2级)。
结论
泽贝妥单抗(375 mg/m2)联合CHOP方案治疗CD20阳性初治DLBCL中国患者的ORR非劣效于利妥昔单抗联合CHOP方案,但其具有较高的CR率、较低的疾病进展和死亡风险趋势,尤其是在GCB亚型中。并且该方案耐受性良好。
巩固治疗
摘要号:S236
与历史基准相比,阿替利珠单抗巩固治疗对高危DLBCL患者DFS有显著改善
题目:阿替利珠单抗巩固治疗高危弥漫大B细胞淋巴瘤的可行性和临床疗效:HOVON 151的最终分析
报告人:Marcel Nijland
背景
高危弥漫大B细胞淋巴瘤(DLBCL)患者在接受利妥昔单抗、环磷酰胺、多柔比星、长春新碱和泼尼松(R-CHOP)治疗后达到完全代谢缓解(CMR)的2年无病生存率(DFS)为78%。检查点抑制剂在复发或难治(R/R)DLBCL中产生了适度的反应。然而,在一线R-CHOP联合阿替利珠单抗(一种靶向PD-L1的人源化免疫球蛋白G1单克隆抗体)显示出令人鼓舞的疗效。我们假设在R-CHOP后使用阿替利珠单抗进行巩固治疗可以消除CMR患者的微小残留病灶。该研究的目的是通过一年的阿替利珠单抗巩固治疗,改善经R-CHOP治疗后达到CMR的高危DLBCL患者的DFS。
方法
在这项单臂开放标签的Ⅱ期研究中,年龄18-75岁、国际预后指数评分≥3、在接受6-8个R-CHOP周期治疗后达到CMR的DLBCL患者符合入组条件。既往存在自身免疫性疾病或中枢神经系统(CNS)受累的患者不符合入组条件。患者每21天接受静脉注射固定剂量1200 mg阿替利珠单抗,持续18个周期或直至疾病进展。主要终点为DFS。目标是将2年DFS从历史≤79%(El-Galaly TC,JCO2015)提高到86%或更高。为了验证这一假设,总共需要109例患者(单侧α为0.05和统计功效为0.9)。次要研究终点包括总生存期(OS)和安全性。每6个月进行一次CT扫描,持续2年。安全性评估遵循不良事件通用术语标准(CTCAE)5.0版本。
结果
从2019年1月至2022年1月,共109例患者入组。诊断时的中位年龄为64岁(四分位数间距(IQR)54-70),男性64例(59%)。87例(80%)患者为Ⅳ期疾病,69例(63%)患者为中高危。经中心病理检查,106例(97%)患者确诊为DLBCL,2例(2%)患者为惰性滤泡性淋巴瘤,1例(1%)为结节性淋巴细胞为主型霍奇金淋巴瘤。大多数(95%)患者接受了6个周期的R-CHOP21治疗,36%的患者接受了CNS预防性治疗。接受阿替利珠单抗治疗的平均周期数为14(范围1-18)。共有64%(70例)患者完成了全部疗程。停用阿替利珠单抗的原因包括不良事件(17%)、复发(10%)、死亡(2%)和患者自行决定(6%)。存活患者的中位随访时间为36.4个月(范围0.7-59.8个月)。共观察到15例(14%)患者复发。至复发的中位时间为9.2个月(范围0.4-47.1)。在巩固治疗早期阶段,有2例患者在“避难所部位”(脑和眼)复发。2年DFS为87.9%(90% CI 81.5-92.1),达到了研究的主要终点(图1)。整个研究人群的2年OS率为96.3%(90% CI 91.7-98.3)。在观察到的15例复发患者中,研究中记录的4例死亡只有2例是由于淋巴瘤。另外2例死亡与淋巴瘤无关(1例由于COVID-19,1例未知)。在复发的患者中,13例接受了挽救化疗,其中10例(77%)达到了第二次CMR。这10例患者中只有1例经历了第二次复发并随后接受了CAR-T治疗。109例患者中,86例(79%)至少发生一起不良事件(AE)。共报告了257起AE:2级193起(75%),3级53起(21%),4级7起(3%)。最常见的AE为感染(n=65,25%)、肌肉骨骼和结缔组织疾病(n=24,9%)和神经系统疾病(n=22,9%)。特别关注不良事件(AESI)为22起:1/2级17起(77%),3/4级5起(23%)。最常见的AESI包括内分泌病变(n=10,45%)和眼毒性(n=3,14%)。AESI的中位持续时间为2.7个月(IQR为0.7-11.3)。18例(82%)患者AESI已解决。
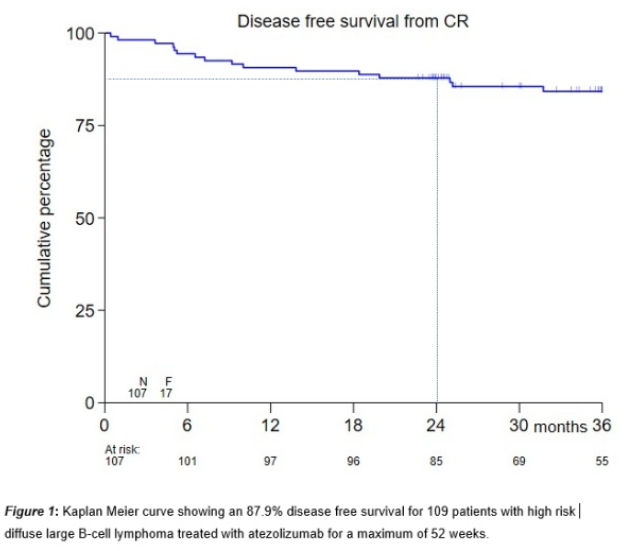
图1 达到CR后的DFS结果
结论
与历史基准相比,阿替利珠单抗巩固治疗对高危DLBCL患者DFS有显著改善。96.3%的2年OS率是在高危DLBCL患者中观察到的最高的结果之一,大多数患者复发时为化疗敏感性疾病。
T细胞淋巴瘤
R/R患者
摘要号:S247
valemetostat单药在R/R PTCL患者中表现出良好的疗效以及耐受性
题目:valemetostat单药治疗复发或难治外周T细胞淋巴瘤患者:来自VALENTINE-PTCL01研究的根据既往治疗线数的疗效和最后一线治疗的结果
报告人:Pier Luigi Zinzani
背景
外周T细胞淋巴瘤(PTCL)是一种侵袭性非霍奇金淋巴瘤,对于复发或难治(R/R)的患者(pts)来说,可选的治疗选择有限。valemetostat tosylate(valemetostat)是一种新型有效的组蛋白甲基转移酶(EZH)2和EZH1双重抑制剂,已在日本被批准用于治疗R/R成人T细胞白血病/淋巴瘤。该开放标签、单臂、全球Ⅱ期VALENTINE-PTCL01研究(DS3201-A-U202;NCT04703192)旨在探究valemetostat治疗R/R PTCL患者的疗效和安全性。
方法
患者年龄≥18岁,确诊PTCL,既往接受≥1线全身治疗(包括维布妥昔单抗治疗间变大细胞淋巴瘤)后出现R/R。患者连续口服valemetostat 200 mg/天,直至疾病进展或出现不可耐受的毒性。主要终点是客观缓解率(ORR),由盲法独立审查中心(BICR)根据Lugano 2014标准,基于计算机断层扫描(CT)的缓解结果评估。次要疗效终点包括缓解持续时间(DOR)、无进展生存期(PFS)和总生存期(OS)。BICR基于正电子发射断层扫描(PET)-CT评估缓解是一个探索性终点。
结果
共有133例R/R PTCL患者入组,接受了≥1剂valemetostat治疗。患者的中位年龄为69岁(范围,22-85),男性91例(68.4%)。患者既往接受治疗线数的中位数为2线(LOT;范围1-12),26.3%的患者既往接受过造血干细胞移植([HCT];自体,n=32;异基因,n=5)。疗效分析集包括119例确认符合PTCL亚型的患者;最常见的亚型是血管免疫母细胞性T细胞淋巴瘤(n=42)和非特指型PTCL(PTCL,NOS;n=41)。截至数据截止日期(2023年5月5日),疗效分析集的119例患者中,基于CT和PET-CT的ORR分别为43.7%(n=52;95% CI,34.6-53.1)和52.1%(n=62;95% CI,42.8-61.3)。基于CT结果评估,17例(14.3%)患者达到完全缓解,32例(26.9%)患者基于PET-CT结果评估达到完全代谢缓解。根据CT结果的中位DOR为11.9个月(95% CI,7.8-不可评估[NE]),至首次缓解的中位时间为8.1周(范围,5-37)。中位PFS为5.5个月(95% CI,3.5-8.3),中位OS为17.0个月(95% CI,13.5-NE)。10例(8.4%)患者接受valemetostat联合异基因HCT治疗。既往LOT为1、2和≥3的患者的ORR分别为52.8%(95% CI,35.5-69.6)、46.7%(28.3-65.7)和35.8%(23.1-50.2)。在接受valemetostat治疗之前,接受最后一次治疗后复发患者的ORR为55.1%(95% CI,40.2-69.3),难治患者的ORR为36.7%(24.6-50.1)。在安全性分析集中的133例患者中,最常见的治疗期间发生的不良事件([TEAE];任何级别/≥3级)为血小板减少症(49.6/23.3%)、贫血(35.3/18.8%)、腹泻(29.3/3.8%)、味觉障碍(28.6/0%)和中性粒细胞减少症(26.3/17.3%)。导致治疗停止、剂量减少或剂量中断的TEAE发生率分别为9.8%、15.8%和49.6%。
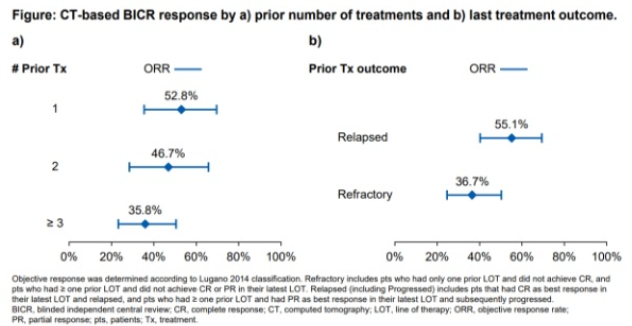
图2 BICR根据既往治疗线数(a)和最后一次治疗结果(b)基于CT评估的缓解结果
结论
valemetostat 200 mg/天在R/R PTCL患者中表现出良好的耐受性,以及较好的疗效(持久缓解)。相比于难治患者,在既往LOT较少的患者和接受最后一次治疗后复发的患者中,缓解趋势更优。总的来说,VALENTINE-PTCL01研究的结果表明,valemetostat为R/R PTCL患者提供了有临床意义的获益。
急性髓系白血病
新诊断患者
摘要号:S142
在新诊断的FLT3-ITD+ AML患者中,特别是那些未接受allo-HCT的患者,奎扎替尼继续治疗具有临床获益
题目:QUANTUM-FIRST:新诊断的FMS样酪氨酸激酶3-内部串联重复序列阳性(FLT3-ITD+)急性髓性白血病(AML)患者接受继续治疗的疗效
报告人:Mikkael A. Sekeres
背景
QuANTUM-First Ⅲ期研究(NCT02668653)表明,在新诊断的FLT3-ITD+ AML患者(pts)中,在标准化疗(CTx)±异基因造血干细胞移植(allo-HCT)中加入口服、高效、选择性的2型FLT3抑制剂奎扎替尼(Q),随后使用Q或安慰剂(P)继续(CONT)单药治疗至36个周期(3年[y]),相比于安慰剂,将相对死亡风险降低22%(PMID:37116523)。该研究通过分析总生存期(OS)、无复发生存期(RFS)和累积复发率(CIR),评估奎扎替尼CONT治疗对新诊断FLT3-ITD+ AML患者疗效的影响。
方法
FLT3-ITD+ AML的成年患者(18-75岁)按1:1随机分配接受Q(40 mg/天)或P治疗,每例患者接受标准诱导治疗7+3 CTx,并根据地区、年龄和诊断时的白细胞(WBC)计数分层。完全缓解(CR)或伴有中性粒细胞或血小板不完全恢复的CR患者(CRi)接受最多4个周期的高剂量标准巩固CTx联合Q(40 mg/天)或P和/或allo-HCT(Q/P在预处理方案前≥7天停止给药并且不与allo-HCT同时使用),随后接受单药Q(30-60 mg/天)或P的CONT最多36个周期,每周期4周。OS通过接受CONT的随机化的意向治疗人群计算;CIR和RFS通过在诱导治疗结束时达到CR并接受CONT的患者计算。RFS是预先指定的探索性分析,而OS和CIR是事后分析。基于倾向性评分(PS)分析OS和RFS需根据基线协变量(年龄、性别、WBC计数、NPM1突变状态、骨髓母细胞百分比),以及CONT前的allo-HCT和蒽环类药物类型。
结果
在539例随机患者中,208例(38.6%;Q组116例,P组92例)患者接受了CONT治疗(Q组中位接受治疗16个周期,P组中位接受治疗17个周期)。患者基线特征(Q vs. P)为中位(范围)年龄,53.0岁(23-73)vs. 56.5岁(20-74);女性,54.3% vs. 58.7%;ECOG PS≥1,63.8% vs. 62.0%;NPM1/CEBPA突变,分别为59.5% vs. 65.2%/25.0% vs. 27.2%;FLT3-ITD变异等位基因频率>25%,61.2% vs. 54.3%;诊断时WBC计数≥40×109/L,50.9% vs. 37.0%。在208例接受CONT治疗的患者中,201例患者在诱导治疗时达到CR/CRi(Q组114例;P组87例)。中位随访39.2个月后,两个治疗组均未达到中位OS,风险比(HR)为0.683(95% CI,0.395-1.183),与主要OS分析时的HR(0.78;95% CI,0.62-0.98)相比,Q组更优(图4)。3年OS率为79.9%(Q组)vs. 71.1%(P组)。在接受CONT治疗且在CONT治疗前未接受allo-HCT的89例患者中,观察到Q组显著的OS优势(HR,0.401;95% CI,0.192-0.838;图5)。接受过allo-HCT治疗并接受CONT治疗的119例患者的OS的HR为1.622(95% CI,0.623-4.220)。在诱导治疗结束后并接受CONT治疗达到CR的166例(Q组94例;P组72例)患者中,Q组RFS的HR更优(0.738;95% CI,0.442-1.230),Q组3年RFS率(67.1%)高于P组(59.6%)。此外,在这166例患者中,与P组相比,Q组的CIR在12、24和36个月时均有所下降,Q组3年CIR为25.9%,P组为34.4%。基于PS的OS和RFS分析,Q组优于P组。
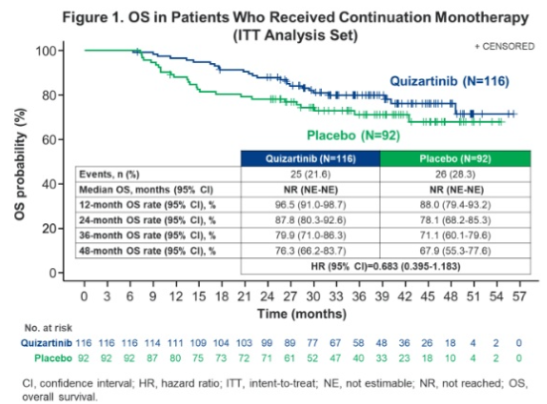
图4 接受继续单药治疗(ITT分析集)患者的OS
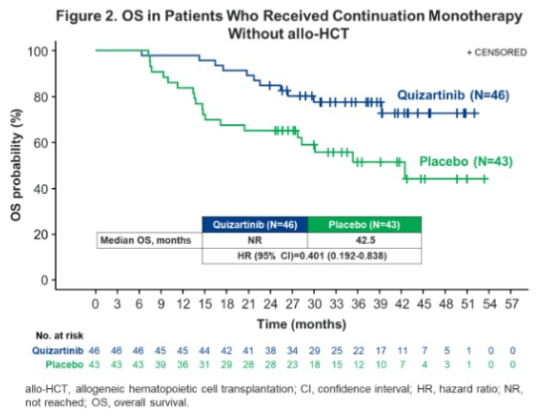
图5 接受继续单药治疗但未接受allo-HCT治疗患者的OS
结论
这项探索性分析显示,在新诊断的FLT3-ITD+ AML患者中,特别是那些未接受allo-HCT的患者,Q相比于P CONT治疗具有临床获益,这表明在这些患者中进行Q CONT治疗与延缓复发或死亡相关。未来CONT治疗中可测量的残留病灶分析可能有助于确定Q CONT的获益。
摘要号:P575
在阿扎胞苷中加入pevonedistat并未改善新诊断不适合强化治疗的AML患者的OS,可能与SARS-COV2大流行导致的早期死亡率上升有关
题目:PETHEMA PEVOLAM试验的结果:一项Ⅲ期随机开放标签研究,比较阿扎胞苷+pevonedistat与阿扎胞苷治疗新诊断不适合强化治疗的急性髓系白血病患者的疗效
报告人:Rebeca Rodriguez Veiga
背景
急性髓系白血病(AML)在不适合强化治疗的老年患者中的预后仍然很差,在过去的几十年里进展甚微;中位总生存期从阿扎胞苷(AZA)单药治疗的10.4个月到维奈克拉联合AZA治疗的14.7个月。pevonedistat(TAK-924/MLN4924)是一种用于治疗恶性肿瘤的神经前体细胞表达的发育下调蛋白8(NEDD8)激活酶的首创小分子抑制剂。初步的早期研究表明,20 mg/m2 pevonedistat联合阿扎胞苷(PEVO + AZA)通常耐受性良好,具有临床活性迹象。这项随机(1:1)、多中心、开放标签的Ⅲ期临床试验比较了pevonedistat(PEVO)联合阿扎胞苷(AZA)[PEVO + AZA]与阿扎胞苷单药[AZA]在新诊断不适合强化化疗的AML患者中的疗效。
方法
由于在入组期间,维奈克拉在西班牙没有市售,AZA被认为是目标人群的标准治疗。目标入组466例患者,主要目标为评估总生存期(OS)。次要目标为无事件生存期(EFS)和复合完全缓解(CR + CRi),其他目标是无疾病生存期、无复发生存期、累积复发发生率、生活质量和安全性/毒性。
结果
根据独立数据监测委员会的建议,PANTHER研究(NCT03268954)比较了PEVO + AZA vs. AZA在高危MDS、CMML或伴低原始细胞AML中的疗效,得到阴性结果后,入组于2019年9月开始,并于2021年10月提前结束。总共筛选了415例患者,其中随机分配310例患者:158例患者接受PEVO + AZA治疗,152例患者接受AZA治疗。11例患者撤回知情同意(PEVO + AZA组7例,AZA组4例)。中位年龄为77岁(47-98),中位给药周期数为4(0-27),两组间无显著差异(表2)。PEVO + AZA vs. AZA的疗效CR + CRi分别为32% vs. 30%,部分缓解分别为9% vs. 11%,难治性患者分别为30% vs. 33%,不可评估患者分别为29% vs. 28%,两组间无显著差异。整体人群中30天死亡率为14%,15例(5%)患者死于SARS-COV2肺炎。数据截止时的中位随访为24个月(0-40个月),PEVO + AZA组的中位OS为6个月,而AZA组的中位OS为7个月(HR=0.99,P=0.98)(图3)。根据年龄(年轻 vs. >75岁)、ELN 2017风险(低/中 vs. 不良)或ECOG(0-1 vs. ≥2),两组之间的OS无差异。两组之间血液学和非血液学不良事件(AE)的发生率和严重程度无显著差异。常见的AE(PEVO + AZA vs. AZA)为转氨酶升高(46% vs. 48%)、发热性中性粒细胞减少症(18% vs. 21%)、肺部感染(17% vs. 21%)和败血症(9% vs. 7%)。
表2 基线特征
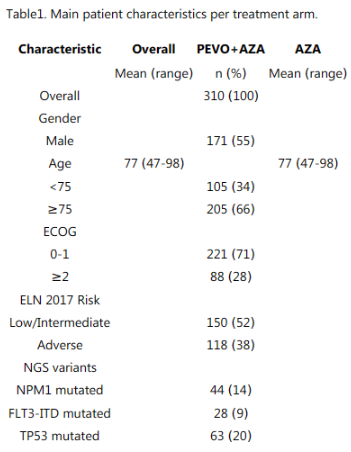
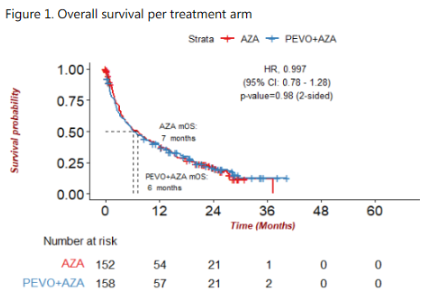
图3 OS结果
结论
在AZA中加入PEVO并未改善新诊断的不适合强化治疗AML患者的OS。事实上,整体人群的OS低于预期,可能是由于早期死亡率上升。值得注意的是,该研究完全是在SARS-COV2大流行期间进行的,这使得病毒感染导致的死亡率上升,并且在这一难以治疗的人群中卫生资源紧缺。
新诊断+R/R患者
摘要号:P602
含盐酸米托蒽醌脂质体方案在AML患者中具有令人鼓舞的疗效和可管理的安全性
题目:含盐酸米托蒽醌脂质体方案治疗急性髓性白血病的真实世界研究结果:短期疗效和安全性分析
报告人:马军 教授(哈尔滨血液病肿瘤研究所)
背景
急性髓系白血病(AML)是一种高度侵袭性的血液系统恶性肿瘤,预后较差。“3+7”方案,结合蒽环类药物和阿糖胞苷,仍然是新诊断(ND)AML的标准治疗方案。然而,正在进行的临床研究正在探索将第三种药物与“3+7”方案联合使用,以进一步提高疗效。对于复发或难治(R/R)AML患者,目前没有确定的标准治疗方法。盐酸米托蒽醌脂质体(PLM60)是一种新型纳米药物,与传统米托蒽醌相比,在动物实验中具有良好的药代动力学特性和更长的生存期。并且一些研究已经证实了PLM60在AML中的抗肿瘤作用。本文提供了PLM60治疗AML的真实世界研究的最新数据,以了解PLM60在临床中的实际应用,评价其在AML患者中的安全性和有效性。
方法
这是一项多中心、非干预性、双队列真实世界研究(ChiCTR2200067172)。纳入除急性早幼粒细胞白血病(APL)外,符合2016 WHO标准的ND AML和R/R AML成年患者。对于回顾性队列,要求至少接受一个周期的PLM60方案治疗。主要终点是复合完全缓解率(CRc),次要终点是总缓解率(ORR)、无复发生存期(RFS)、总生存期(OS)和安全性。
结果
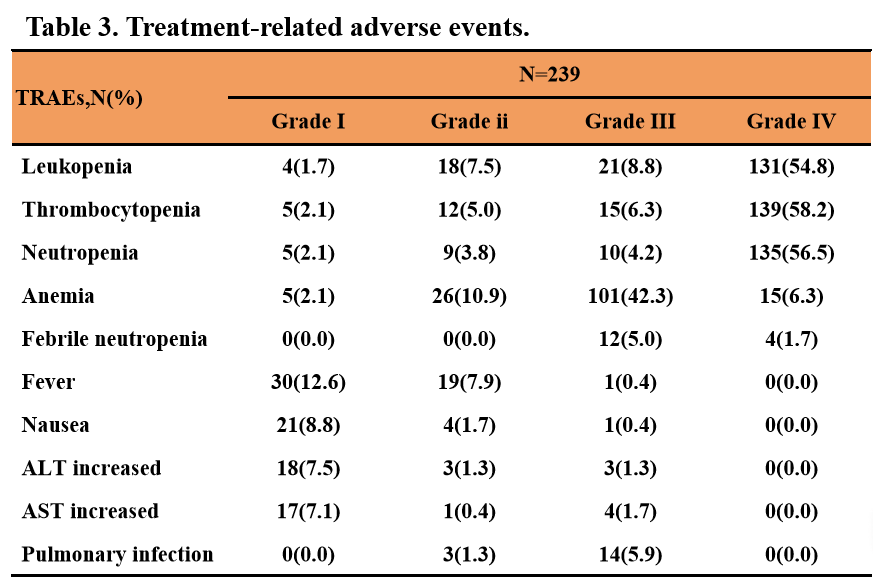
截至2024年2月21日,我们分析了239例符合入组条件的AML患者(中位年龄47岁,男性51.5%),这些患者在2022年1月至2023年11月期间接受了PLM60方案治疗。原发性AML为211例(92.5%),继发性AML为17例(7.1%)。79.1%的患者有细胞遗传学和分子检查结果,其中FLT3是最常见的突变基因,占12.1%。PLM60的中位剂量为19.0(范围5.9-33.8)mg/m2。117例ND患者中,总CRc率为84.6%(99/117),ORR为91.5%(107/117),接受诱导治疗患者的CRc率和ORR分别为75.6%(34/45)和88.9%(40/45)。在122例R/R患者中,总CRc率为45.1%(55/122),ORR为55.7%(68/122),接受诱导治疗患者的CRc率和ORR分别为41.6%(42/101)和54.5%(55/101)。MA(PLM60+阿糖胞苷)方案是诱导治疗中最常见的方案,ND患者CRc率为86.7%(26/30),ORR为93.3%(28/30),R/R患者CRc率为54.5%(18/33),ORR为63.6%(21/33)。其他有前景的诱导方案包括在R/R患者(CRc/ORR 62.5%(5/8))中的FL/CLAG-M(氟达拉滨/克拉屈滨+MA+G-CSF)方案和在ND(CRc/ORR 100%(5/5))和R/R(CRc 62.5%(5/8),ORR 75%(6/8))患者中的MAV(MA+维奈克拉)方案。其他疗效指标如RFS、OS等将在长期随访后报告。血液学3/4级TRAE包括血小板计数降低(64.4%)、白细胞数降低(63.6%)、中性粒细胞计数降低(60.7%)和贫血(48.5%)。最常见的非血液学3/4级TRAE是肺部感染(5.9%)。整体的安全性是可接受和可控的。
表3 基线特征
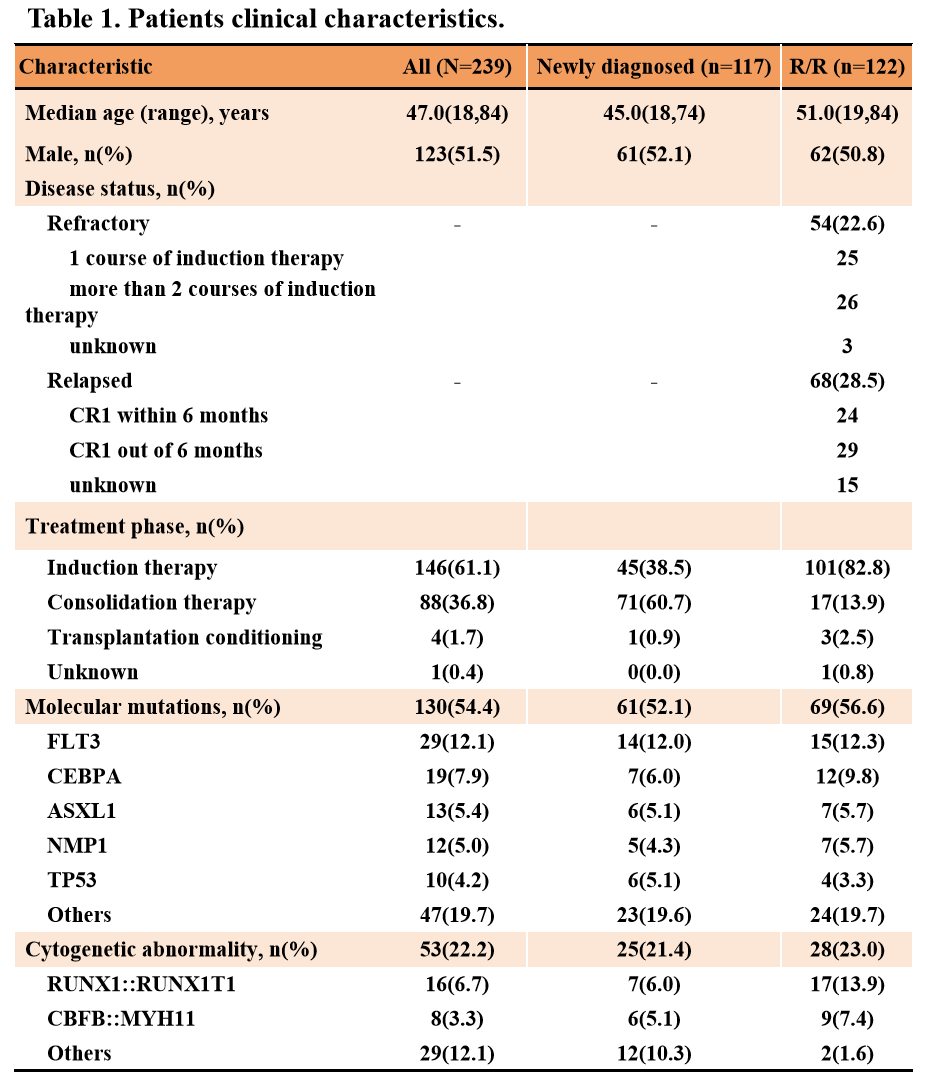
表4 疗效结果
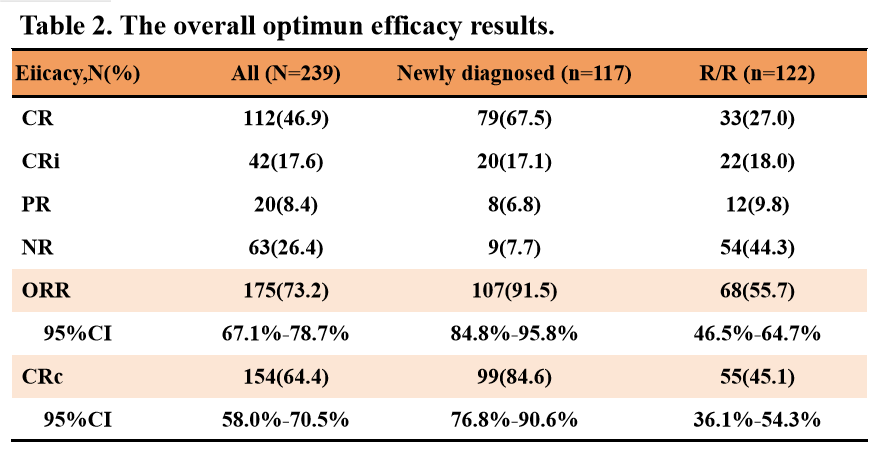
表5 治疗相关不良事件
结论
PLM60方案在AML患者中具有令人鼓舞的疗效和可管理的安全性。值得进一步探索疗效更优的方案。
R/R患者
摘要号:S267
131i-apamistama诱导的HCT显著改善了TP53突变的R/R AML患者的预后
题目:在随机Ⅲ期临床试验中,131i-apamistama诱导的异基因造血干细胞移植可改善高危TP53突变的R/R AML患者的生存结果
报告人:Hannah Choe
背景
异基因造血干细胞移植(HCT)是唯一可能治愈复发或难治急性髓性白血病(R/R AML)患者的治疗方法。TP53突变的AML患者预后不良,主要由于对治疗反应差,复发率高,仅少数患者接受了HCT治疗。iomab-B(131i-apamistamab)是一种抗CD45放射-免疫偶联物,可向造血干细胞提供高剂量靶向辐射,可清除骨髓和白血病细胞,且非靶向毒性较低。由于其新的作用机制可更好地控制疾病和更安全地进行HCT,iomab-B诱导/调节治疗具有改善TP53突变患者预后的潜力。在此报道了SIERRA试验中TP53突变患者的特征和结果。
方法
SIERRA(NCT02665065)是一项多中心、随机、对照的Ⅲ期研究,比较基于iomab-B的治疗与医生选择的常规治疗(CC)在≥55岁的活动性R/R AML患者中的疗效。患者被随机分配(1:1,N=153)至CC组或iomab-B组联合氟达拉滨和全身放疗(2 Gy),然后进行HCT(CC,N=77;iomab-B,N=76)。主要终点是持续CR(dCR),定义为CR/CRp持续≥6个月。iomab-B组在接受HCT后28-56天或开始CC后28-42天对患者进行CR/CRp评估,未达到CR/CRp的患者可以交叉(CO)至iomab-B。
结果
在153例随机分组的患者中,100%接受治疗剂量iomab-B的患者(N=66)进行HCT,CC组为14例(18.2%)。在可评估的患者中,iomab-B组6个月时的dCR率为22%,而CC组为0%(95% CI[12.29,34.73];p<0.0001)。共有37例TP53突变(TP53mut)患者入组(CC组20例;iomab-B组17例),发生率为24.2%。有或无TP53突变患者的基线特征在中位年龄、疾病风险/状态、既往治疗线数、HCT合并症指数和Kanofsky表现状态方面均较为平衡。iomab-B在该人群中的安全性与整个SIERRA试验人群相似,严重不良事件发生率较低。在接受iomab-B治疗的患者中,无论突变状态如何,CR率和dCR率相似。在接受iomab-B治疗的TP53mut患者中,CR率和dCR率达到了55.6%和14.8%,TP53野生型(TP53wt)患者达到了58.1%和16.1%。未CO CC组的TP53wt患者,有17.4%达到CR,但无人达到dCR。未CO CC组中TP53mut患者均未达到CR或dCR。iomab-B组TP53wt患者的中位总生存期(OS)为6.37个月,TP53mut患者为5.72个月(HR=0.66;95% CI[0.37, 1.18];p=0.16)。在CC组(包括CO患者)中,TP53mut患者的中位OS为2.96个月。在不包括CO患者的CC组的事后分析中,TP53wt和TP53mut患者的中位OS分别为6.51个月和1.66个月(HR=0.28;95% CI[0.12, 0.67];p=0.0022)。在TP53mut患者中,接受iomab-B(iomab-B + CO)治疗和未接受iomab-B治疗(CC组不包括CO)的患者中位OS分别为5.49个月和1.66个月[(HR=0.23;95% CI[0.10, 0.52];p=0.0002)(图6)]。
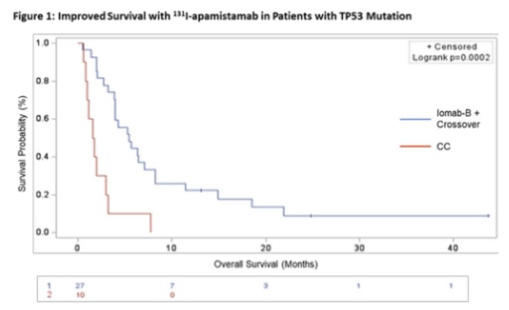
图6 131i-apamistamab在TP53突变患者中的生存结果
结论
131i-apamistama诱导的HCT显著改善了TP53突变的R/R AML患者的预后,与TP53野生型患者在CR、dCR和OS方面观察到的比率相当,克服了这种突变通常与预后不良相关的不良影响。这些数据支持131i-apamistama诱导/调节治疗和HCT在R/R AML中的使用,特别是在TP53突变患者中。


