浙江大学/西南大学ACS Nano:口服益生元蛋白质活性氧纳米清除剂协同治疗炎症性肠病
时间:2024-05-26 06:01:02 热度:37.1℃ 作者:网络
在治疗炎症性肠病(IBD)及其相关肠道纤维化的安全有效用药方面存在着巨大的需求方面。由于氧化应激在IBD的发病机制中起着核心作用,虾青素(AST)是一种安全性高的良好抗氧化剂,有望用于治疗IBD。然而,AST的溶解性差、易氧化,限制了其应用。
在本研究中,浙江大学Xin Li和西南大学李翀教授等人制备了一系列蛋白质基纳米颗粒(NP)用于AST负载,以鉴定具有潜在临床应用性的口服纳米载体。通过分子动力学模拟和体外特性表征的系统验证,使用不需要交联剂或乳化剂简单方法制备的、乳清蛋白分离物(WPI)驱动的NP被确定为口服AST递送的最佳载体。口服给药后,WPI驱动的NP受益于固有的pH敏感性和粘膜粘附特性,可有效地保护AST不被胃液降解,并在肠道损伤部位靶向释放AST。此外,AST NPs通过改善炎症、氧化损伤和肠道微生态,在右旋糖酐硫酸钠(DSS)诱导的急性结肠炎和慢性结肠炎相关的肠纤维化中显示出强大的治疗效果。总之,AST WPI NPs在治疗炎症性肠病的炎症和纤维化方面具有潜在的治疗价值。相关工作以“Readily Available Oral Prebiotic Protein Reactive Oxygen Species Nanoscavengers for Synergistic Therapy of Inflammation and Fibrosis in Inflammatory Bowel Disease”为题发表在ACS Nano。

【文章要点】
乳清蛋白分离物(WPI)主要由β-乳球蛋白(β-Lg)(约70%)、α-乳清蛋白(α-Lac)(约25%)和少量牛血清白蛋白(BSA)组成,具有成本效益并且十分安全。此外,据报道,WPI对在IBD中都会受到严重破坏的免疫和肠道微生物组都有积极影响。这些特征使WPI驱动的蛋白质基NP(PNP)有望成为治疗肠道疾病的理想口服载体。然而,尽管先前的研究试图开发基于WPI的口服载体,但它们往往需要额外的材料,这限制了它们的应用。为此,在本研究中,作者使用分子动力学模拟(MDS)和体外性质表征,系统地研究了药物负载和控制药物释放的能力和底层机制。首先,作者使用乳液溶剂蒸发法评估了几种蛋白质[蛋蛋白、丝蛋白和WPI封装AST的能力,其中WPI表现出最佳性能(图1)。
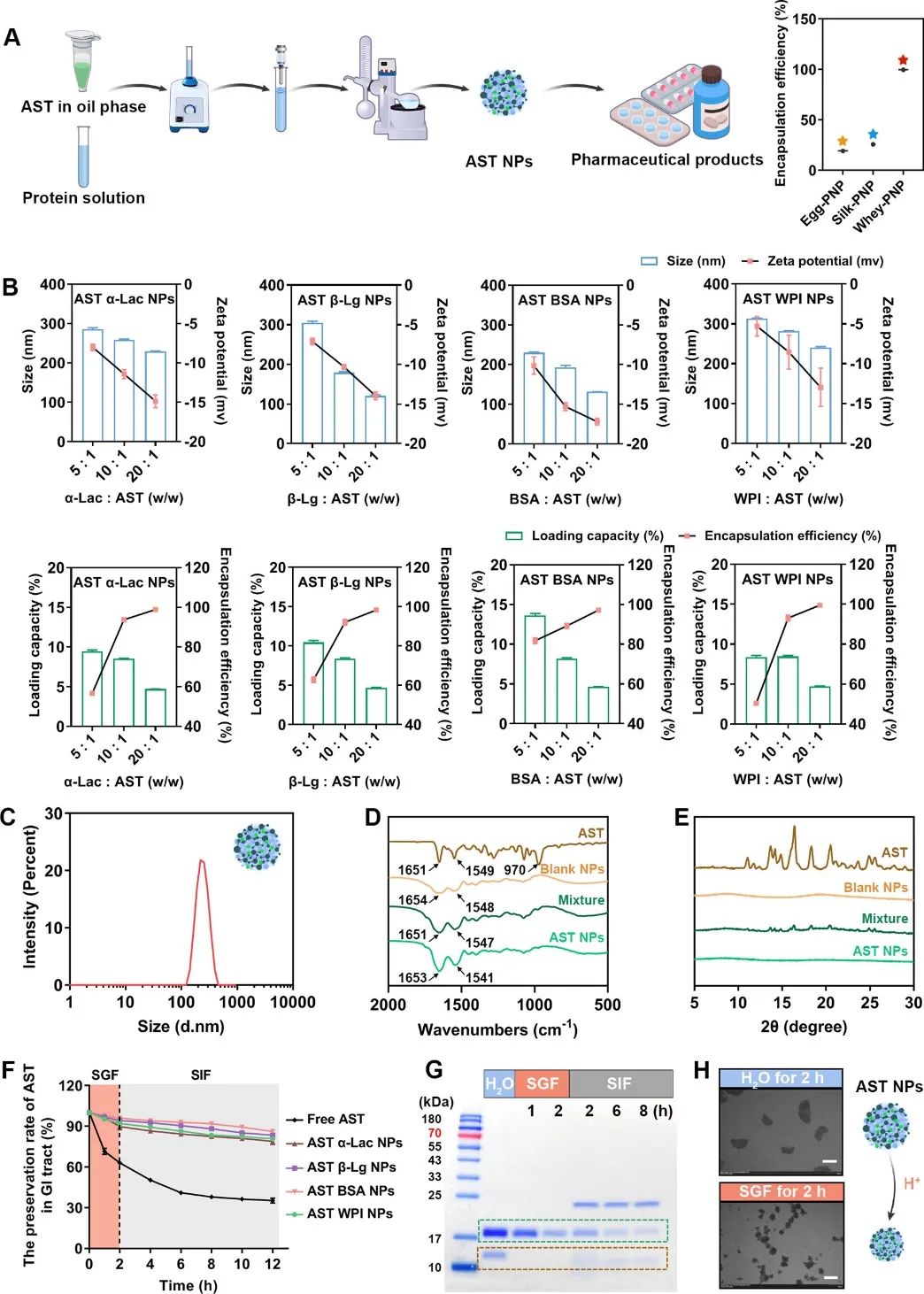
图1 AST WPI NPs的制备
作为WPI的主要成分,β-Lg表现出了良好的抗胃酸性能。此外,WPI表现出了粘膜粘附特性,可用于延长药物在胃肠道中的滞留时间。因此,WPI可以作为口服AST的合适载体,而不需要蛋白质分离和纯化。此外,益生元WPI通过调节肠道菌群、营养代谢和能量供应,具有补充有益作用。在右旋糖酐硫酸钠(DSS)诱导的急性结肠炎小鼠模型和慢性结肠炎相关肠纤维化小鼠模型中,WPI通过降低干扰素-γ受体2(Ifngr2)和鸟苷酸结合蛋白(GBPs)的表达来调节免疫平衡,后者介导结肠炎小鼠的干扰素-γ信号通路。同时,AST NPs可清除ROS,从而进一步减轻肠纤维化(图2)。
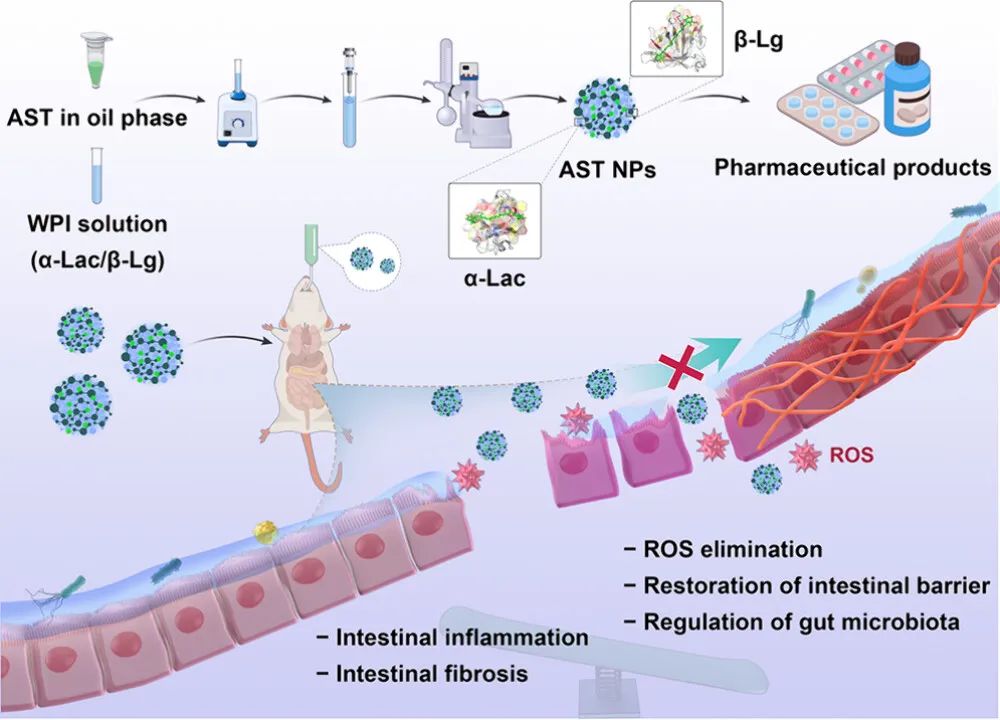
图2 抗炎和抗纤维化作用示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.3c13114


