Science重磅:男性避孕药新突破,可实现安全可逆的非激素性避孕
时间:2024-05-27 06:01:06 热度:37.1℃ 作者:网络
雄性或小鼠中具有纯合性丝氨酸/苏氨酸激酶33(STK33)突变的个体由于精子形态和运动能力缺陷而不育。
2024年5月23日,贝勒医学院 Martin M. Matzuk 团队在Science 在线发表题为“An AAV capsid reprogrammed to bind human transferrin receptor mediates brain-wide gene delivery”的研究论文,该研究为了通过STK33特异性抑制剂对STK33进行化学评估以作为男性避孕手段,筛选了包含数十亿化合物的DNA编码化学库,发现了有效的STK33特异性抑制剂,确定了与截短的命中化合物CDD-2211结合的STK33激酶结构域,并生成了优化的命中化合物CDD-2807,其表现出纳摩尔级细胞效力(半数抑制浓度 = 9.2纳摩尔)和良好的代谢稳定性。
在小鼠中,CDD-2807表现出无毒性,能够有效穿过血睾屏障,不在大脑中积累,并诱导可逆的避孕效果,其表现与遗传性STK33扰动的表型相同而不改变睾丸大小。因此,STK33被化学验证为一种非激素类避孕靶点,而CDD-2807则是一个有效的工具化合物。
在过去的60年里,世界人口增加了超过2.6倍,从1960年的30亿增长到2022年的80亿,预计到2037年将达到90亿。人口增长带来的不确定性影响未来儿童的生活。避孕是家庭计划的重要策略,特别是个人决定何时以及是否生育,以及想要多少孩子。然而,近几十年来,避孕领域的突破有限。尽管明显需要更多经济实惠、长效、可逆且安全的避孕方法,但目前没有有效的男性口服避孕药。男性的激素类药物(孕激素和雄激素)或混合物的临床试验正在进行中,一些研究在第一阶段和第二阶段显示了有希望的结果。虽然已经创建了超过800个睾丸特异基因的敲除模型,并且其中约250个表现出男性不育的表型,但迄今为止,针对这些已验证靶点的小分子(非激素)抑制剂开发的很少,甚至更少的在临床前模型中显示出避孕效果。
人类基因组中有538个激酶,但只有约15%的激酶有美国食品药品监督管理局(FDA)批准的抑制药物或药物候选物。大多数获批的激酶抑制剂都是为治疗癌症而开发的。然而,鉴于激酶在人类生物学中的关键作用,它们是吸引人的靶点,不仅限于癌症治疗。基于高通量筛选的传统药物发现模式成本高且效率低,这减缓了开发激酶抑制剂以改善人类健康的进程。因此,针对激酶提供了大量的治疗机会。
一部分160个激酶由于研究不足或理解不充分,被称为“暗激酶”,需要有效的小分子开发。其中一个暗激酶是STK33,这种激酶在哺乳动物、鸟类、爬行动物、鱼类和脊索动物中进化上保守,且在睾丸中富集,在精母细胞通过转化为精子细胞的过程中表达。STK33在男性生殖细胞中专门用于精子细胞分化,Stk33敲除雄性小鼠由于畸形精子症和精子不动性而不育。在一个家庭中发现有男性携带STK33基因的移码突变导致不育,这种表型与Stk33敲除小鼠相似。这些STK33突变的小鼠和男性在总体上表现正常,睾丸大小没有显著变化。因此,STK33被认为是一个具有最小安全风险的可行避孕靶点。已经有STK33抑制剂被描述,但尚无特异性用于体内化学干扰STK33功能的抑制剂。
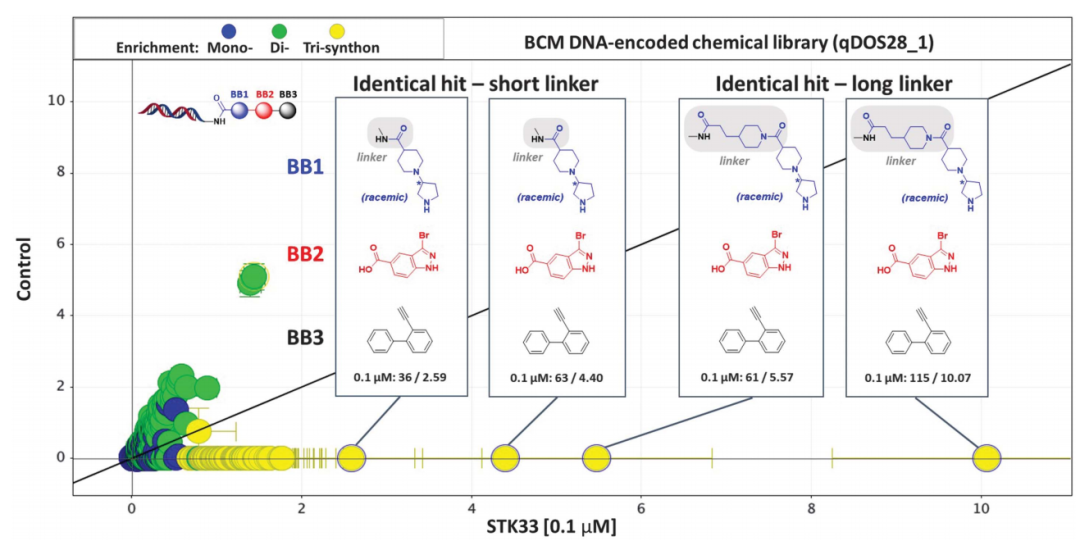
DEC-Tec选择(图源自Science )
在这项最新研究中,研究团队使用DEC-Tec技术成功筛选到了靶向STK33的高效抑制剂,并对其进行了改造,使其更具稳定性、高效和特异性。在这些经过改造的化合物中,化合物CDD-2807效果最为显著。
在这项研究中,研究团队还解析了STK33的第一个晶体结构,晶体结构展示了高效抑制剂与STK33激酶在三维空间的相互作用方式,这帮助了研究团队构建并设计出最终的化合物CDD-2807,以获得更好的药物特性。
实验结果显示,化合物CDD-2807能够有效地穿过血-睾屏障,在低剂量时降低精子的运动能力和数量,并降低小鼠的生育能力。CDD-2807治疗并未使小鼠出现毒性反应,而且该化合物不会在大脑中积累,也不会改变睾丸的大小,这与Stk33基因敲除小鼠和STK33基因突变的人的情况相似。更重要的是,CDD-2807带来的避孕效果是可逆的。在停止使用一段时间后能够恢复精子的运动能力和数量,从而恢复生育能力。
原文链接:
https://www.science.org/doi/10.1126/science.adl2688


