杨阳教授:黏脂贮积症Ⅳ型的AAV基因治疗研发进展 | 2024全球罕见病科研论坛
时间:2024-05-29 18:03:10 热度:37.1℃ 作者:网络
5月23-25日,2024全球罕见病科研论坛暨第二届中国罕见病科研及转化医学大会在上海三甲港绿地国际会议中心举办,本次大会由瑞鸥公益基金会、国际罕见病研究联盟(International Rare Diseases Research Consortium,简称IRDiRC)、复旦大学主办,国家儿童医学中心复旦大学附属儿科医院、蔻德罕见病中心联合主办。
本次大会邀请来自超过20个国家和地区的150多位高校、医院、科研院所、政府部门、基金会及医药企业从事罕见病基础与转化医学研究、科研资助及行业推动的专家学者,围绕罕见病基础研究、基因与细胞治疗、研究者发起的临床试验(IIT)、临床研究、药物研发、国际科研合作等多个主题进行分享与交流,报告罕见病科研最新进展与原创性成果,展示罕见病研究的中国力量与国际视野。
在会上,来自四川大学华西医院的杨阳教授开展了题为“黏脂贮积症Ⅳ型的AAV基因治疗研发进展”进行了深度剖析,为这一罕见遗传病治疗前景带来了新曙光。现梅斯医学特将会议内容精粹整理成文,以分享给各位同道。
一、黏脂贮积症Ⅳ型流行病学
黏脂贮积症Ⅳ型(MLIV)是一种罕见的常染色体隐性遗传溶酶体贮积症,第一例患者于1974年被诊断出来。黏脂贮积症Ⅳ型患者在世界各地都有发现,大约70-80%的患者是德系犹太人。据估计德系犹太人中该病的发生率为1/40000。目前,未有相关文献报道我国黏脂贮积症IV型的发病情况。
二、黏脂贮积症Ⅳ型病因
黏脂贮积症Ⅳ型起因在于MCOLN1基因的变异,该突变阻碍了关键蛋白——粘磷脂1(TRPML1)的正常合成,这是一种至关重要的阳离子通道蛋白。TRPML1的缺失扰乱了溶酶体向晚期阶段的正常转运过程,导致脂质与水溶性代谢产物在各类组织及器官的细胞中异常累积。这种积累随着时间的推移,逐渐引发多系统的组织损伤与功能障碍。
三、黏脂贮积症Ⅳ型临床表现
根据临床表现,黏脂贮积症Ⅳ型又分为典型黏脂贮积症Ⅳ型和非典型黏脂贮积症Ⅳ型:
典型黏脂贮积症Ⅳ型占到85%,最常见的症状包括精神运动迟缓、角膜混浊、视网膜营养不良、视神经萎缩和斜视,通常始于婴儿期,患者在1岁后出现发育里程碑延迟(由于发育性大脑异常)和视力受损(由角膜混浊和视网膜变性共同引起)。到了青春期,所有患者都有严重的视力障碍。大多数患者20岁以后开始表现出进行性痉挛性四肢轻瘫和运动能力丧失。
然而非典型黏脂贮积症Ⅳ型仅占15%,此类型疾病进展缓慢,部分表现出畸形特征且没有角膜和认知方面的异常。
四、腺相关病毒(AAV)基因治疗
目前尚缺乏黏脂贮积症Ⅳ型有效治疗方法,以支持治疗为主。随着基因治疗的快速发展,AAV基因治疗作为遗传性疾病的新型治疗手段,展现出了治疗罕见病及其他遗传性疾病的巨大潜力。
- AAV不具有致病性,安全性好;
- 无包膜,稳定性好,耐受反复冻融;
- AAV基因组在细胞核中形成“episome”,可持续区稳定表达治疗基因,实现一次治疗,长期有效;
- 超过100种血清型,适应症广;
- AAV是目前最成功的体内导入系统。
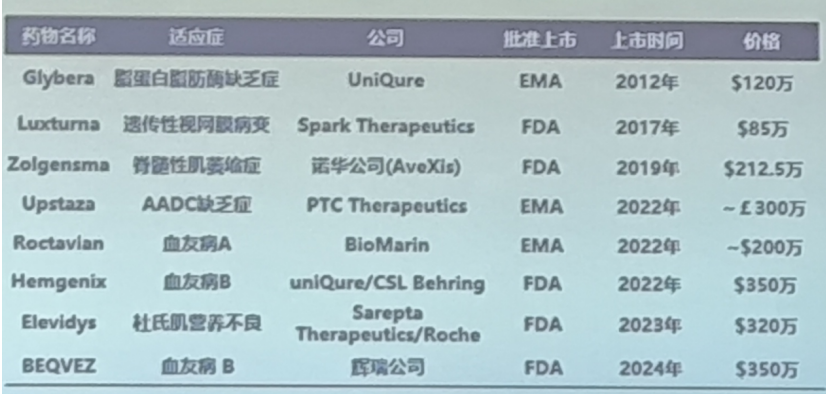
全球基因治疗正处迅速发展期,已有8款AAV基因治疗药物获批上市。目前,全球共有235项正在开展的AAV基因治疗产品临床试验,其中19款产品处区于临床前期,而中国现有40款AAV药物进入临床研究,3款处于临床Ⅲ期。
1、黏脂贮积症Ⅳ型基因治疗研究
美国麻省总医院 Yulia Grishchuk 团队在 2021 年发表的论文中,证明了使用AAV基因治疗改变黏脂贮积症Ⅳ型病程的可行性。
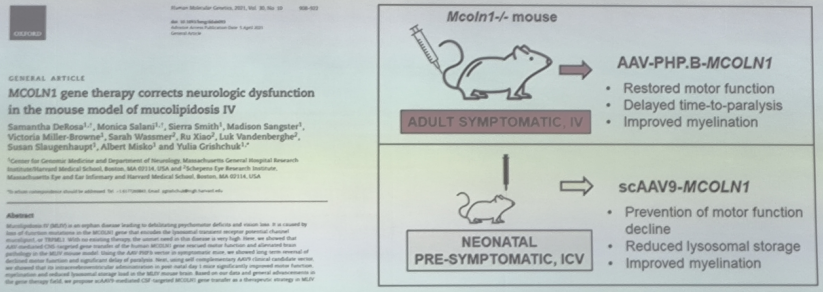
结果显示:
- 静脉注射AAV-PHP.B-MCOLN1可恢复成年有症状黏脂贮积症Ⅳ型模型小鼠的运动功能,并延迟瘫痪的发生;
- AAV-PHPb可以高效突破小鼠的血脑屏障,但是在非人灵长类中对CNS系统的转导效率较低;
- 脑室内注射SCAAV9-MCOLN1,可以显著改善新生黏脂贮积症Ⅳ型模型小鼠的运动功能;
- SCAAV9-MCOLN1减少McoIn1-/-小鼠大脑中的 LAMP 阳性溶酶体聚集物;
- SCAAV9-MCOLN1改善McoIn1--小鼠大脑胼胝体厚度。
此外,静脉注射的SCAAV9-MCOLN1基因治疗,在成年有症状MLIV模型小鼠中枢神经系统的转导效率很低,没有观察到治疗效果。需要进一步提高AAV的CNS 靶向效率以实现最佳治疗效果。
2、黏脂贮积症Ⅳ型基因治疗——金石计划
黏脂贮积症Ⅳ型基因治疗科研项目是金石计划首批项目之一。2023年6月已经完成了动物模型构建以及载体设计及病毒制备。
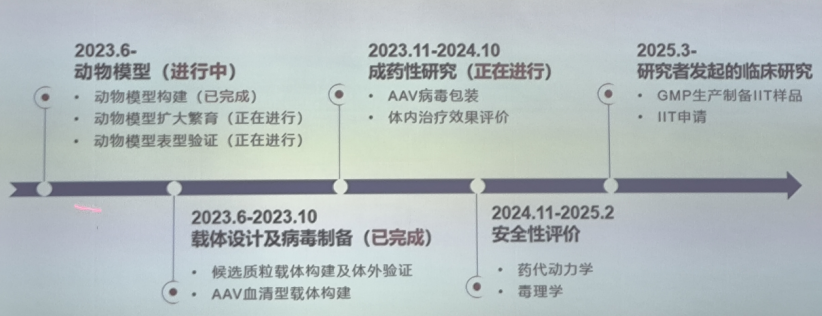
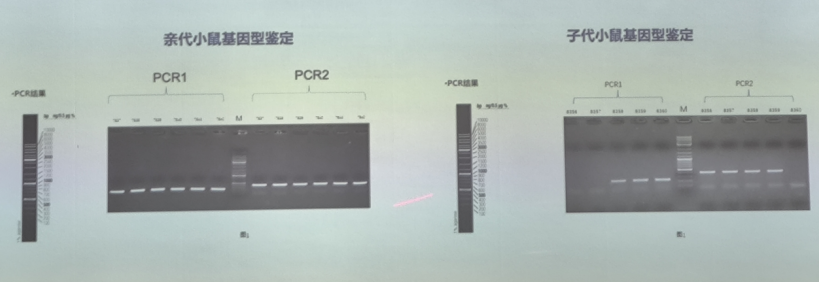
1)黏脂贮积症Ⅳ型动物模型构建及繁育
该研究构建了MCOLN1基因敲除疾病模型。动物模型繁育和表型验证:运动功能评估(行为学)、病理检查(LAMP阳性溶酶体聚集物等)。
2)AAV基因治疗载体设计及验证
该研究优化MCOLN1(MCOLN1co)基因,合成基因序列,并构建了4个候选基因治疗载体,酶切及测序验证。

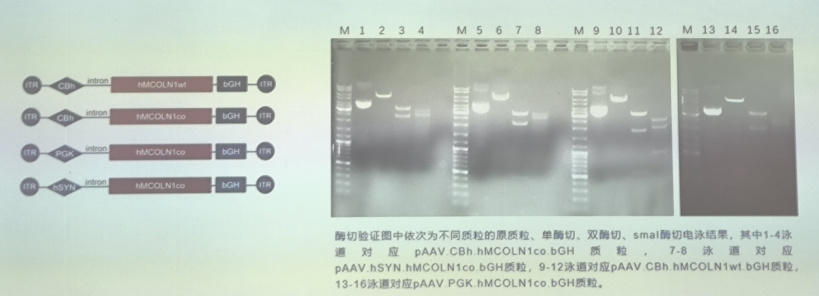
同时,转染HEK293细胞,提取蛋白和mRNA进行westernblot和gPCR,检测MCOLN1转录和表达。通过序列优化,可提高MCOLN1基因的转录和表达水平。
AI设计改造AAV衣壳,提升CNS转导效率。利用AI深度学习设计超20万病毒变体,接近60%具有生物活性,效率远高于传统随机突变(≤1%)。深度学习神经网络模型准确预测AAV衣壳活性和逃逸中和抗体的能力。
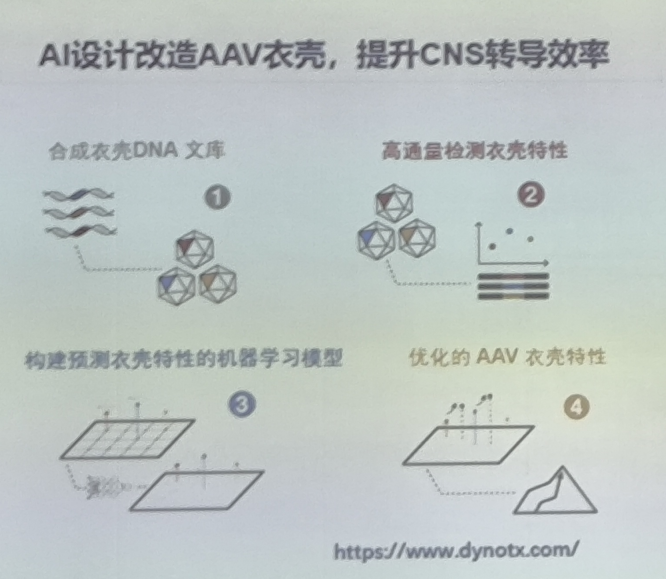
2023年,基于AI技术设计的AAV-bCap1衣壳,与AAV9相比,在NHP肝脏中的转导减少10倍,但在中枢神经系统的转导增强了100倍。
- 构建了AAV-bCap1衣壳载体,包装AAV9-EGFP.AAVbCap1-EGFP两种血清型的病毒;
- 静脉注射(5x10^13 vg/kg)C57小鼠,通过活体成像以及免疫荧光检测检测大脑中的EGFP表达;
- 相比与AAV9,AAVbCap1可以在C57小鼠中高效转导CNS系统,适用于黏脂贮积症4型动物模型的基因治疗研究。
3)AAV病毒载体的生产制备
通过三质粒转染HEK293,成功包装出AAVbCap1病毒,纯度和滴度都符合要求。AAV病毒产量与常规AAV9的产量无区别,也为后续的GMP生产奠定了基础。
3、X连锁视网膜劈裂症基因治疗研究
X 连锁视网膜劈裂症是一种 X 染色体隐性遗传眼底疾病,由 RS1基因突变导致,全球患病率约为 1/5000至1/25,000。XLRS 在青少年期发病,是导致男性青少年黄斑变性的主要原因,主要的疾病表型包括:
- 中心视力的丧失、视野缺损、视网膜内层劈裂引起的黄斑区微囊样轮辐状改变和其他周边视网膜异常;
- 视网膜电图(ERG)b波相对于a波不成比例的下降;
- 疾病晚期(~50岁)出现光感受器丧失;
RS1蛋白主要表达于视网膜光感受器细胞及双极细胞的表面,参与调节细胞间的黏附及信号传递,对维护视网膜正常的结构及功能具有重要作用。
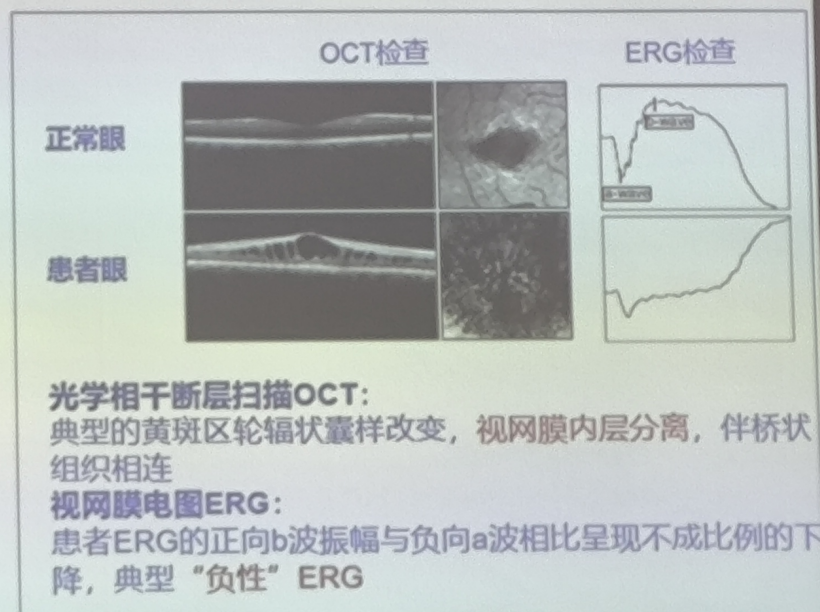
一项JWK002注射液在X连锁视网服劈裂症受试者中单次单眼视网膜下注射给药的安全性和有效性的临床研究,结果显示,AAV 基因治疗在低剂量患者组中都显示出较好的耐受性,无SAE,无血管炎、视网膜炎、脉络膜炎、血管闭塞或眼内炎,未观察到临床相关的低眼压事件。在低剂量组队列1的6例患者中,OCT可见视网膜劈裂腔逐渐变小,90天时基本消失。
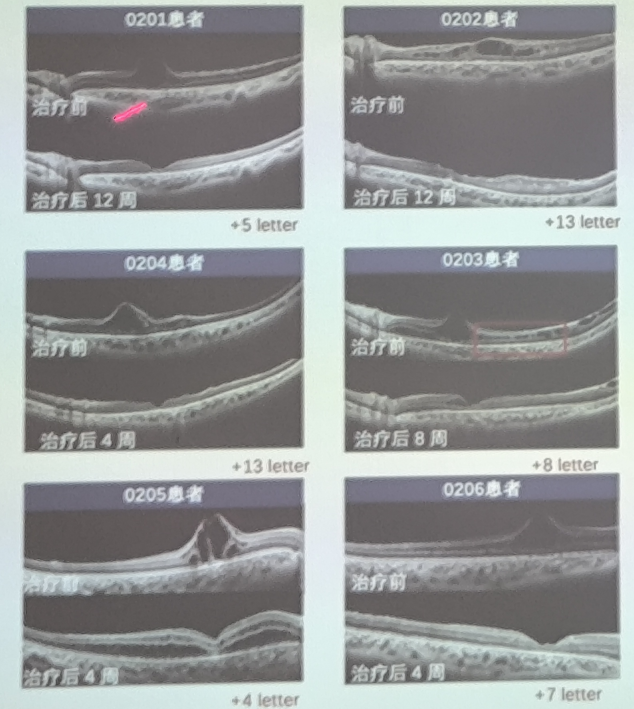
进一步,证实通过AAV 基因治疗最佳矫正视力BCVA分别提升了5,13,8,13,4和7个字母。全视野视网膜电图ffERG暗适应3.0 ERG的b/a比值在第90天也有所提升。
4、杜氏肌营养不良症基因治疗研究
杜氏肌营养不良症(DMD)为抗肌萎缩蛋白基因突变而导致的X-连锁隐性遗传疾病,全球男性患病率约1/3600,中国每年患者约为2600人。
在国内首个进行AAV基因治疗临床试验的受试患者中,相比于给药前,受试者爬楼梯的步态明显改善,可连续跳跃,可以自主骑自行车;运动的耐力和稳定性增加。

另外,北极星移动评价量表(NSAA)评分显著改善,从治疗前的25分提高到了31分。相比于给药前,受试者相关运动指标均有明显改善,且改善效果已持续3个月。
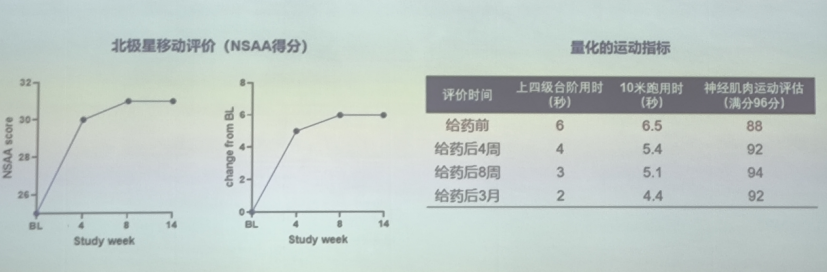
受试者治疗后安全性良好。持续3月的检测结果显示,最常见治疗相关不良事件是呕吐,患者肝酶出现短暂升高;受试者给药后3个时,主要血生化,血常规指标未发现明显异常,肌酸激酶CK和心肌标志物明显降低。
总之,黏脂贮积症Ⅳ型的AAV基因治疗正处于研发的关键时期,尽管面临诸多挑战,但通过动物模型的成功、载体优化和新技术的应用,为未来临床治疗提供了希望。随着研究的深入,有望为黏脂贮积症Ⅳ型患者带来更有效的治疗选项。


