了解缺氧肿瘤微环境
时间:2024-06-05 15:00:18 热度:37.1℃ 作者:网络
前言
缺氧是是一种组织和器官缺乏足够氧气供应的状态,是实体瘤的一个常见特征,影响其生物学和对治疗的反应。缺氧肿瘤微环境(TME)被定义为氧分压(pO2)低于10mmHg的情况。缺氧调节肿瘤细胞快速增殖、肿瘤血管系统异常、间质高压或低氧输送诱导的肿瘤生长、侵袭和对治疗的抵抗。
缺氧激活的主要转录因子之一是缺氧诱导因子(HIF),它调节参与肿瘤发生各个方面的基因的表达,包括增殖能力、血管生成、免疫逃避、代谢重编程、细胞外基质(ECM)重塑和细胞迁移,通过诱导治疗耐药性对患者的结果产生负面影响。进一步了解缺氧对TME和对治疗耐药性的影响,以及缺氧生物标志物作为治疗反应的预后和预测指标的潜力,将为发现新的治疗靶点提供机会。
缺氧诱导因子
HIF是一种对低氧水平有反应的转录因子,它调节基因表达以适应肿瘤细胞的生存行为。它的激活支持缺氧适应的基因,如与血管生成、红细胞生成、葡萄糖摄取和厌氧代谢相关的基因,同时抑制非必需的生存基因。
细胞对缺氧的反应诱导由HIF调节的细胞内信号通路。HIF-1是一种异二聚体,由氧敏感亚基HIF-1α和组成型表达的HIF-1β组成。在低氧条件下,HIF-1α被降解,但在缺氧条件下,HIF-1α稳定地与HIF-1β形成异二聚体。这种复合物充当转录激活剂,与靶基因启动子中称为缺氧反应元件(HRE)的DNA序列结合。
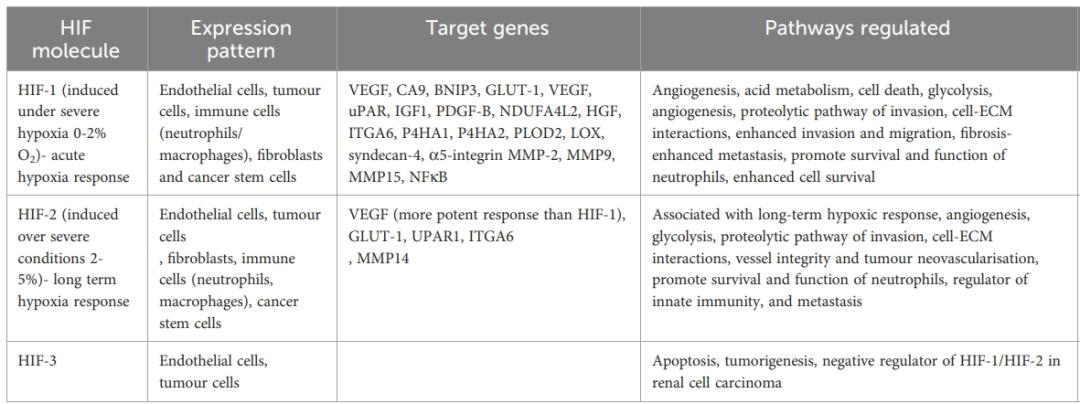
HIF-2也是与氧敏感的HIF-2α亚基的异二聚体,同时与HIF-1α共享HIF-1β作为组成型表达的亚基。然而,HIF-1和HIF-2具有不同的作用。HIF-3是最不具特征的HIF,具有多种异构体,这些异构体具有不同的组织分布和功能特性。HIF-3并不像HIF-1/HIF-2那样具有反式激活结构域,而是含有抑制HRE应答基因表达的多肽。
缺氧与肿瘤微环境
TME是肿瘤周围形成的复杂环境,涉及多种细胞类型和分子的相互作用。在实体瘤中,TME由癌细胞、周围血管、免疫细胞、癌症相关成纤维细胞(CAFs)、信号分子和ECM组成。肿瘤细胞可以通过释放促进血管生成的细胞外信号或诱导外周免疫耐受以逃避免疫检测来改变微环境的组成。缺氧、代谢微环境、酸性生态位和机械环境等特征在TME的表型中也起着重要作用。缺氧TME可以帮助肿瘤生长、扩散或对治疗产生耐药性。
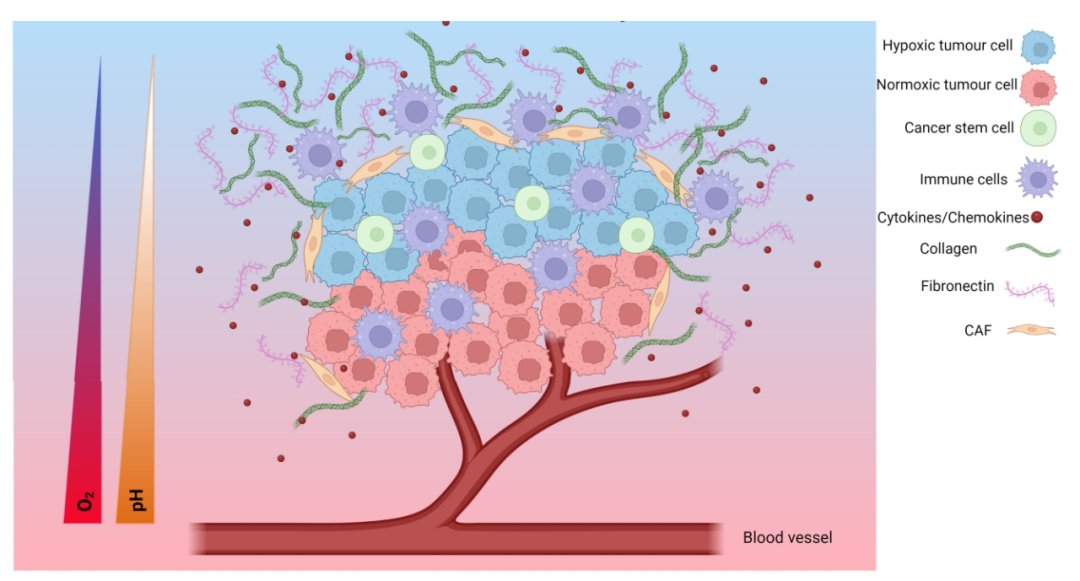
TME内的代谢转换对于癌细胞的生长和代谢以及适应缺氧微环境至关重要。这种现象被称为Warburg效应,其特征是细胞代谢有利于糖酵解,以满足癌细胞的生存需求。Warburg效应涉及葡萄糖摄取速率的增加和乳酸的优先产生。这导致TME因大量代谢废物(包括乳酸、二氧化碳和碳酸氢盐)的积累而酸化。这些产物降低了细胞外空间的pH值,并在细胞内和细胞外pH值之间产生梯度。这对癌症的多个特征有影响,包括抑制免疫反应、增加肿瘤侵袭和转移以及调节增殖。
缺氧还增强了葡萄糖转运蛋白的上调,包括GLUT1和参与糖酵解途径的酶(例如CA9)。酸化的另一个结果是基质金属蛋白酶(MMPs)的活性增强,其在降解ECM和基底膜中起作用。因此,肿瘤在缺氧条件下的侵袭和转移潜力增强。酸化还可以通过减少药物摄入和激活DNA修复机制来增强对化疗和放疗的抵抗力。
缺氧与肿瘤细胞外基质
ECM是细胞外区域的复杂生物分子网络,为周围细胞提供结构和机械支持,它在癌症发展中具有重要作用。ECM包括广泛的分子,如结构蛋白(纤连蛋白、胶原)、信号分子(EGF、TGF-β)和酶(MMPs、LOX、P4HA)。ECM的主要蛋白质成分是纤连蛋白(FN)、胶原(COL)、弹性蛋白和层粘连蛋白。
肿瘤相关成纤维细胞是ECM的主要生产者。在癌症发展过程中,正常ECM表型向癌性ECM表型转变。在这个过程中,ECM经历了生长因子和酶水平的重塑,由于这种重塑,肿瘤中会出现更多的纤维化和硬化ECM。ECM向癌症表型的转化是肿瘤发展的关键过程,其促进细胞生长和存活、转移和癌症相关细胞的募集,并调节免疫反应。
缺氧增强了ECM的重塑,成为肿瘤结缔组织形成的驱动因素,这是一个复杂的过程,包括ECM的降解、组成和结构变化,产生纤维化和更硬的ECM。基底ECM膜的降解在缺氧中增强,它的降解是肿瘤进展的关键,促进局部组织侵袭和肿瘤转移。此外,缺氧增加MMPs分泌,通过HIF信号传导诱导基底ECM膜降解。
缺氧条件下ECM组成和结构的变化是由COL、FN和透明质酸(HA)的沉积和交联增加驱动的。ECM纤维的数量和交联增加ECM硬度并诱导纤维化。从机制上讲,纤维化通过增强整合素机械力感应促进癌症的发展和扩散,该途径激活EMT转变,导致高ECM硬度、纤维化和转移增加。ECM蛋白(如COL、FN、HA)的沉积增强不足以诱导纤维化,ECM交联酶如LOX是使ECM变硬所必需的。
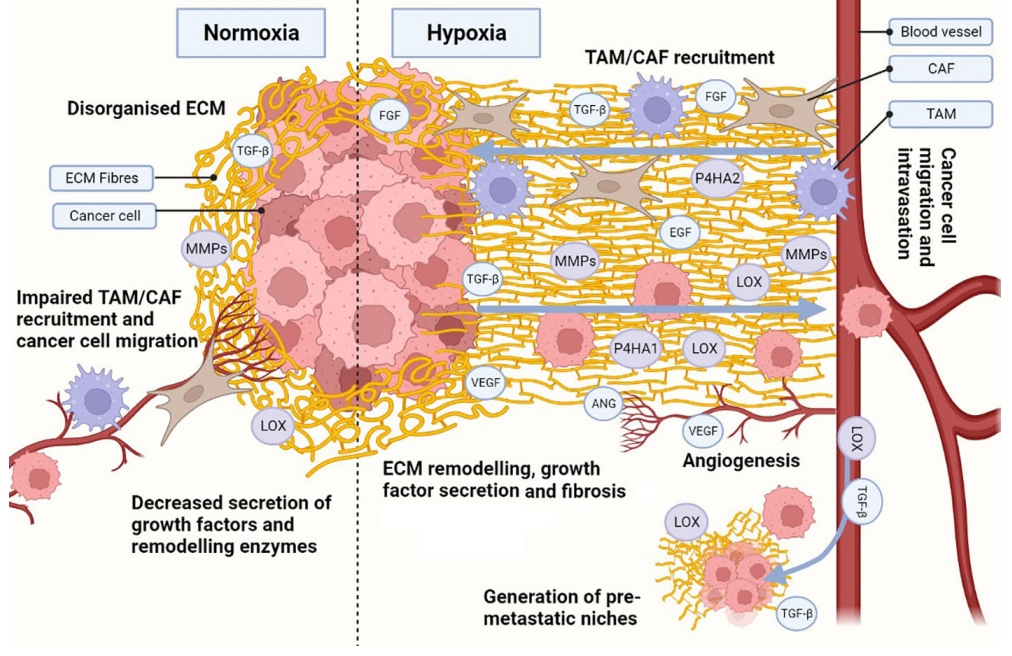
缺氧还诱导生长因子和细胞因子的分泌,这些生长因子和因子也因ECM重塑而释放,从而建立协同效应。生长因子如TGF-β、EGF、FGF的释放不仅促进癌细胞的生长和存活,而且促进CAFs和肿瘤相关巨噬细胞(TAMs)的募集。TAMs和CAFs参与生长因子的分泌、ECM重塑和COL/FN沉积,增加协同效应。在缺氧应激下,血管生成通过分泌血管生成生长因子,如VEGF、ANG而被激活。血管生成过程允许新血管的发展,在这个过程中增强ECM的重塑。此外,缺氧ECM提供了将细胞引导向血管并增强血管内浸润的迁移,促肿瘤生长因子和酶(如TGF-β、LOX)可以进入血管内并传播到远处的健康组织,通过ECM重塑产生转移前的生态位。这增强了癌细胞的迁移和浸润,使它们能够进入循环并最终在转移前生态位定植,并培育新的肿瘤细胞。
缺氧与CAFs
CAFs是TME内的一种基质细胞,它们可以来源于不同的细胞类型,包括常驻成纤维细胞、间充质干细胞、周细胞、平滑肌细胞、内皮细胞、上皮细胞、纤维细胞、星状细胞和脂肪细胞。CAFs被多种信号分子激活,包括TGF-β、IL-1β、PDGF、ROS、SDF1、SHH、HDGF和FGF,这些信号分子可以由癌细胞和基质细胞分泌。CAF激活可在缺氧条件下介导癌症进展,HIF/TGF-β激活调节ECM重塑、免疫反应、代谢重编程、血管生成和转移。
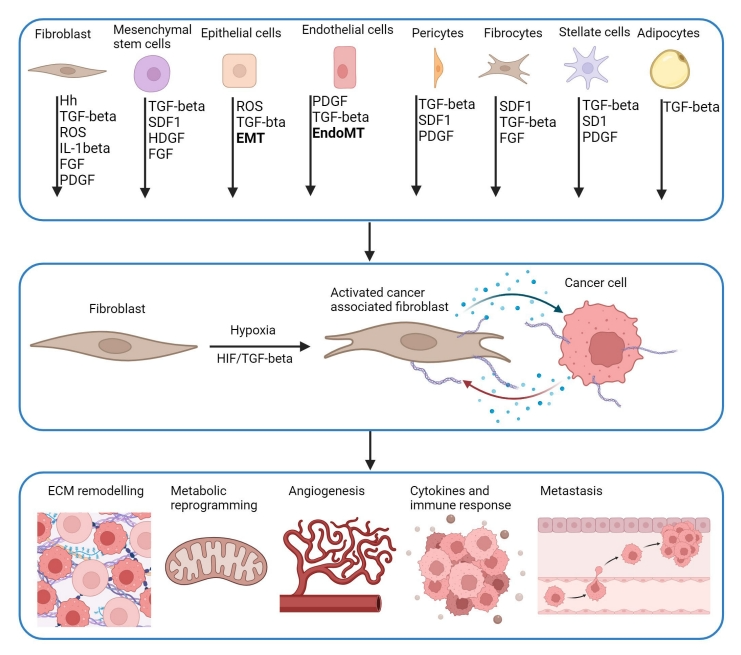
CAFs可与多种TME细胞相互作用,并对肿瘤生物学产生重大影响,包括血管生成、侵袭、免疫逃避、转移和耐药性。缺氧可以改变CAFs的表型和功能,调节TME不同细胞之间的串扰。由于其在TME中的重要作用,促肿瘤CAF被认为是癌症的潜在治疗靶点。
缺氧与免疫细胞调节
在TME中具有多种浸润的免疫细胞,包括CD8+T细胞、CD4+T细胞,Tregs、自然杀伤细胞(NK)、TAMs和树突状细胞(DC)。缺氧可以通过调节包括免疫细胞激活、浸润和功能在内的关键过程来抑制抗肿瘤免疫反应。缺氧诱导的免疫调节可以通过直接和间接机制发生,包括细胞因子和生长因子的变化、免疫检查点分子的表达和代谢活性。
对T细胞的调节
T细胞(CD8+和CD4+)是适应性免疫系统的重要组成部分,通过各种细胞毒性活性在消除肿瘤细胞中发挥关键作用。有证据表明,缺氧通过调节生长因子、细胞因子、趋化因子和肿瘤内pH的变化来调节检查点分子的表达和免疫细胞浸润,从而在诱导T细胞功能障碍中发挥重要作用。
VEGF是一种缺氧反应性生长因子,研究发现阻断VEGF通过增加IFN-γ和TGF-β的产生来提高CD8+T细胞的细胞毒性潜力。然而,需要强调对抗VEGF疗法的仔细考量,因为尽管抑制VEGF改善了抗肿瘤免疫细胞表型,但这伴随着缺氧的增加。使用联合疗法可能有助于消除负面副作用的风险。
此外,与低缺氧区域相比,高缺氧区域的Treg浸润增加,颗粒酶B阳性T细胞减少。体外分析表明,缺氧会增加CCL28的分泌,从而增加Treg的迁移。缺氧TME的酸性更强,葡萄糖缺乏,这些代谢变化为Tregs提供了生存优势。同时,其他免疫细胞,包括NK细胞、DC、CD8+和CD4+T细胞的细胞毒性和成熟受到抑制,导致免疫抑制增加。
对NK细胞的调节
NK细胞是先天免疫应答的一部分,其可以在不需要抗原呈递细胞引发的情况下诱导快速且强烈的抗肿瘤活性。然而,在缺氧条件下,NK细胞上PD-L1的表达增加,导致CD8+T细胞增殖减少。此外,缺氧通过减少NK细胞表面受体(即NKp46、NKp30、NKp44和NKG2D)的表达来减少NK细胞对肿瘤细胞的活性。
尽管缺氧降低了与NK细胞活化相关的受体的表达,但Fc-γ受体CD16的表面密度和功能在缺氧下不受影响,这表明缺氧不会影响NK细胞的细胞毒性潜力。与T细胞中的观察结果类似,缺氧在不同程度上影响NK细胞的活性,可能是肿瘤依赖性的、个体依赖性或依赖于缺氧的严重程度。
对髓源性抑制细胞的调节
MDSCs是来源于髓系谱系的免疫细胞,即使在生理条件下也具有强大的免疫抑制活性。缺氧增加肿瘤内乳酸,促进MDSCs的产生,从而降低T细胞和NK细胞的增殖以及T细胞的细胞毒性潜力。
对肿瘤相关巨噬细胞的调节
在肿瘤内,TAMs在血管和无血管基质区域都大量存在。TAMs可以M1或M2表型存在,其中M2 TAMs与促肿瘤潜能相关。缺氧调节TAM的募集、表型和功能以诱导免疫抑制性TME。
缺氧会抑制TAMs的迁移,导致TAMs在缺氧区域内积聚。缺氧区域的乳酸增加诱导M2 TAM表型,缺氧肿瘤分泌的外泌体含有高水平的细胞因子和趋化因子,这些细胞因子和化学因子驱动巨噬细胞募集和M2极化。TAMs向M2样表型的极化诱导IL-10、TGF-β或VEGF的分泌,其抑制T细胞功能,诱导Tregs并促进血管生成,促进促肿瘤微环境。
对树突状细胞的调节
缺氧通过增加IL-10、iNOS和VEGF等因子的产生,降低DC摄取肿瘤抗原的能力,并下调DC分化和激活标记物(包括CD40、CD80和MHCII)的表达。这影响DC处理和呈递肿瘤抗原的能力,减少T细胞引发的免疫原性细胞死亡。此外,缺氧诱导DC增加骨桥蛋白的分泌,骨桥蛋白是一种与肿瘤细胞迁移增强相关的因素。
缺氧与治疗耐药性
ECM、CAFs和免疫细胞都受到缺氧的影响,对化疗、放疗和免疫疗法的耐药性有影响。缺氧可以激活包括PI3K/AKT、MAPK和NFκB在内的生存途径,从而诱导对细胞凋亡和DNA损伤的抵抗。缺氧也是导致放疗反应不佳的一个众所周知的因素。此外,通过激活免疫检查点的表达来抑制免疫应答,它还改变TME内免疫细胞的组成和功能。
对化疗的耐药性
对化疗的耐药性是由多种机制控制的,而缺氧往往会增强这些作用。实体瘤ECM的生物力学和生物物理特性通常会诱导对化疗的耐药性。P4HA1、P4HA2、PLOD1和PLOD-2对胶原的羟基化介导组织硬度,并受HIF-1的调节。在转移性CRC中,ECM硬度的增加受到高度活化的转移相关成纤维细胞的调节,这降低了贝伐单抗的疗效。
缺氧TME的另一个后果是酸化,这通过一种被称为“离子捕获”的机制对治疗产生耐药性。“离子捕获”现象被描述为弱碱被隔离在酸性隔间中,弱酸被隔离在碱性隔间中。这对包括蒽环类和长春花生物碱在内的弱碱药物有影响。此外,研究表明,长期暴露于酸性条件会激活热休克蛋白HSP-27,诱导顺铂耐药性。
细胞周期在调节癌细胞增殖和凋亡中起着重要作用。缺氧TME诱导癌症细胞中的细胞周期停滞或静止。细胞在这些细胞周期阶段被“卡住”,使其对针对快速分裂细胞的化疗不太敏感。慢性低氧与癌细胞中静止状态的诱导有关,其中细胞暂时可逆地停滞在G0期,这与更具侵袭性的肿瘤表型有关。
DNA修复途径的失调与癌症的发生和发展有关。缺氧增加DDR蛋白,通过下调BRCA1、BRCA2和RAD51减少同源定向修复,减少错配修复蛋白MLH1、MSH2、MSH3,并下调碱基切除修复因子,包括APE1、OGG1和MYH。这些机制在化疗治疗的缺氧肿瘤中很活跃,往往容易产生耐药性。
对放疗的耐药性
氧气是影响实体瘤放疗反应的一个重要因素。研究表明,当照射时氧分压低于20mmHg时,细胞对辐射损伤具有抵抗力。当肿瘤被辐射靶向时,它们吸收辐射并直接或间接产生高反应性自由基。所产生的自由基是不稳定的,并且与氧气高度反应,从而对目标组织造成损伤。辐射通过产生ROS和诱导细胞凋亡来诱导DNA损伤。因此,肿瘤中氧气的存在通过增加ROS的产生和抑制DNA修复来增强辐射的效果。
了解缺氧TME对于优化放疗效果至关重要。缺氧改变了辐射的有效性,需要对缺氧肿瘤给予更高的剂量,但这可能导致副作用增加。包括改变分级、剂量递增和高线性能量转移(高LET)辐射在内的方法有助于对抗缺氧的挑战。
对免疫疗法的耐药性
HIF-1α在肿瘤和基质细胞上上调PD-L1,PD-L1的过表达与缺氧性黑色素瘤、结直肠癌和神经胶质瘤对免疫疗法的耐药性有关。在神经胶质瘤中抑制HIF-1α可降低PD-L1的表达并增强免疫疗法的疗效。
小结
缺氧是TME的关键调节因子,在调节癌症的特征、介导化疗、放疗和免疫疗法耐药性方面发挥重要作用。复杂的缺氧TME为鉴定新的治疗靶点提供了机会。因此,深入了解缺氧TME中不同细胞类型之间的复杂相互作用,以及缺氧调节的不同表达模式,有助于开发更有针对性的治疗方法。
参考文献:
1.Tumour response to hypoxia: understanding the hypoxic tumour microenvironment to improve treatment outcome in solid tumours. Front Oncol. 2024; 14: 1331355.

