癌症生物学系列:癌症中的细胞信号网络
时间:2024-06-11 06:00:51 热度:37.1℃ 作者:网络
1 前言
上一章我们了解了细胞表面的受体广泛地接收信号并把信号转导到细胞质内,这一章我们将要探讨这些大部分由生长因子受体发出的信号是如何被加工并整合入细胞质中的。这些信号在加工后大多被传递到细胞核中,在那里它们为细胞增殖提供重要的调控信号。
癌症是一种细胞增殖失控的疾病,我们常常可能会认为癌细胞创建了全新的调控自身生长和分化的方式。然而,事实上,癌细胞和正常细胞利用几乎完全相同的调控网络,癌细胞仅仅对细胞内现有的调控机制稍加改变。它们只稍微调整了一下已有的调控系统,而不是破坏其全部机制或重新组装一个新系统。
从某种意义上来说,癌症确实是一种增殖异常的疾病。但当我们更加深入地了解癌细胞时,我们将会在另一个层面上了解到:癌症实际上是一种信号加工异常的疾病。
2 Ras蛋白的中心位置
细胞对于对于生长因子的不同反应给那些对胞内信号转导感兴趣的人带来了挑战,因为此前对胞内交互信号通路的组织及功能几乎一无所知。经过了大约10年,这些通路慢慢地像一个游戏拼图那样被拼凑起来,故事的主人公就是Ras蛋白。
一个完全未预料到的领域进展揭示了Ras的作用机制。果蝇眼部发育的遗传学研究显示,一系列基因产物对果蝇复眼的光感原件的正常发育起关键作用,其中一个重要的基因被称为Sevenless。研究者发现Sevenless基因编码的蛋白质含有酪氨酸激酶受体普遍存在的结构。
Sevenless的一个下游蛋白是由一个名为Son of sevenless简称sos的基因编码的,密切观察酵母的生化过程,发现Sos蛋白与参与激活核苷酸交换的G蛋白如Ras有关。这些酵母蛋白,通常被称为鸟嘌呤核苷酸交换因子(GEF),可通过诱导G蛋白释放GDP,以便为GTP的结合提供位点。
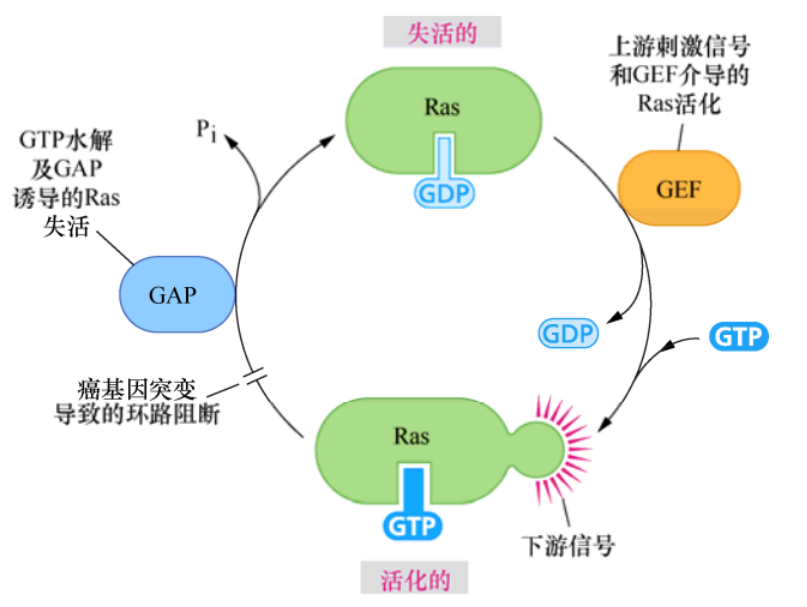
这样便可将这些G蛋白从无活性状态诱导为活化的、可释放信号的构象。而这个精细的反应是Sos作用于Ras之后的结果。因此,Sos就是长期以来寻找的可将Ras转化为活性状态的上游刺激因子,是调控Ras的关键组分。
之后陆续发现了信号级联中的其他中间分子。其中的两个(Shc和Grb2)是通过对磷酸化受体或衍生肽有相互作用的蛋白质,进行遗传和生化筛选而发现的。这些蛋白质的功能是作为接头蛋白,在生长因子受体和Sos之间起桥联作用。
这样,经过遗传和生化数据的糅合,提示人们有这样一条线性信号级联:酪氨酸激酶受体-Shc-Grb-Sos-Ras。
3 SH2和SH3结构域
酪氨酸的磷酸化非常重要,但它是如何激活下游复杂的信号通路的呢?人们提出了2个模型,一个认为酪氨酸磷酸化可以改变蛋白质的构象,使之处于活化状态;而另一种认为酪氨酸磷酸化影响的是下游信号分子的定位,而不是它们的活性。一旦它们重新定位于胞质内的新位点,这些下游分子就可向胞内的其他靶点释放信号。
结果显示,第二种模型,包含蛋白质的重新定位被证明是更加重要的。研究人员发现了3种不同的氨基酸序列结构域,每一种都既存在于Src蛋白中,又存在于其他的无关蛋白质中。这些序列被称为Src的同源结构域1、2、3(SH1、SH2、SH3),对于解开受体信号通路这个谜题起了关键的作用。
Src蛋白的SH1结构域代表了它的催化结构域,SH2结构域作为内部的“受体”发挥作用。SH2受体的配体是一个短肽序列,它包含磷酸化的酪氨酸及其C端一个3-6个残基的特异多肽序列。迄今为止,已发现存在许多不同的SH2结构域,预计人类基因组可编码至少120种不同的SH2结构域。
SH2结构域的相关发现最终回答了酪氨酸激酶受体是如何发出信号的。配体诱导的受体转磷酸作用的结果是受体分子胞内区产生特征性的磷酸酪氨酸残基谱。这些磷酸酪氨酸残基对各种含SH2的胞内蛋白质具有亲和力,于是,在被配体结合激活后不久,一个生长因子受体就被一系列伴侣蛋白——通过SH2结构域结合到其磷酸化酪氨酸残基上所修饰。
由于酪氨酸激酶受体胞内的结构域位于质膜内表面,由受体募集而来的含SH2的蛋白也就贴近质膜。这种靠近使得各种含SH2蛋白可直接与质膜相关蛋白或磷脂相互作用,故而产生一系列生化信号,并通过各种信号级联传递下去。
SH3结构域是Scr蛋白中的第三个序列模板,它能特异地结合伴侣蛋白中的富含脯氨酸序列结构域,这些富含脯氨酸的序列就作为SH3结构域配体来发挥作用。
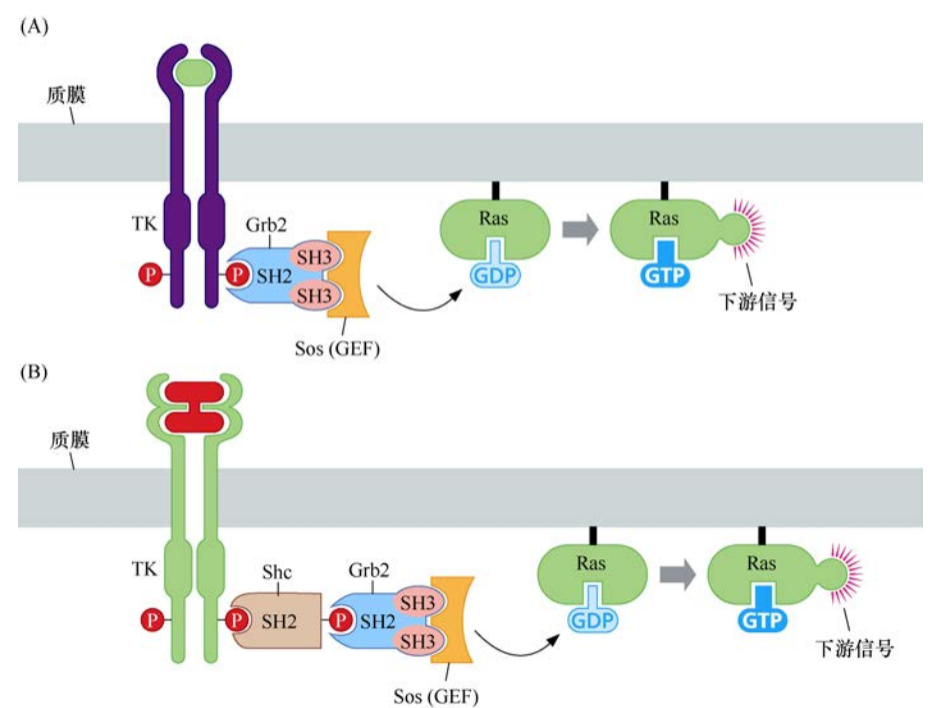
SH2和SH3结构域解释了生长因子受体如何激活Ras并获得信号传递的特异性。Grb2包含两个SH3结构域和一个SH2结构域,它的SH3结构域对Sos中两个不同的富含脯氨酸的序列具有亲和力,而它的SH2结构域则可与众多生长因子激活受体的C端的磷酸化酪氨酸结合。一旦Sos蛋白通过Grb2(或者Grb2和Shc)与受体连接,它与Ras蛋白的距离就会被拉近,而大部分Ras蛋白都被永久性地锚定于质膜内侧。Sos与Ras分子的直接相互作用诱导后者释放GDP并结合GTP。这种鸟嘌呤核苷酸的转换使Ras蛋白通路的信号激活。因此,这条生化通路可显示如下:受体-Grb2-Sos-Ras或者受体-Shc-Grb2-Sos-Ras。
4 Ras调控的信号通路
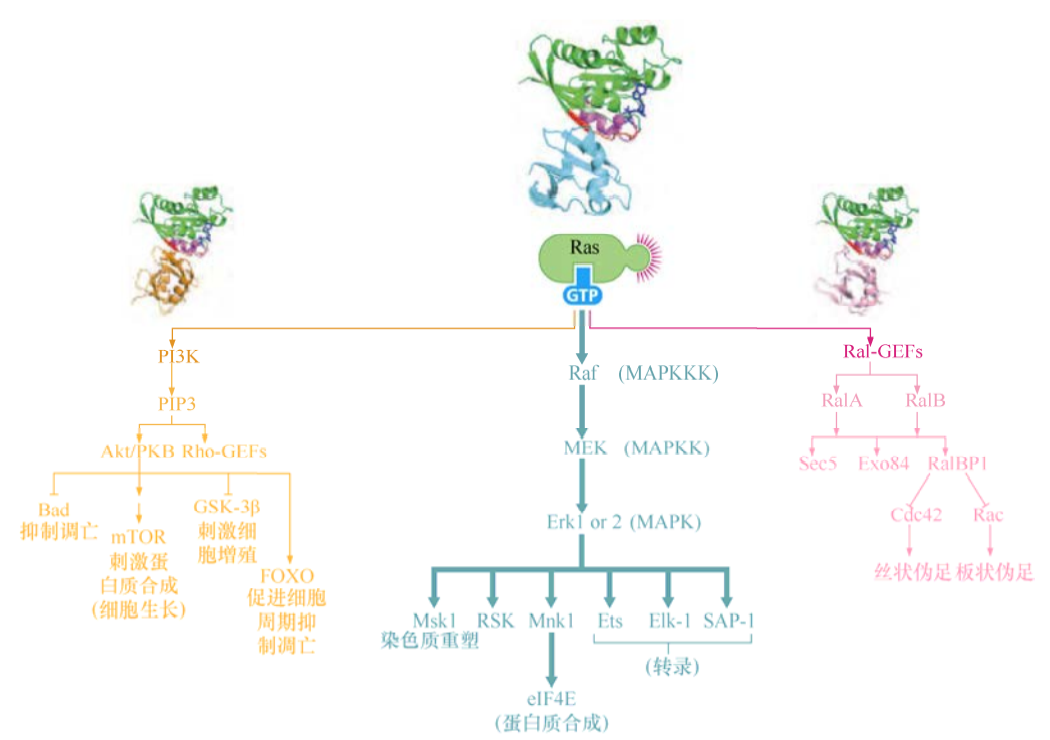
激酶级联
第一个被发现的Ras效应分子是Raf激酶,Raf磷酸化底物蛋白的丝氨酸和苏氨酸残基。Raf活化后通过磷酸化激活第二个激酶MEK。MEK实际上是一种“双特异性激酶”,既可以磷酸化丝氨酸/苏氨酸残基,又可以磷酸化酪氨酸残基。MEK利用这两种功能来磷酸化另外两种激酶,胞外信号调控激酶1和2(Erk1和Erk2)。一旦被活化,每一种Erk都可以磷酸化底物,然后调节包括转录在内的各种胞内进程。
这种激酶信号级联通常称为MAPK通路。实际上,在哺乳动物细胞中存在一系列这样的信号级联。Raf起始的信号级联下游的Erk1和Erk2可以称为MAPK;磷酸化MAPK的激酶通常称为MAPKK,MEK行使这个MAPKK的功能;磷酸化MAPKK的激酶则通常称为MAPKKK,Raf可以认为是一种MAPKKK。
Ras-Raf-MEK-Erk通路只是GTP结合的Ras蛋白活化的下游信号级联之一。这条激酶级联在细胞转化中非常重要,因为在许多种细胞中转导入突变的致癌Raf蛋白激酶时,能够诱导出Ras癌蛋白引起的大部分转化表型。因此,在这些细胞中,Raf通路是Ras癌蛋白转化能力的重要执行者。
PI3K和Akt/PKB激酶
Ras蛋白的另一个重要的下游效应分子是调控肌醇脂类和Akt/PKB激酶,产生的效应就是抑制细胞凋亡,这种抗凋亡的活性对于癌细胞及其关键。
目前已知磷脂的肌醇部分能被几种不同的激酶修饰,在已发现的几种磷脂酰肌醇3(PI3)激酶中,最重要的可能是磷酸化PI(4', 5')P2(又称PIP2)的PI3K。PIP2经PI3K修饰后变成了PIP3。PIP3的肌醇头部在3,4,5位都带有一个磷酸,似乎是磷酸化肌醇最重要的组成基团。许多与PIP3作用的胞浆蛋白都有一个pleckstrin同源(PH)结构域,这个结构域对三磷酸化的肌醇头部有很强的亲和力。
Akt又称为蛋白激酶B(PKB),是一种含有PH结构域的丝氨酸/苏氨酸激酶。PI3K催化PIP3生成一个细胞内含PH结构域蛋白的锚定位点,Akt/PKB激酶一旦通过其PH结构域锚定在细胞膜内表面,Akt/PKB就被其他两种激酶(PDK1、PDK2)磷酸化而激活。
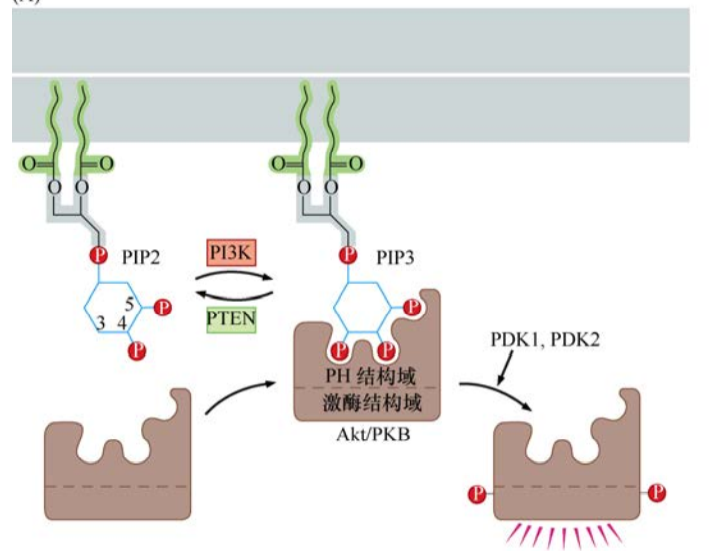
磷酸化激活后,Akt/PKB对一系列的底物进行磷酸化,从而对细胞产生各种各样的效应。
通过Ras同源物Ral进行的调控
Ras下游三大效应通路中的第三条通路涉及一对Ras样蛋白:RalA和RalB,这两种蛋白质与Ras具有58%的序列同源性。同Ras一样,Ral蛋白的功能激活依赖于GTP取代GDP与之相结合。
Ras和Ral之间的信号转导由Ral鸟嘌呤核苷酸交换因子(Ral-GEF)介导,Ral-GEF能促进Ral蛋白释放GDP并结合GTP,这与Sos对Ras蛋白的作用类似。除了它的GEF结构域,每个Ral-GEF还有一个能结合活性状态下Ras的口袋形结构域。Ral-GEF与Ras的结合,使Ral-GEF定位在细胞膜的内表面,而且能引起Ral-GEF构象改变,激活其内在的GEF的活性。RalA和RalB蛋白被激活后,进一步调节信号通路的下游靶基因。
5 Jak-STAT信号通路
造血系统刺激因子受体与大多数生长因子受体略有不同,它们没有共价结合的酪氨酸激酶结构域,而是与Jak(Janus激酶)一类的酪氨酸激酶形成非共价复合物。
由配体结合介导受体发生二聚化后,每个受体分子结合的Jak酶将二聚体中另一个受体分子的细胞质尾部酪氨酸磷酸化,形成的磷酸化酪氨酸吸引并结合含有SH2结构域的转录因子STAT(信号转导和转录激活蛋白)。这些STAT进一步被Jak磷酸化后形成同时含有SH2结构域和磷酸化酪氨酸的单个STAT分子。重要的是,STAT的SH2结构域能够特异性地结合STAT上形成的磷酸化酪氨酸残基,因此形成STAT-STAT二聚体,其中每个STAT都通过其SH2结构域与二聚体中另一STAT的磷酸化酪氨酸相结合。形成的STAT二聚体迁移入核,作为转录因子发挥功能。
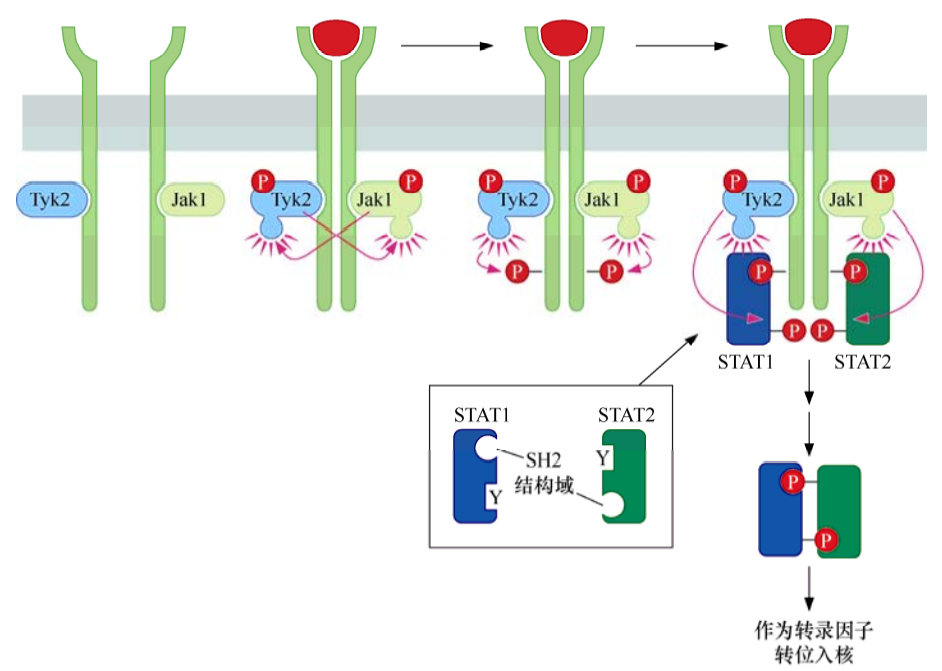
STAT可以激活对细胞增殖和细胞存活及其重要的靶基因,包括如myc、cyclinD2和D3,以及编码强抗凋亡蛋白Bcl-XL的基因等。
有关STAT促进癌症发生发展最生动的例子来自STAT3,在STAT3中插入一对半胱氨酸残基,突变后的STAT3能够自发二聚化并形成共价二硫键从而稳定地交联。这样形成的STAT3突变二聚体作为核内转录因子的作用使组成性激活的,因此具有致癌蛋白功能。
6 其它信号通路
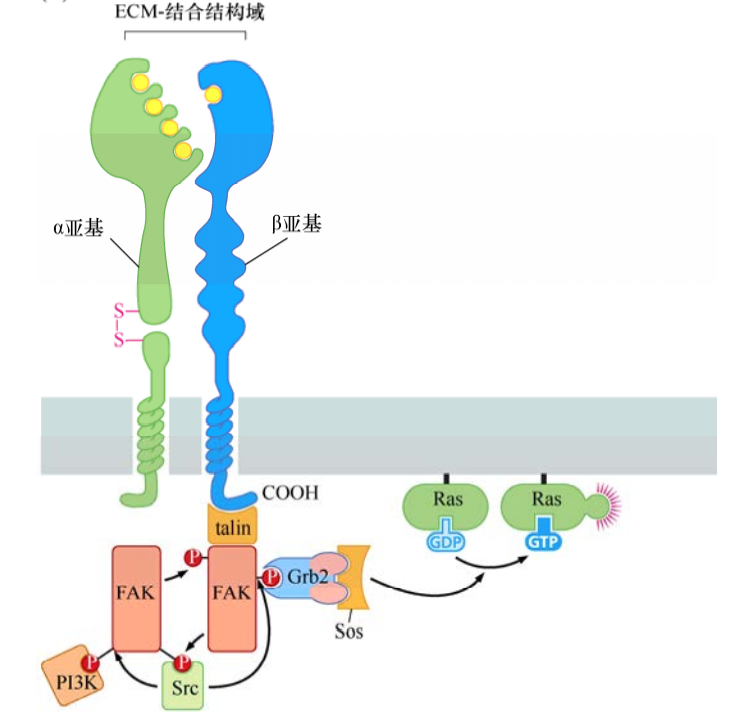
整合素信号转导
整合素由α+β二聚体组成。除了把细胞骨架与细胞外基质连在一起,整合素二聚体的胞外功能区与细胞外基质的结合引发一系列细胞内信号转导蛋白的结合(如黏着斑激酶FAK),结合到β亚基的胞内结构域。由此导致反式磷酸化作用及结合的含SH2结构域信号分子释放出信号,激活配体激活的生长因子受体信号通路。
Wnt-β-catenin通路
如同许多整合素一样,钙黏蛋白是一种跨膜蛋白,与细胞外空间有联系,经中介蛋白与肌动蛋白细胞骨架相连。破坏这种黏附连接会引起肿瘤细胞的高度恶性表型。
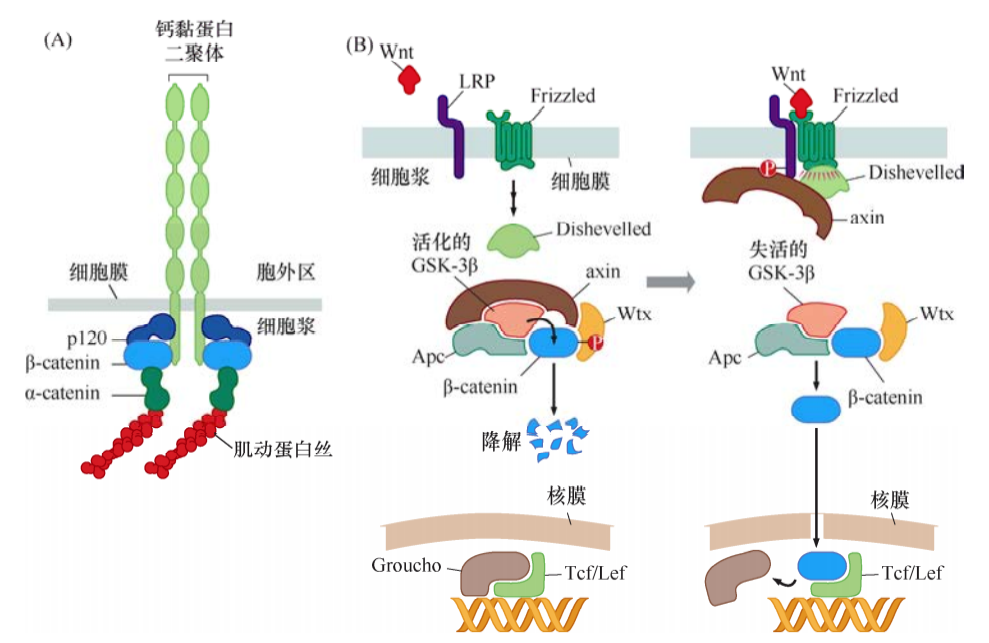
Wnt蛋白通过结合到其Frizzled受体及LRP受体,经Dishevelled作用,抑制GSK-3β的活性,阻止GSK-3β磷酸化包括β-catenin在内的底物。逃脱降解的β-catenin在胞质和胞核里累积,而且一入核,β-catenin便会结合Tcf/Lef蛋白,激活转录。β-catenin和Tcf/Lef形成的转录因子复合物能激活多个重要靶基因,包括那些编码细胞生长增殖相关蛋白的基因,如cyclinD1和Myc。
G蛋白偶联受体
G蛋白偶联受体是一种7次跨膜受体蛋白,可以活化多种异源三聚体G蛋白,它们最大的区别在于Gα亚基。一旦被GPCR所激活,Gα亚基从Gβ和Gγ脱离,进而激活或者抑制胞浆中的酶类。这些酶类再根据细胞类型不同而依次产生促细胞分裂或者抑制细胞分裂的作用。同时,Gβ+Gγ二聚体也可以活化它们下游的效应蛋白,包括磷脂酰肌醇3-激酶γ(PI3Kγ)、磷脂酶C-β(PLC-β)和Src。
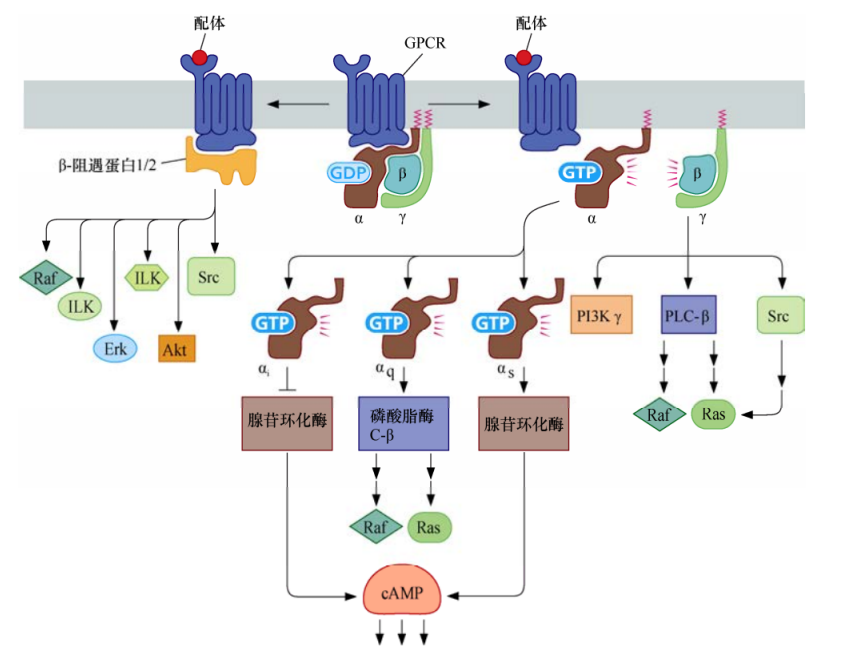
GPCR活化后,另一组受体相关蛋白β-arrestin1和β-arrestin2也开始活化一系列已知在细胞增殖和存活过程中发挥关键作用的激酶。
NF-κB信号通路
人们发现在一类快速转化的火鸡逆转录病毒中的癌基因rel,在B细胞淋巴瘤网状内皮组织增生形成中发挥重要作用。后来在研究调控免疫球蛋白表达的转录因子时发现Rel属于某一类转录因子家族,后命名为NF-κB。这些蛋白质在细胞质中形成同源和异源二聚体。
最常见的NF-κB异源二聚体由p65和p50组成。通常NF-κB被另一个多肽-IκB(NF-κB抑制因子)阻滞在细胞质中。在这种状态下,这个信号系统保持沉默。但是,在接收到某些不同来源的信号时,IκB被磷酸化并迅速降解。结果,NF-κB从IκB的禁锢中解放出来,并移动到细胞核中,进而激活一大批基因,其中包括抗凋亡和促进细胞分裂的基因。
Notch信号通路
这条通路由Notch蛋白调控。关于这条通路的研究可以追溯到1919年,那时人们发现了果蝇的一个等位基因可以引起果蝇翅膀边缘形成凹口(notch)。几十年后,人们又发现了Notch是一个跨膜蛋白。
Notch是一个细胞表明受体,当与配体(Jagged或Delta-like蛋白)结合后经历两次蛋白酶切,一次在细胞外结构域,另一次在细胞跨膜区。后一次的酶切从细胞膜附着处释放出一个大的胞质蛋白片段,这个片段随后移动到细胞核中,与其伴侣蛋白一起作为转录因子发挥作用。
Hedgehog信号通路
当Patched受体与其配体Hedgehog结合时,改变了Patched(Ptc)与Smo的相互作用,结果导致Smoothened与Gli在初级纤毛富集,位置主要在纤毛顶部。
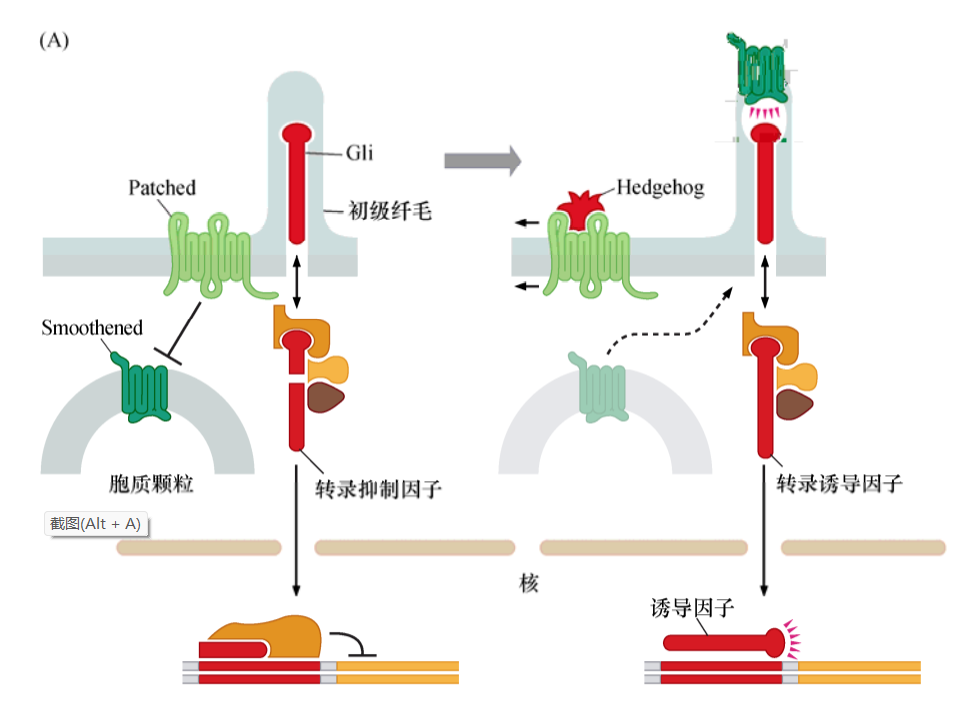
正常状态下,在缺少Smoothened蛋白调节时,Gli前体蛋白被切割为两个片段,其中一段移动到细胞核中,在那里行使转录抑制因子的功能。但是,当Smoothened被活化shi时,Smoothened与Gli在初级纤毛相互作用,Gli前体的切割被抑制,导致完整的Gli蛋白移动到细胞核中,作为转录激活因子发挥功能。
TGF-β信号通路
TGF-β和它所引起的信号转导通路几乎在所以的肿瘤发生中起重要作用,包括肿瘤发生早期TGF-β在多种类型细胞中阻滞细胞生长及在随后的肿瘤进展期影响肿瘤侵袭的表型。
TGF-β结合到II型TGF-β受体,将I型和II型TGF-β受体结合在一起,导致I型受体磷酸化而活化。活化的I型受体磷酸化细胞质中的Smad2或Smad3蛋白,磷酸化的Smad与Smad4结合。最后这种异源二聚体的Smad复合物(由Smad2/2/4、2/3/4或者3/3/4组成)转位到细胞核中,在那里与相邻的转录因子共同作用,驱动或抑制基因的表达。
参考文献:
1. 《The biology of CANCER》second edition. Robert.A Weinberg


