危重症中的对称性周围性坏疽
时间:2024-06-12 18:02:35 热度:37.1℃ 作者:网络
对称性周围性坏疽 (SPG) 是一种致残性并发症,影响一小部分危重病患者。 其发病机制反映了继发于循环性休克(心源性、脓毒症)的易感组织床中促凝-抗凝平衡严重紊乱。 SPG 有一个典型的三联征:(a) 休克(低血压、乳酸血症、正常母细胞血症、多器官功能障碍)、(b) 弥散性血管内凝血 (DIC) 和 (c) 自然抗凝物质耗竭(蛋白 C、抗凝血酶)。 近年来,自然抗凝耗竭的危险因素已被确定,最显着的是急性缺血性肝炎(“休克肝”),至少 90% 的 SPG 患者会出现这种情况。 此外,休克/休克肝的发作和继发于外周微血栓形成的缺血性损伤(“肢体缺血伴脉搏”)之间存在一个特征性的时间间隔(2-5天,中位3天),反映了发生缺血性损伤所需的时间。 肝脏合成的天然抗凝剂严重消耗。 自然抗凝耗竭的其他危险因素包括慢性肝病(例如心源性肝硬化),以及可能输注缺乏凝血因子的胶体(白蛋白、高剂量免疫球蛋白)。 升压药治疗的因果作用尚未得到证实,而且可能性不大,这是因为发生 SPG 的危重患者通常在接受血管加压药治疗至少 36-48 小时后发生,这表明存在时间依赖性的病理生理机制,对这一现象最合理的解释是关键天然抗凝因子随时间逐渐下降,反映了持续的 DIC(“消耗”)、急性或慢性的近期肝病(“生成受损”)以及给与胶体(“血液稀释”)。 鉴于这些不断演变的发病机制概念,可以开发出预防/治疗 SPG 的合理方法。
1.介绍
涉及肢端(远端)四肢的组织坏死是危重疾病的一种罕见并发症,但却是在重症监护病房(ICU)中存活下来的受影响患者显着且永久性发病的一个重要原因。 对于那些遭受涉及多个肢体的重大组织损失的患者来说尤其如此,例如双侧下肢截肢,无论是否失去双手手指。 当坏死主要发生在肢端和双侧时,通常使用术语“对称性周围性坏疽”(SPG); 当还存在非肢端坏死时,使用“暴发性紫癜”(PF) 来描述临床表现。 我们的综述将重点关注 SPG 主题,因为该实体在 ICU 患者中比 PF 更常见; 然而,这两个实体有相当大的临床和病理生理学重叠。
这篇叙述性综述旨在总结当前 SPG 发病机制的概念,强调在血流动力学(循环)休克情况下外周肢体灌注不良的患者促凝-抗凝平衡严重紊乱的作用。 此外,我们将讨论在识别和潜在纠正天然抗凝剂严重消耗方面出现的新问题,包括治疗性血浆置换(以下称为“血浆交换”)的(理论)作用。 我们的综述从新兴论文中讨论了 SPG,这些患者通常观察到三个特征:(a)循环休克; (b) 弥散性血管内凝血 (DIC),以及 (c) 严重的自然抗凝耗竭。 虽然这些因素中的一种或多种在危重患者中很常见,但三种因素同时出现的情况较少见,即“完美风暴”情景,其中这三种因素同时发生,并且达到足够严重的程度, 发生缺血性肢体损伤。
2.示例:缺血性坏死的两个不同阶段
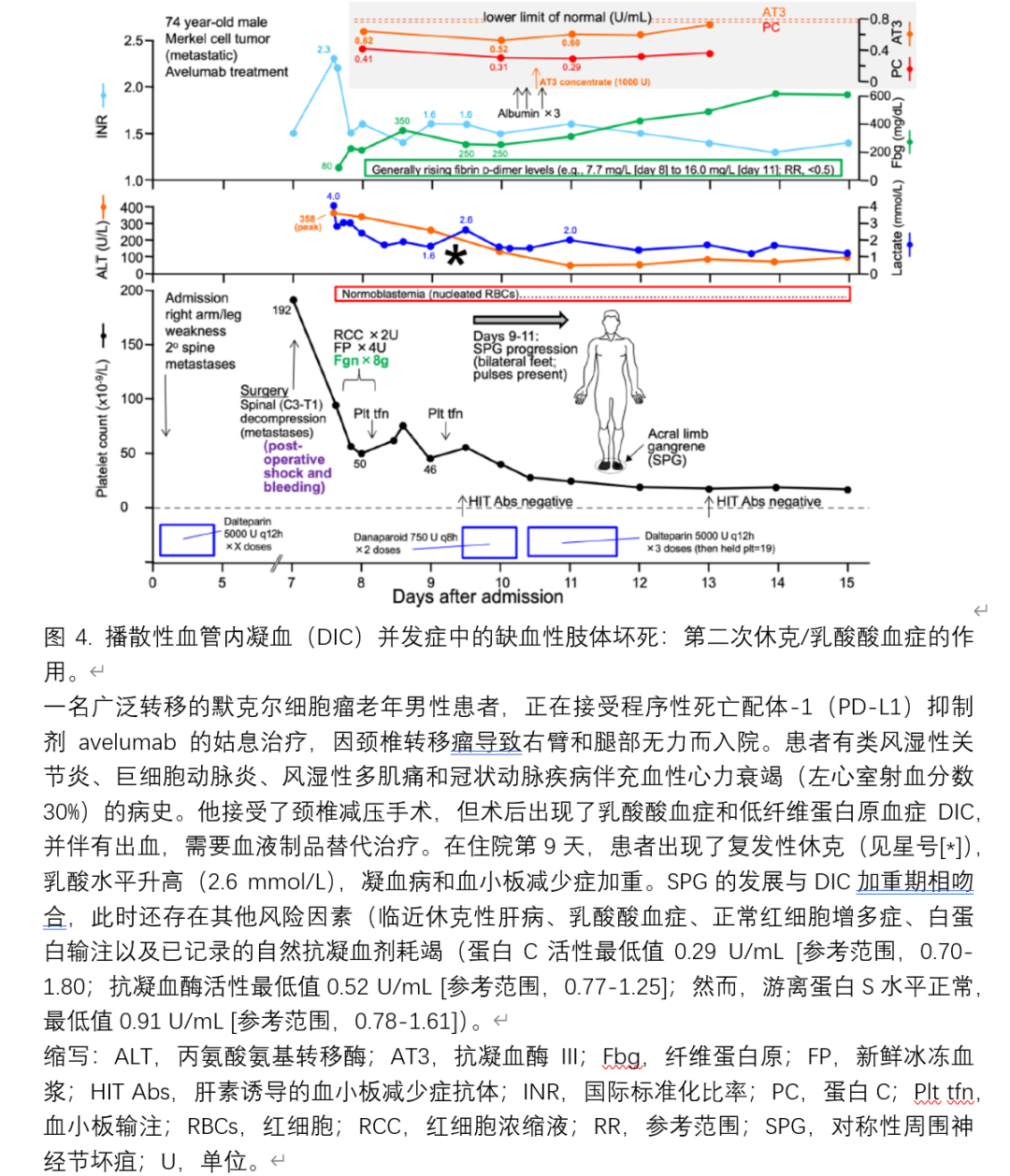
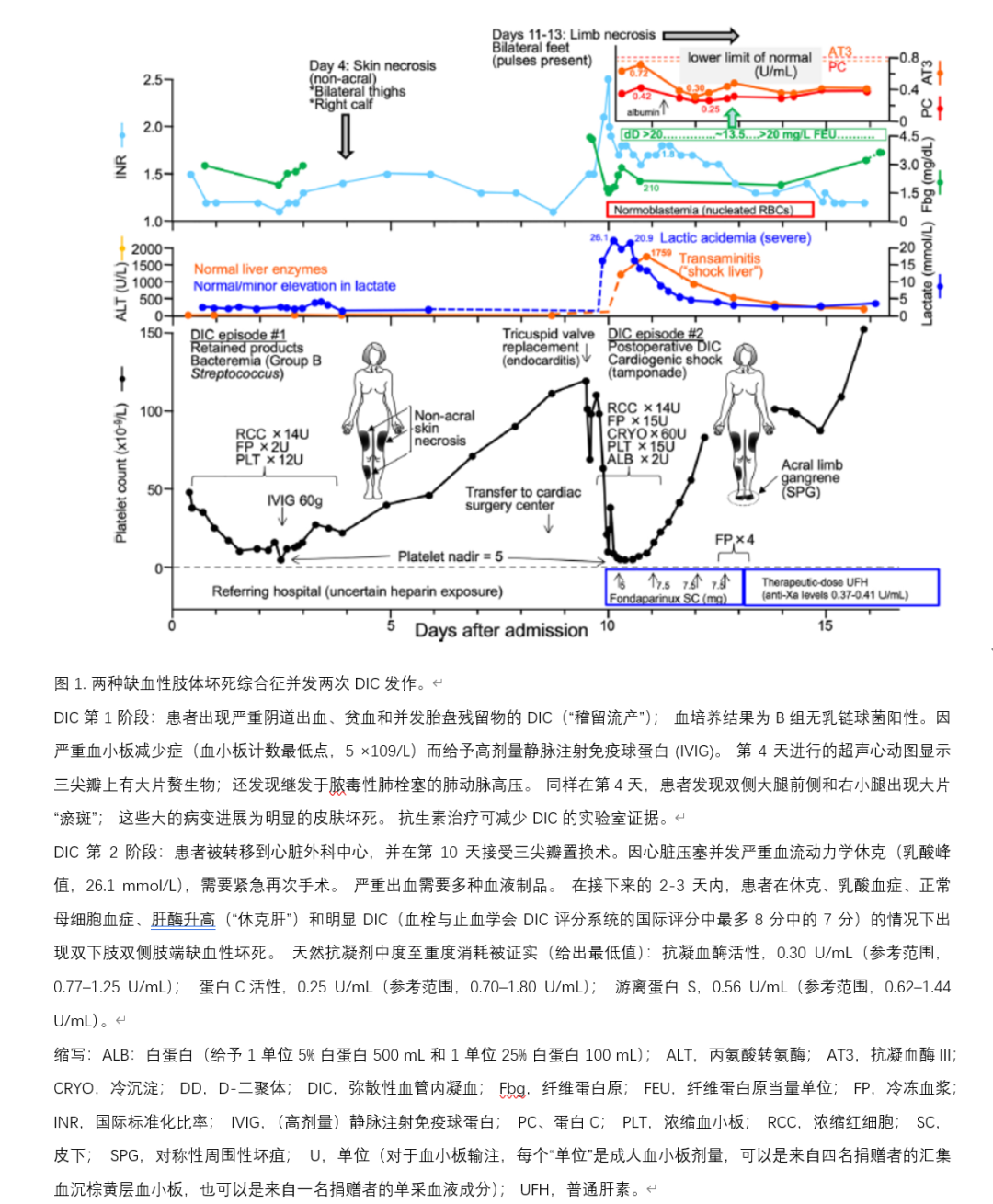
图 1 展示了一个说明性案例,突出显示了 DIC 相关缺血性肢体损伤的令人困惑的特征。 该患者有两次不同的 DIC 发作,第一次与细菌性败血症(胎盘产物滞留)有关,第二次与心脏手术后休克(心包填塞)有关。 缺血性肢体损伤的首发表现为双侧大腿及右小腿三处大片非肢端皮肤坏死。 相比之下,第二次缺血性肢体损伤表现为更传统的 SPG 图像(本文的重点)。 此外,SPG 的发作包括本文讨论的三个特征,即(a)循环性休克; (b) DIC; (c) 与急性缺血性肝炎(“休克肝”)相关的自然抗凝耗竭。 尽管本综述讨论了与患者第二次 DIC 发作相关的概念,但首次 DIC 发作并发非肢端皮肤坏死的病理生理学基础仍然无法解释。
3. 历史视角
3.1. 对称性周围性坏疽和暴发性紫癜
“四肢对称性坏疽”的首次提及归功于英国外科医生Hutchinson。他在他的讲座中向听众介绍了一位37岁的男性患者,该患者的脚趾尖、双耳边缘和指尖均已缺失。这位医生注意到了病变的显著对称性,以及患者从一种未被识别的前驱疾病中恢复过来(“一种急性和意外的疾病……使他卧床二十周”)。
“对称性周围坏疽”这个术语是在1938年由Fishberg提出的,当时他注意到两位患者在“心力衰竭”的情况下发展出这种并发症,作者认为这是“血管痉挛性的原因”,但没有提供临床细节。然而,次年,Perry和Davie——引用了Fishberg的研究——在描述一位64岁的男性患者时再次使用了“对称性周围坏疽”这个术语,该患者在晚期心力衰竭(推测为心源性休克)的情况下表现出明显的界限清晰的肢体坏疽,涉及远端的腿/脚,但没有大动脉阻塞。值得注意的是,尸检显示“肝硬化”,这一观察结果已被证明是有先见之明的,因为最近有证据表明,急性或慢性严重肝功能障碍的发生频率很高,有助于解释大多数SPG病例。Abrahams报告了一例SPG并发持续性致命性室性心动过速的病例,Swan和Henderson描述了两位因心肌梗死并发症发展出SPG的患者,这些病例中常见的致命结果表明存在潜在的心源性休克。尽管随后的文献强调了脓毒症是SPG的常见临床情况,但早期观察到SPG可能并发严重心力衰竭也是值得注意的,根据其中一位作者(T.E.W.)在心脏外科中心工作的经验,在心脏源性休克中至少会出现50%的SPG患者。
“紫癜性坏疽”这个术语更为古老,因为Guelliot使用了“purpura infectieux foudroyant”这个术语(可以翻译为“压倒性的”或“猛烈的”感染性紫癜)。此外,PF(紫癜性坏疽)这个术语似乎被用于感染并发症的背景下,特别是急性脓毒症(分布性)休克。还有两种更为罕见的PF形式——感染后PF(通常发生在猩红热或水痘感染康复后,由于获得了自然抗凝血蛋白的自身免疫清除,最常见的是蛋白S)和新生儿PF(发生在出生后几天内,最常见的是由于严重的先天性自然抗凝血蛋白缺乏,最常见的是蛋白C);这两种情况在这篇综述中将不再进一步讨论。
3.2. 休克和播散性血管内凝血(DIC)
术语“播散性血管内凝血”(DIC)最初似乎由Schneider在1951年提出,当时他描述了三名因胎盘早剥导致纤维蛋白原耗竭和“纤维蛋白栓塞”的患者。随着十年间对各种动物休克和脓毒症模型的研究,人们逐渐认识到这些模型会导致可再现的血管内凝血情况,这一术语的使用也日益增多。Hardaway在1961年总结了休克和脓毒症动物模型所导致的病理生理后果,他在报告中指出:“自1953年起,对几种不同来源的休克进行了研究,本文综述了这些研究,重点放在血液凝血机制的变化以及血液凝血事件的证据上。列出的证据表明,注射不兼容的血液、羊水、凝血酶和内毒素不仅会引起休克,而且会以基本相同的方式改变凝血机制,即纤维蛋白原和凝血酶原的减少以及内源性肝素和纤维蛋白溶解酶的激活。病理变化,无论是肉眼可见的还是显微镜下的,本质上都是相似的。在所有病例中都发现了显微镜下的血栓或毛细血管栓塞。这些变化并不依赖于将外来物质注入血流,因为发现在出血性休克中也有类似的改变”。
Hardaway本人和他的频繁合作者McKay帮助推广了“播散性血管内凝血”这个术语,包括在两本书的标题中使用该术语,第一本由McKay著作(Ratnoff在评论这本书时认为这是“第一次有人试图收集关于这些重要过程的信息”),第二本由Hardaway著作,两本书都超过460页。人们越来越清楚地看到,动物休克和脓毒症模型的病理生理后果也出现在发展出凝血激活、特征性实验室异常以及由于血小板和凝血因子的“消耗”而导致血管内血栓形成和出血的危重病人身上。Corrigan在1968年总结了脓毒症患者所见的实验室变化。一些代表性的报告涉及在已知为“DIC”的情况下发展出SPG的患者,例如Stossel和Levy描述的一例在脾切除后脓毒症期间发展出SPG的患者,通过血小板减少、血清纤维蛋白裂解产物升高和皮肤活检中的纤维蛋白微血栓来诊断DIC;以及Chaudhuri和McKenzie描述的一名儿童,由于基础的DIC(由严重的血小板减少症指示)而出现感染相关的数字坏疽。这些作者在他们的论文结尾写道:“播散性血管内凝血或消耗性凝血病,这是一个相对较新的术语,与病毒疾病有很好地文献记录。”
3.3. 普遍的Schwartzman反应和微血栓形成
Gregory Shwartzman,一位在纽约市西奈山医院工作的医学生物学家,在1928年报告了在正常兔子身上适当时间注射(第一次,皮内;第二次,静脉;间隔24小时)无菌培养滤液(来自革兰氏阴性细菌)的后果,这可再现导致了最初皮内注射部位的皮反应(“局部Schwartzman反应”)。这些研究类似于Sanarelli四年前报告的结果,他报告了两次连续的静脉注射含有内毒素的细菌培养滤液的后果,这导致了包括多个微血管血栓形成在内的特征性全身性凝血病理后果。后续系统性研究由Apitz进行,他进行了两次静脉注射大肠杆菌培养滤液(24小时间隔),进行了详细的组织病理学研究,发现在许多器官床上形成纤维蛋白血栓,特别是双侧肾皮质坏死。Apitz将这一现象称为“普遍的Schwartzman反应”,这个术语获得了广泛接受。正如Robbins和Angell所说:“播散性血管内凝血是人类普遍Schwartzman反应的等同物。”Rappaport和同事报告了一个反映这一观点的SPG病例:SPG并发假单胞菌败血症,实验室证据显示DIC(严重的血小板减少症,凝血功能全部异常,纤维蛋白原减少和凝血因子降低)以及死后证据显示多个微血管血栓,微血栓在肾小球中表现突出。现代对普遍Schwartzman现象的概念是,它反映了先天免疫反应。亚致死的第一次(“准备性”)内毒素注射引发了免疫反应,第二次(“激发性”)内毒素注射触发了致命的全身反应。有趣的是,McKay和Shapiro六十年前就表明,第一次毒素注射触发了血浆纤维蛋白原水平的突然升高,第二次注射导致纤维蛋白原的戏剧性降低。这一发现与观察到只有一次内毒素注射就可以在妊娠兔子中引起致命性改变(具有高基线纤维蛋白原水平)的相关。这些有趣的发现与本综述后面讨论的“高纤维蛋白原DIC”有关,在这种DIC中,患有前驱疾病的患者(导致高纤维蛋白原血症)如果病情发展为明显的、失代偿的DIC,可能会发展出毁灭性的多肢缺血性坏死。Schwartzman现象研究的另一个含义与肝素抗凝血研究有关;适当时间的肝素(在第二次激发反应之前)可以降低致死率。DIC作为解释SPG的关键角色是基于病理学研究显示小血管内非炎症性纤维蛋白沉积(纤维蛋白微血栓)。在20世纪70年代初,系统性高凝血性(即DIC)和SPG之间的联系变得清晰,因为Robboy等人的基础组织病理学研究在 “紫癜、紫癜性坏疽、坏疽、肢端发绀、出血性疱疹”之一或多个的患者中发现了毛细血管和静脉内血栓形成(“皮肤的小血管”)。
当然,以下是您提供的段落的翻译:
3.4. 关于SPG发病机制的共识:休克和DIC(译者注:按照既往惯例,脓毒症仍翻译为败血症)
在1985年,Molos和Hall报告了3例并发于败血症的对称性周围坏疽(SPG),并回顾了以往英文文献中报告的68例患者。这些作者确定DIC是与SPG相关联的“最常见基础病”,至少90%的患者中出现DIC,其中败血症是最常见的基础疾病,而心脏疾病则解释了剩余大多数病例。Knight及其同事在2000年进行了另一项关于SPG的综述。他们的综述指出,两个最常见的特征是:(a) 败血症和/或低流量(译者注应该为低容量)状态,以及 (b) DIC的存在。他们还从新兴文献的角度考虑了SPG,这些文献暗示了血管加压药的作用,但对于血管加压药在败血症休克患者中的作用持怀疑态度,称“血管加压药治疗可能或可能不是败血症患者的一个加剧因素。”他们对临床问题的总结为SPG在新千年之初的情况提供了一个视角:对称性周围坏疽被定义为在没有主要血管阻塞性疾病的情况下,两个或更多部位发生对称性远端缺血性损伤。它发生在患有播散性血管内凝血的败血症患者以及有心脏或低血容量性休克的非败血症患者中。该综合征是毁灭性的且罕见的,对其病因和治疗仍然缺乏相关研究。尽管Knight等人没有明确地将DIC牵连进非脓毒性休克患者的SPG中,但我们的经验是,在心源性休克情况下发展SPG的患者确实表现出明显的DIC。
3.5. 自然抗凝血剂耗竭——三因素中的第三个实体
Knight及其同事的综述推测,在低流量状态下发生的血管闭塞必须有一个或多个未知的解释。作者列出了“血管痉挛”、“微循环中的预先存在的病理”、“血小板或纤维蛋白降解产物的淤滞”以及“尚未定义的免疫学或分子事件”。最后一个实体引导至当前时间,目前强调“免疫性血栓形成”以及关键分子角色的耗竭,即自然抗凝血系统蛋白的耗竭。我们的综述范围不包括“免疫性血栓形成”这一广泛话题,这是由Engelmann和Massberg提出的,以指示免疫系统——特别是血小板、中性粒细胞、单核细胞及其各自的促血栓形成宿主反应,如促凝血血小板衍生微粒的形成、中性粒细胞胞外陷阱(NETs)的形成和单核细胞组织因子表达——在血管内形成血栓作为先天抗菌反应的一部分。实际上,正如本综述其余部分所讨论的,自然抗凝物质的耗竭是与另外两个因素(休克、DIC)一起解释SPG(对称性周围坏疽)发病机制的第三个实体。
3.6. 脑膜炎双球菌血症和(华-弗氏综合征)Waterhouse-Friderichsen综合征中的自然抗凝物耗竭
脑膜炎双球菌血症是SPG和PF的一个突出触发因素,因为脑膜炎双球菌脂多糖在激活止血、纤维蛋白溶解、补体、激肽和细胞因子网络方面异常有效。携带组织因子的微粒有助于DIC发病机制。严重降低的蛋白C活性与皮肤病变(PF)的增加程度相关。尽管在脑膜炎双球菌血症中蛋白C活性水平始终低于抗凝血酶活性水平(以及抗凝血酶水平低于蛋白S水平),但在有皮肤病变的PF患者与那些没有皮肤病变的患者相比,抗凝血酶活性水平也较低。脑膜炎双球菌血症也与内皮功能障碍相关,包括ADAM-10依赖的内皮蛋白C受体(EPCR)的裂解,导致EPCR的“脱落”。在脑膜炎双球菌血症中,内皮功能障碍的假定作用是一个重要概念,因为内皮功能障碍不会通过替代缺失的循环凝血因子来逆转。正如我们在本综述后面部分(见第5.2节 休克性肝病)讨论的,急性肝功能障碍有助于解释大多数SPG/PF患者中(肝脏合成的)自然抗凝物质的严重耗竭;在我们的经验中,发展SPG/PF的脑膜炎双球菌血症患者通常有严重的休克性肝病。脑膜炎双球菌血症在医学文献中也因其与所谓的Waterhouse-Friderichsen综合征的关联而著称,后者由双侧肾上腺出血性坏死的定义。然而,即使在没有肾上腺坏死的情况下,休克也可能并发于暴发性脑膜炎双球菌血症。尽管在任何严重的细菌感染中都可以看到肾上腺出血,就像PF的临床表现一样,显然Waterhouse-Friderichsen综合征和PF在脑膜炎双球菌感染中比其他生物体更常见。矛盾的是,出血的发生似乎是由于肾上腺窦内的纤维蛋白微血栓形成的后果。
3.7. 蛋白C和抗凝血酶基因敲除的动物模型
Safdar及其同事在评估沉默肝脏抗凝血酶和蛋白C产生的效应的动物模型中观察到,当两个基因——而不是仅仅一个——被沉默时,会导致以纤维蛋白沉积和后肢坏死为特征的急性凝血病。作者得出结论,抗凝血酶和蛋白C抗凝血系统之间存在协同作用。在我们看来,这些发现与急性或慢性肝功能障碍的作用一致,这种肝功能障碍导致双重抗凝血剂耗竭,有助于解释SPG的发生。值得注意的是,蛋白C和抗凝血酶的半衰期相当不同(分别大约为8小时和60小时),因此在危重病人中,在休克和DIC发展后出现SPG/PF的“延迟”——通常至少2天——支持了抗凝血酶逐渐耗竭的关键协同作用,此外,人们更广泛认可的是急性蛋白C耗竭在这类患者中的作用。
4. 当前现状:重症医学教科书
我们检查了重症教科书中SPG主题的覆盖情况及讨论方式。我们回顾了4本代表性书籍,并用表1总结了关键特点。这些书籍都没有使用SPG这个术语,而是在讨论PF(紫癜性坏疽)的背景下讨论了危及肢体的坏死问题。所有4本书都特别提到PF的特点是“血栓形成”,其中两本特别评论了“微血栓形成”。所有4本书都强调了PF与脑膜炎双球菌血症之间的频繁关联。在讨论PF时,没有一本书指出血管加压药的任何促成的不良作用。基于我们的综述,似乎一般重症文献还没有将SPG本身识别为由休克并发的DIC(播散性血管内凝血)和自然抗凝剂耗竭导致的后果。然而,当出现额外的非肢端皮肤坏死(即PF),特别是存在潜在的脑膜炎双球菌感染时,DIC和自然抗凝剂耗竭的作用则容易被提出。此外,没有提及肝功能障碍在病理生理学上发挥关键作用。有趣的是,两本书提到血浆置换作为PF的潜在治疗选择,我们将在本综述的最后一节讨论。
相比之下,SPG发病机制的近期概念开始在止血和血栓形成文献中得到认可。例如,在《止血和血栓形成参考》(第4版,Kitchens等人编辑)中,列出的DIC环境中“严重和/或进行性蛋白C耗竭”的风险因素及其后遗症(“紫癜性坏疽”,“可触及脉搏的肢端发绀”)包括:“急性肝衰竭(休克性肝病)”和“慢性严重肝衰竭”。
5. 当前模式:休克、DIC和自然抗凝剂耗竭(消耗、急性和慢性肝病、胶体血液稀释)
我们提出的SPG(对称性周围坏疽)的当前模式重点关注三个因素:(a) 循环休克,(b) DIC(播散性血管内凝血),以及 (c) 自然抗凝剂耗竭见表2)。尽管循环休克和DIC的作用已经得到了很好的确认,但自然抗凝剂耗竭的促成作用尚不明确,原因有几个:首先,在SPG患者中通常不测量自然抗凝血剂水平;其次,除了在潜在DIC状态下预期的“消耗”之外,自然抗凝血剂严重耗竭的解释尚未得到充分研究。然而,自然抗凝剂的耗竭在微血栓疾病中扮演着重要角色,这一点从自然抗凝剂耗竭在其他模仿皮肤坏死综合征中已确定的作用中可见一斑,特别是所谓的华法林(香豆素)诱导的坏死综合征,尤其是被称为“静脉肢体坏疽”的模型中表现明显。在华法林使用导致外周肢体缺血性坏死的高凝血状态疾病中包括:诱导的血小板减少症、与癌症相关的高凝血状态、抗磷脂综合征、感染/脓毒症、心力衰竭/心脏性休克,以及心脏手术后DIC。
5.1. 华法林诱导的坏死综合征中的自然抗凝血剂耗竭和促凝血-抗凝血平衡的扰乱
存在两种明显不同但又有重叠的华法林诱导的微血栓形成综合征:(a) “经典”的华法林诱导的皮肤坏死,以及 (b) 华法林诱导的静脉肢体坏疽。前者(“经典”综合征)通常主要涉及非肢端组织部位,并且经常与蛋白C自然抗凝血途径的遗传性异常相关(蛋白C缺乏,蛋白S缺乏,因子V Leiden,凝血酶原基因突变),而后者(“静脉肢体坏疽”)通常以严重的基础DIC状态为特征,如肝素诱导的血小板减少症(HIT)或转移性腺癌。一个常见的误解是微血栓形成反映了自然抗凝血系统的严重衰竭;然而,关键的概念在于促凝血-抗凝血平衡被打乱,因为维生素K依赖性抗凝剂的耗竭导致无法控制显著增加的凝血酶生成,这反映了潜在的DIC状态。实际上,与华法林过量导致出血的患者(需要紧急纠正的超治疗性INR值)相比,癌症相关静脉肢体坏疽患者的蛋白C活性水平实际上更高;关键的区别在于,静脉坏疽患者的凝血酶生成标志物(例如,凝血酶-抗凝血酶复合物)明显更高(反映了DIC状态),但在华法林过量的患者中基本正常。因此,关键是蛋白C(有时是蛋白S)不足以控制DIC状态。
正如我们在其他地方提出的,华法林诱导的静脉肢体坏疽与SPG(对称性周围坏疽)有几点相似(见表3)。两者都发生在凝血酶生成显著增加的情况下,但最关键的是,华法林诱导的静脉肢体坏疽的特征性时间轮廓,即开始华法林治疗后2-5天发生缺血性坏死,以及已知的肝合成蛋白C和抗凝血酶时间依赖性减少的作用,这表明急性缺血性肝炎在SPG的发病机制中可能扮演类似的角色(后续讨论)。
5.2. 休克性肝病的前驱症状
2012年,有报道一例心脏手术后并发心脏性休克的SPG病例。一个值得注意的特征是在SPG发作前3天出现了休克性肝病。(在该论文中,我们使用了“急性肝坏死”这一术语,而不是“急性缺血性肝炎”或“休克性肝病”,尽管在这种临床背景下这些术语可以认为是同义的)。提出随着时间推移,肝合成的自然抗凝剂减少,导致患者的促凝血-抗凝血平衡严重紊乱,包括纤维单体、D-二聚体和凝血酶-抗凝血酶复合物增加100至200倍;自然抗凝剂蛋白C活性[约1%]和抗凝血酶活性[约20%]显著降低。为了支持这一观点,我们测量了13个促凝血和抗凝血因子,并显示这些水平与因子的半衰期密切相关。
在SPG患者中,休克性肝病的前驱症状是非常常见的发现。2015年,我们报告了15例在危重疾病期间发展为SPG的患者的汇总数据。所有15名患者的肝酶均升高(转氨酶升高),其中14名(93%)患者的丙氨酸氨基转移酶水平至少是正常上限的10倍。此外,明显呈现了一种特征性的时间关系:肢体缺血性坏死的发作在急性缺血性肝炎发作后2-5天(中位数,3天)开始。图2总结了在危重疾病情况下发展SPG的患者的典型临床、实验室和时间上的临床表现。自从认识到休克性肝病前驱症状在帮助解释随后的SPG中的作用,其他研究者最近的SPG论文也对休克性肝病前驱症状的发生进行了评论。
5.3. 慢性肝病
普遍认为慢性肝病会导致获得性出血性疾病。然而,正如Tripodi和Mannucci所指出的,慢性肝病在某些情况下也可能导致促血栓形成倾向。急性DIC(播散性血管内凝血)的危重疾病就是这种情况之一,一个例子是报道的一例由克雷伯菌肺炎引起的SPG并发病例。值得注意的是,该患者仅有轻度急性转氨酶升高,但实际上患有由酒精引起的慢性肝病。尽管没有达到休克性肝病的传统标准,该患者在严重DIC的情况下发展出严重的自然抗凝剂耗竭(抗凝血酶,24%;蛋白C,20%)。有趣的是,在一项回顾20个SPG个案报告的先前研究中,有4例(20%)被注明患有“肝硬化”。如前所述,最早的SPG病例之一(报道于1939年)发生在一个尸检时发现有“心源性肝硬化”的患者。
5.4. 输血
从理论上讲,任何导致自然抗凝剂水平降低的治疗——在易感患者中——都可能导致触发或加剧SPG的风险。最近,我们报告了两例在没有休克性肝病主要作用的情况下发展为SPG的脓毒性休克患者(见图3)。然而,两名患者在发展SPG之前都接受了大量胶体输血(患者1,6单位白蛋白和700毫升大剂量静脉注射免疫球蛋白;患者2,3单位白蛋白)。两名患者的3种自然抗凝血剂水平(蛋白C、蛋白S、抗凝血酶)严重降低,我们提出在这些特定病例中,胶体输血在促进SPG发病机制中可能发挥了重要作用。这些观察结果也对危重病患者进行血浆置换时使用的替代液体类型有影响(见第6节,治疗含义)。
5.4. 胶体
理论上,任何导致自然抗凝剂水平降低的治疗——在易感患者中——都可能增加触发或加剧对称性周围坏疽(SPG)的风险。最近,我们报告了两例在脓毒性休克情况下发展为SPG的患者,其中并没有休克性肝病的显著作用(见图3)。然而,在这两名患者发展为SPG之前,他们都接受了大量胶体输注(患者1接受了6单位的白蛋白和700毫升大剂量静脉注射免疫球蛋白;患者2接受了3单位的白蛋白)。两名患者的3种自然抗凝剂(蛋白C、蛋白S、抗凝血酶)水平严重降低,我们认为胶体输注在这些特定病例中SPG发病机制的易发因素中扮演了重要角色。这些观察结果对于接受血浆置换治疗的危重病患者所使用的替代液体类型也具有意义(见第6节,治疗含义)。
一项病例对照研究表明,患有脑膜炎双球菌血症并伴有因子V Leiden突变(一种损害活化蛋白C对因子V进行蛋白水解的突变)的生存患者,其死亡率与对照组相似,但在与紫癜性坏疽(PF)相关的组织坏死风险上却增加了三倍(从7% [14/233]增至21% [5/24])。理论上,因子V Leiden可能是重症患者发生对称性周围坏疽(SPG)的危险因素,尽管据我们所知,这一点尚未被报道或研究过。
5.6. 血管加压药
之前已经发表了反对血管加压药治疗在SPG(对称性周围坏疽)发病机制中起关键作用的论点。这里要强调的一个关键点在图2中进行了总结——它突出了循环性休克发作(和开始血管加压药治疗)与SPG发作之间特有的2-5天时间间隔。这表明存在一个与时间相关的病理生理因素,尤其是自然抗凝剂水平的逐渐降低(例如,由邻近的休克性肝病加剧)。如果血管加压药导致SPG,人们可能会预期肢体缺血会在治疗开始后仅几小时内开始,而不是至少在36-48小时后开始。我们在分析的SPG和PF(紫癜性坏疽)病例中反复注意到的休克发作和血管加压药开始治疗后,随后SPG发作之间的这种特有的时间间隔,也已被其他人观察到。对于血管加压药的致病作用持怀疑态度的,还有其他血栓形成和止血领域的专家,因为通常在接受血管加压药治疗的危重患者中报告的缺血性肢体损伤情况,并没有包括相关的风险因素信息,如DIC(播散性血管内凝血)和急性或慢性肝衰竭的同时发生。
5.7. 其他考虑因素
参与SPG发病机制的三个关键要素——休克、DIC、自然抗凝剂耗竭——正在变得更加清晰。此外,人们也开始认识到自然抗凝剂耗竭的风险因素(急性和/或慢性肝功能障碍、胶体血液稀释)。然而,可能还有其他未被充分理解的病理生理考虑因素,包括例如这些不同病理生理因素之间的时间关系。例如,我们和其他研究者已经注意到,在初始休克期之后,SPG可能暂时与随后的第二次休克发作(或加剧)相关联。例如,图4展示了我们医院最近确认的一例SPG。这例病例的特点是休克(心脏性、乳酸酸血症、正常红细胞增多)、DIC和自然抗凝血剂耗竭的关键三联征(风险因素:休克性肝病、白蛋白输血)。该图还描绘了一个星号(*),表明在乳酸水平二次增加以及血小板计数进一步下降的时间,与SPG的发作相对应。根据我们的经验,许多发展为SPG的患者都有这种休克和/或DIC参数恶化的次级时期。总体概念与“Shwartzman现象”并无不同,后者是动物模型,其中两次适当时间间隔的内毒素注射触发了广泛微血管血栓形成的综合征。类似地,休克、炎症和DIC的初始触发因素(例如,通过快速的脂多糖诱导的单核细胞组织因子表达,以及其他介质)可能有助于随后的SPG发生,特别当1-2天后发生第二段止血激活期时(根据Shwartzman现象,内毒素注射之间24-48小时的时间间隔在导致随后的微血栓形成中是最佳的)。
6. 治疗
初期对称性周围坏疽(SPG)的治疗仍然不确定。尽管某些治疗在理论上可能看起来有益(例如,抗凝血酶和/或蛋白C浓缩物、肝素抗凝、新鲜冰冻血浆输注),但存在重要的实际问题。这些问题包括:凝血物质及时获取的缺乏(因子浓缩物)、实现有效肝素抗凝的困难(在严重血小板减少和凝血病患者中使用肝素存在出血风险、误导性的部分凝血活酶时间(APTT)值,即“APTT混淆”)、容量管理的困难(例如,在少尿性肾衰竭中输注新鲜冰冻血浆)、甚至是病理生理学的缺陷(例如,内皮细胞蛋白C受体(EPCR)和血栓调节蛋白的脱落可能抵消了蛋白C浓缩物的任何益处,因为这种酶原需要内皮细胞激活)。此外,一旦存在病情演变中的微血栓形成的“完美风暴”条件,可能很快就会发生不可逆的多部位微血管血栓形成,因此可能为时已晚,无法进行有益的治疗干预。因此,治疗方法可能更好地针对预防SPG,即识别有风险的患者(例如,DIC、休克、急性或慢性肝功能障碍),即使没有肢体缺血的临床证据也要开始治疗(见表4)。
我们回顾的两本重症教科书将血浆置换列为PF(紫癜性坏疽)的潜在治疗方法。理由包括去除毒素(例如内毒素、有害的促炎细胞因子)和补充缺乏的凝血因子。Rimmer及其同事报告了一项关于血浆置换治疗脓毒症和脓毒性休克的系统评价和META分析。他们共研究了194名患者,只发现了4项相关试验,他们发现主要终点(死亡率)没有差异(RR = 0.83; 95% CI, 0.45–1.52)。实际上,对于“脓毒症伴多器官衰竭”这一指征使用血浆置换的治疗方法被归类为III类(“去除疗法的最佳作用尚未确定。决策应当个体化”),这是基于被分类为II级证据水平的(“弱推荐,中等质量证据”,承认“具有重要限制的随机对照试验”)。在我们看来,从理论上讲,如果将来要设计脓毒症的血浆置换研究,最好在有SPG风险的患者中进行,例如存在持续的血流动力学休克、DIC和自然抗凝血剂耗竭风险因素(如休克性肝病)的患者,并在休克性肝病发作后48小时内开始血浆置换;此外,替代液体应为新鲜冰冻血浆而非白蛋白,以避免加剧自然抗凝剂的耗竭。此外,SPG的发生应该是这些研究中评估的临床相关终点。尽管SPG的发生太不频繁,不足以作为此类试验的主要终点,但它应作为一个重要的次要终点被包括在内。





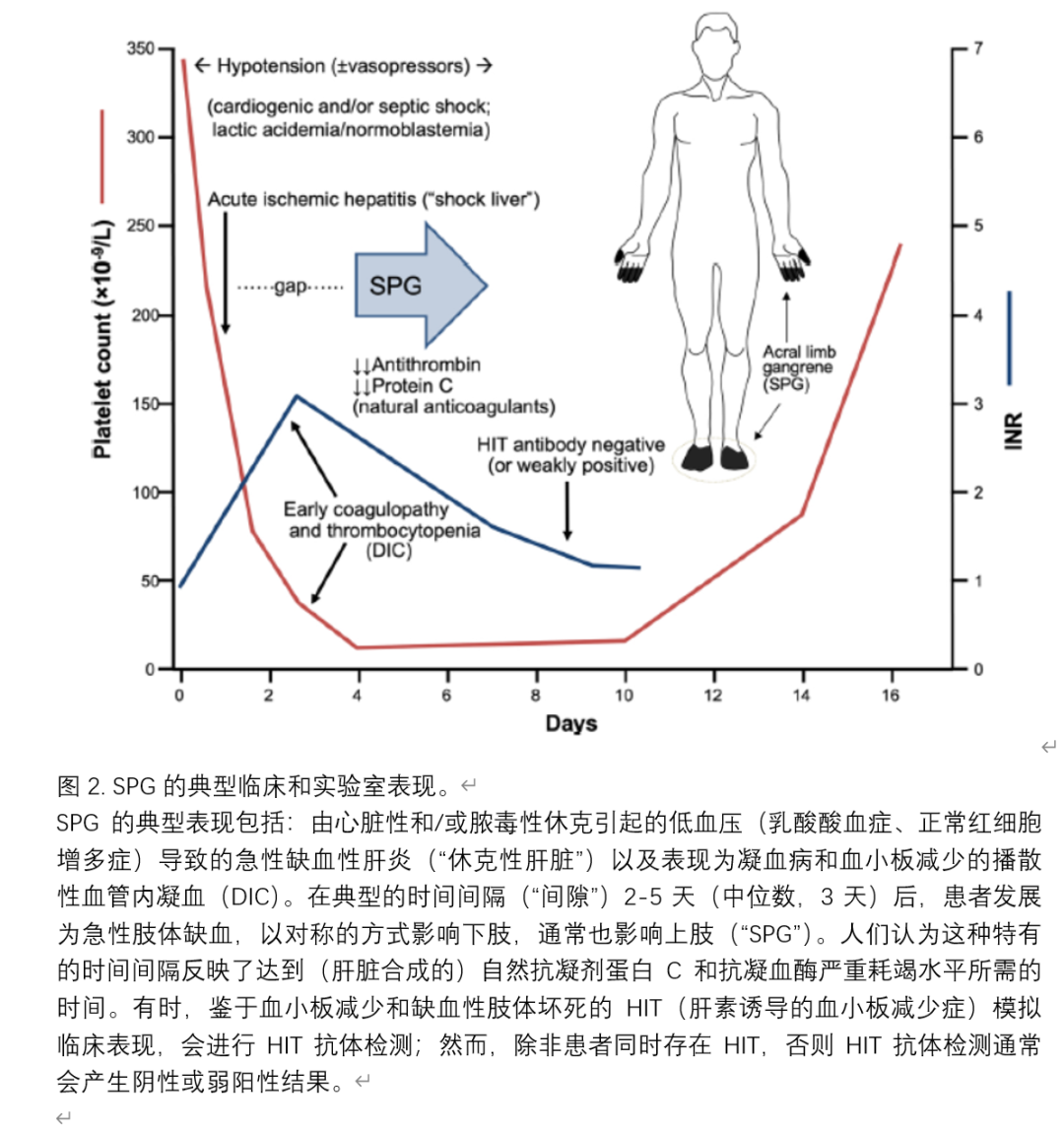
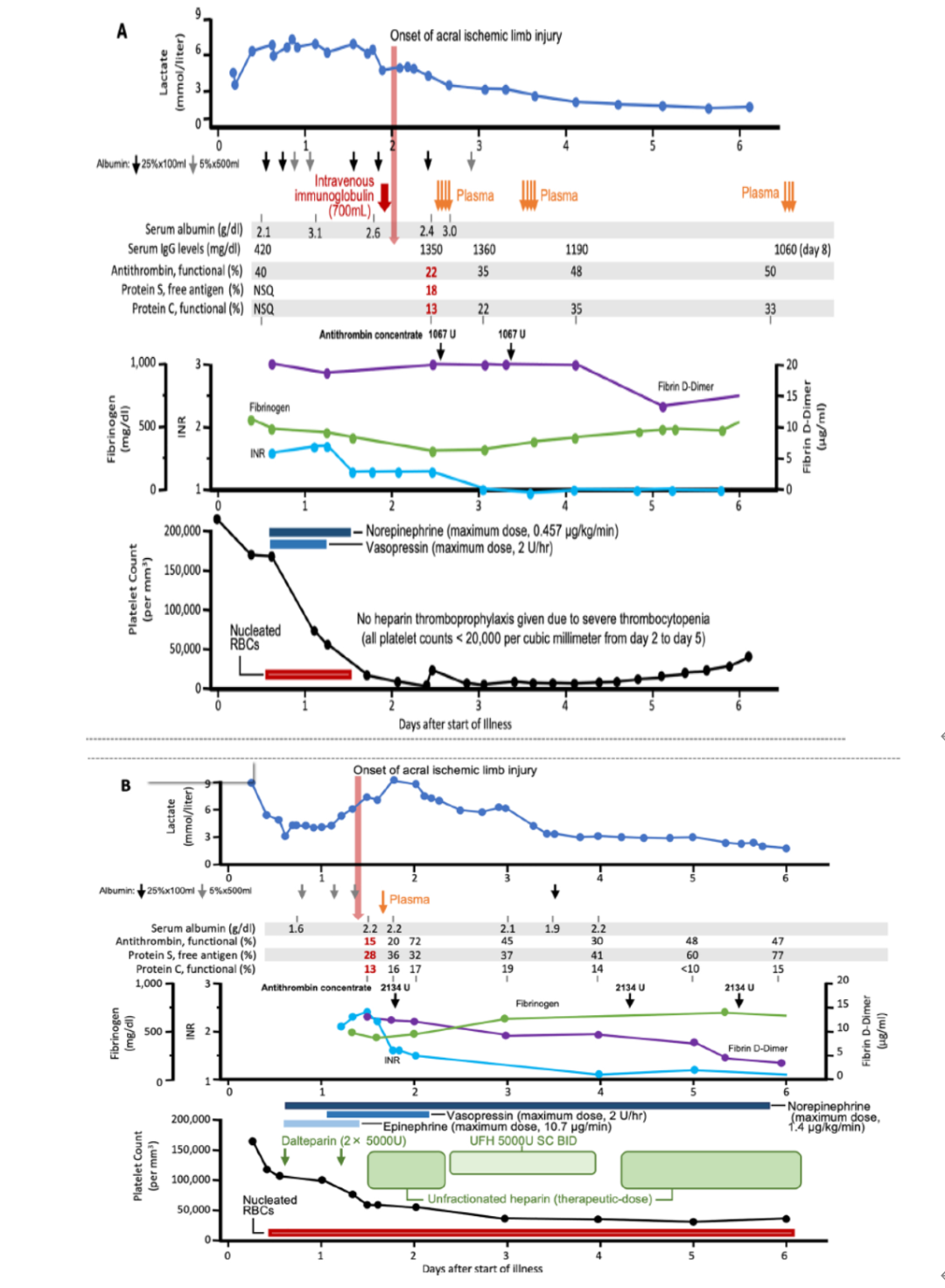
图3. 两名患者在接受胶体输血后的对称性周围坏疽(SPG)。
A 显示了患者1的临床和实验室数据,这是一名45岁女性,因培养阴性杆菌脓毒症和急性肾损伤入院。她符合DIC的标准,有严重的血小板减少和凝血病(峰值国际标准化比率[INR]为1.7;纤维蛋白D-二聚体>20 mg/L)。她的丙氨酸氨基转移酶水平略有升高(峰值69 U/mL)。在双手和双脚发生缺血性肢体损伤后不久,她的三种自然抗凝血剂严重耗竭(以红色显示;参考范围:抗凝血酶77-125%;蛋白S 62-144%;蛋白C 70-180%)。在接受700 mL大剂量静脉注射免疫球蛋白后不久,她发生了缺血性肢体损伤;在肢体损伤发生前36小时内,她还接受了6次白蛋白输注。她最终从脓毒症中恢复过来,但不得不对右手的拇指和三个手指进行了部分截肢。
B 显示了患者2的数据,这是一名38岁女性,因与流感B相关的肺炎入院,病情进展为血流动力学休克和呼吸及肾衰竭。她也符合DIC的标准,有严重的血小板减少(峰值INR为2.4;纤维蛋白D-二聚体13 mg/L)。她的丙氨酸氨基转移酶水平略有升高(峰值44 U/mL)。在缺血性肢体损伤发生后不久,她的三种自然抗凝剂严重耗竭(以红色显示;参考值为Panel A所示)。在接受3次白蛋白输注后不久,她的双脚发生了缺血性肢体损伤,这发生在肢体损伤发生前16小时内。她入院后第21天去世时,脚趾有多个坏死区域。NSQ表示数量不足,SC BID表示每天皮下两次,UFH表示未分离的肝素。