JEV:天津医科大学尹海芳团队发现减轻溃疡性结肠炎的潜在新策略
时间:2024-06-17 06:00:20 热度:37.1℃ 作者:网络
溃疡性结肠炎(UC)临床表现为慢性肠道炎症和菌群失调。虽然生物制剂可以有效地控制炎症,但有效地将其输送到结肠和结肠上皮细胞仍然具有挑战性。乳源性细胞外囊泡(EV)作为一种口服给药工具大有希望,然而,将生物制剂装载到EV中的能力对治疗应用提出了挑战。
2024年6月5日,天津医科大学尹海芳团队在Journal of Extracellular Vesicles在线发表题为“Milk-derived extracellular vesicles functionalized with anti-tumour necrosis factor-α nanobody and anti-microbial peptide alleviate ulcerative colitis in mice”的研究论文,该研究表明抗肿瘤坏死因子-α纳米体和抗微生物肽功能化的乳源性细胞外囊泡减轻小鼠溃疡性结肠炎。该研究证明了将细胞穿透肽(TAT)与绿色荧光蛋白(GFP)融合,可以使生物制剂在体外和体内口服给药后装载到EV中,并防止胃肠道环境中的降解。
与单独给予抗肿瘤坏死因子-α (TNF-α)纳米体(VHHm3F) (EVVHH)相比,经TAT口服载抗肿瘤坏死因子-α纳米体(EVVHH)的EV可显著降低急性UC小鼠的组织TNF-α水平并减轻病理。在慢性UC小鼠中,同时将VHH和抗菌肽LL37引入EV (EVLV),然后口服改善肠道屏障,炎症和微生物群平衡,可缓解UC诱导的抑郁和焦虑。总之,该研究证明了口服EVLV有效地减轻了小鼠UC,TAT有效地将生物制剂装载到EV中,以保护其免受胃肠道降解。这种治疗策略对UC很有希望,是一种简单且可推广的方法,可用于其他疾病的口服给药EV治疗。

溃疡性结肠炎(UC)是一种全球性的健康挑战,其临床表现为慢性炎症、肠道上皮屏障缺陷和肠道微生物群失调,其特征是共生菌群复杂性降低和生态失调。胃肠道炎症、微生物生态失调和肠道屏障结构破坏也被证明会影响UC患者的行为和认知功能。尽管已经开发了许多治疗药物,其中生物制剂被认为具有最大的增长,但通过肠外途径全身施用生物制剂,如抗肿瘤坏死因子-α (TNF-α)抗体可引起不利影响和不便在家给药。口服给药TNF-α抗体的不同技术尝试包括脂质体和聚合物还没有完全克服胃肠稳定性和膜通透性的限制。
细胞外囊泡(EV)作为一种从哺乳动物细胞中释放出来的纳米级囊泡,是一种细胞信使,在诊断和治疗方面受到了广泛关注。最近,牛奶衍生EV作为给药载体受到了广泛的关注,由于其生物相容性、对胃肠道微环境的抗性和可及性,作为胃肠道疾病的口服给药工具显示出独特的优势。然而,与细胞培养的EV不同,酪蛋白是从牛奶中提取EV的主要污染物之一,UC患者通常患有牛奶不耐受,去除酪蛋白对于口服EV的纯化至关重要。尽管已经探索了不同的方法,包括用螯合剂乙二胺四乙酸(EDTA)解离酪蛋白,通过酸化沉淀或超离心,在生产方法上没有达成共识,EV的纯度还有进一步提高的空间。更重要的是,高效的载药,特别是对于蛋白质或肽等生物制剂,是EV面临的最大挑战之一,因此提高纯度和载药技术是EV治疗应用的关键。
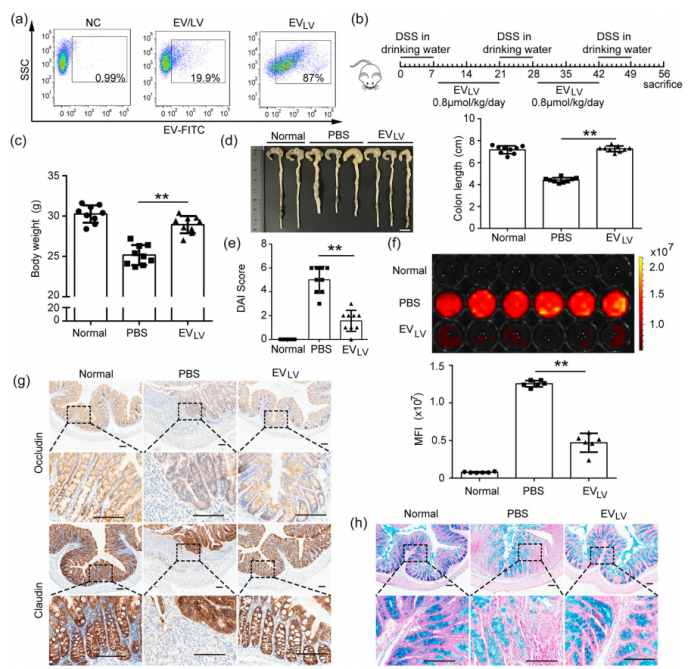
抗TNF-α纳米体和LL37同时负载的EV对慢性溃疡性结肠炎小鼠的影响(图源自Journal of Extracellular Vesicles )
该研究开发了一种基于解离和聚集的纯化和TAT介导的牛奶衍生EV蛋白装载方法。TAT能够有效地将各种蛋白质或肽装载到EV中,并且EV保护蛋白质免受体外和体内胃肠道液体的消化,从而为EV药物的口服利用提供了一个通用的平台,特别是对于易于在肠道降解的基于蛋白质的生物制剂。通过TAT同时负载抗TNF-α纳米体(VHHm3F)和LL37的EV可改善慢性UC小鼠的炎症,诱导表型拯救,改善胃肠道病理和微生物群,从而增强认知功能,证明EV作为UC药物递送工具的潜力。该研究证明了口服EVLV有效地减轻了小鼠UC,TAT有效地将生物制剂装载到EV中,以保护其免受胃肠道降解。这种治疗策略对UC很有希望,是一种简单且可推广的方法,可用于其他疾病的口服给药EV治疗。
原文链接:
https://isevjournals.onlinelibrary.wiley.com/doi/full/10.1002/jev2.12462


