广医/暨大/华工最新AFM:嵌入式3D水凝胶系统非同步给药抑制恶性胶质瘤术后复发并促进神经系统恢复
时间:2024-06-17 12:00:44 热度:37.1℃ 作者:网络
多形性胶质母细胞瘤(GBM)的手术切除常导致肿瘤复发和轻度神经功能缺损。在此,广州医科大学Maojin Yao、暨南大学郭瑞研究员和华南理工大学任娇艳教授等人创新性地开发了一种3D非同步给药系统,以应对GBM复发和术后神经功能缺损的双重挑战。基于对原发性和复发性小鼠GBM组织之间的肿瘤细胞和肿瘤微环境(TME)细胞的转录组分析,作者将mTOR通路抑制与小胶质细胞/巨噬细胞复极相结合,开发了一种新的双靶向方法,。然后,作者构建原位注射甲基丙烯酸明胶(GelMA),使其完美地适应肿瘤切除腔,并实现双靶向药物的直接递送。同时,神经营养因子饱和的3D打印GelMA贴片用于构建3D异步药物递送系统,可使神经营养因子逐渐渗透到底层水凝胶中,以促进GBM抑制后的轴突发芽。值得注意的是,这种3D非同步给药系统在不削弱抑制肿瘤复发功效的情况下促进了神经系统的恢复。因此,本研究不仅提出了一种新的双靶向GBM治疗策略,而且率先构建了用于GBM综合治疗的3D非同步给药系统。相关工作以“Assembled Embedded 3D Hydrogel System for Asynchronous Drug Delivery to Inhibit Postoperative Recurrence of Malignant Glioma and Promote Neurological Recovery”为题发表在Advanced Functional Materials。

【文章要点】
为了探索原发性和复发性GBM中肿瘤细胞和TME细胞之间的差异,作者通过利用肿瘤细胞(人)和TME(小鼠)的种间起源,在免疫缺陷小鼠中建立了原位异种移植物模型,并进行了核糖核酸(RNA)测序。结果显示,哺乳动物雷帕霉素靶向通路基因(mTOR)在复发性GBM肿瘤细胞中显著上调。在复发性肿瘤中,TME内的巨噬细胞从M1(抗肿瘤性)表型转变为M2(促肿瘤性)。这其中,集落刺激因子1(CSF-1)/CSF-1受体(CSF-1R)是巨噬细胞的关键调节因子,而CSF-1在复发性肿瘤中过表达。基于这些结果,作者确定肿瘤细胞中的mTOR通路和TME细胞中的CSF-1/CSF1R信号传导是关键的双重治疗靶点(图1)。
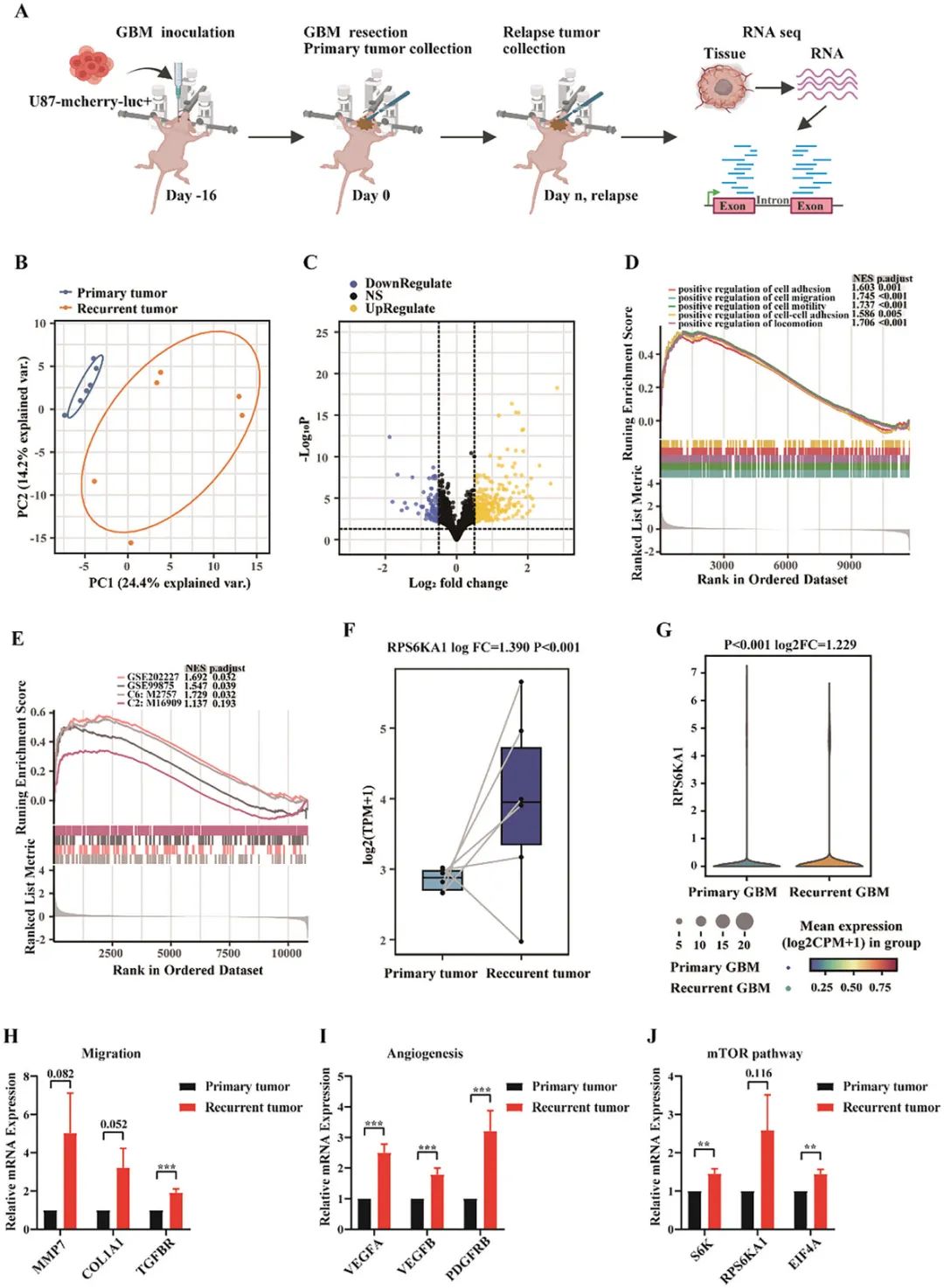
图1 原发性GBM与复发性GBM肿瘤细胞差异表达基因的生物信息学分析
结合双靶向治疗,作者制备了负载PLX5622和替西罗莫司(GelMA/TP)的10%GelMA水凝胶,以对肿瘤细胞和它们生长的支持性环境实现协同作用。动物实验结果表明,GelMA/TP水凝胶不仅增强了对浸润性GBM细胞的疗效,而且显著减少了通常与常规化疗相关的全身副作用。此外,神经营养素,包括神经生长因子(NGF)和脑源性神经营养因子(BDNF),在神经元的正常发育和功能中起着重要作用。因此,作者进一步构建了一种加载BDNF和NGF的3D打印GelMA贴片,以解决GBM手术后的神经后遗症。受海绵结构的启发,作者通过立体光刻3D打印技术制备了具有大孔结构的GelMA水凝胶贴片。将NGF和BDNF滴到冻干贴剂上以制备因子饱和海绵载体。接下来,将因子负载海绵放置在GelMA植入材料上,以缓慢向下扩散神经营养因子。最后,体内实验结果表明,这种新型的3D给药系统可以促进轴突发芽电位,但不影响GBM的治疗(图2)。
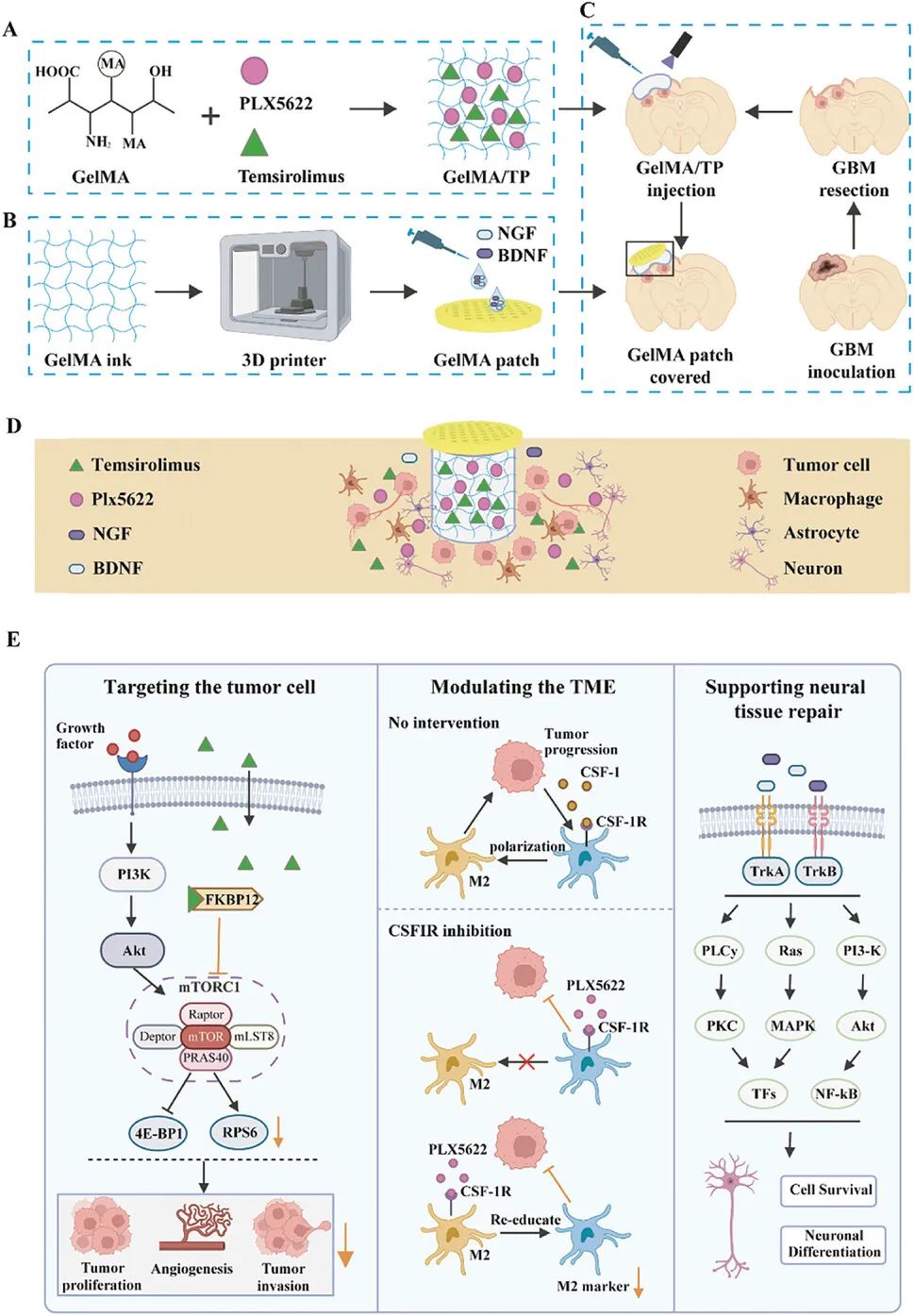
图2 非同步给药3D水凝胶系统抑制恶性胶质瘤术后复发并促进神经系统恢复
原文链接:
https://onlinelibrary.wiley.com/doi/10.1002/adfm.202401383


