天津医科大学贺慧宁教授ACS Nano:脂质纳米颗粒共递送系统,通过铁死亡-凋亡与程序性细胞死亡-配体1下调协同增强抗肿瘤作用
时间:2024-06-17 16:00:35 热度:37.1℃ 作者:网络
对化学药物的内在或后天耐药性严重限制了其在癌症治疗中的疗效。各种细胞内抗氧化分子,特别是谷胱甘肽(GSH),通过减轻由于细胞快速增殖而产生的过量活性氧(ROS),在维持细胞内氧化还原稳态方面发挥着至关重要的作用。然而值得注意的是,这些抗氧化剂还消除了化学药物诱导的ROS,最终减少了它们的细胞毒性,降低了它们的效力。
在本研究中,天津医科大学贺慧宁教授等人将GSH生物合成抑制剂erastin与基于ROS的药物2′-脱氧-5-氟尿苷5′-一磷酸钠盐(FdUMP)联合使用,以有效破坏细胞内氧化还原稳态并逆转化疗耐药性。最终,同时诱导有效的铁死亡和细胞凋亡以增强抗肿瘤效果。此外,作者使用靶向PD-L1的小干扰RNA(siPD-L1)作为第三剂来阻断CD8+T细胞对免疫检查点的识别。erastin诱导的高免疫原性细胞过氧化物或损伤相关分子模式(DAMP)与下调的PD-L1协同作用,增强抗肿瘤作用。总体而言,本研究通过消耗谷胱甘肽和激活适应性免疫,验证了克服临床耐药性的新型策略。相关工作以“Lipid Nanoparticular Codelivery System for Enhanced Antitumor Effects by Ferroptosis–Apoptosis Synergistic with Programmed Cell Death-Ligand 1 Downregulation”为题发表在ACS Nano。

【文章要点】
为了同时有效地对这三种药物进行共递送,作者设计了含有磷酸钙核心的GE11肽修饰的脂质纳米颗粒(LNP)GL-EF@siPD-L1 LNPs,以实现高包封效率。在该纳米制剂中,FdUMP和siPD-L1被封装在核心中,而erastin由于其亲脂性被封装在脂质双层中,最终实现三种药物的有效共递送。体外研究证实了,GL-EF@siPD-L1 LNPs具有增强的细胞毒性、有效的细胞内ROS诱导能力和GSH/GPX4下调、大量的脂质过氧化产物积累和线粒体去极化能力(图1)。
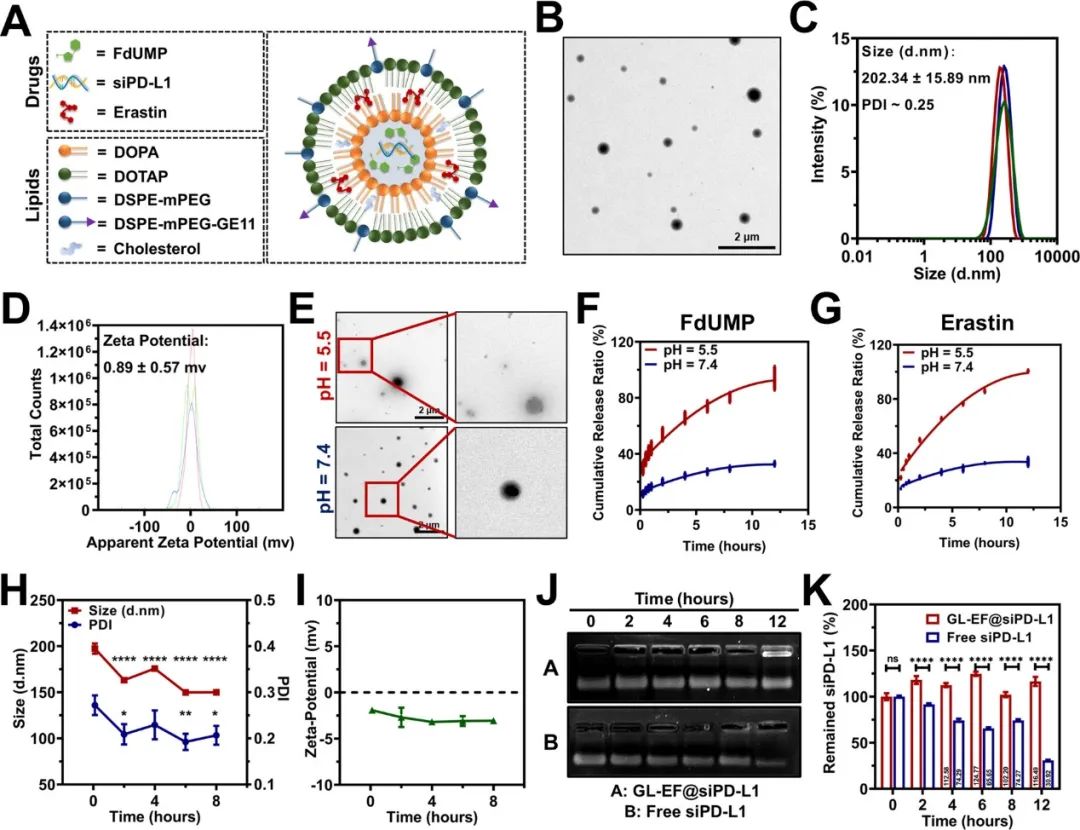
图1 GL-EF@siPD-L1 LNPs
erastin与FdUMP(5-FU的细胞内激活形式)相结合,可有效地打破细胞氧化还原平衡,促进脂质的广泛过氧化;因此,以这种方式实现了有效的细胞铁死亡和细胞凋亡。此外,erastin可以通过抑制GSH生物合成和减少能量供应以抑制药物外排泵(如ATP结合盒亚家族B成员1,ABCB1)来减少药物外排,最终使细胞对FdUMP敏感。除此之外,由于铁死亡,大量高免疫原性DAMP可能被释放;因此,作者进一步利用siPD-L1下调细胞表面PD-L1,以增强肿瘤细胞和CD8+T细胞之间的识别,最终在肿瘤微环境中引发协同的长期抗肿瘤作用。在体内,该制剂在肿瘤部位有效积累,并在皮下结肠癌癌症(CRC)小鼠模型中实现了显著的肿瘤抑制,在相对较低的剂量下,最大肿瘤抑制率为83.89%(图2)。
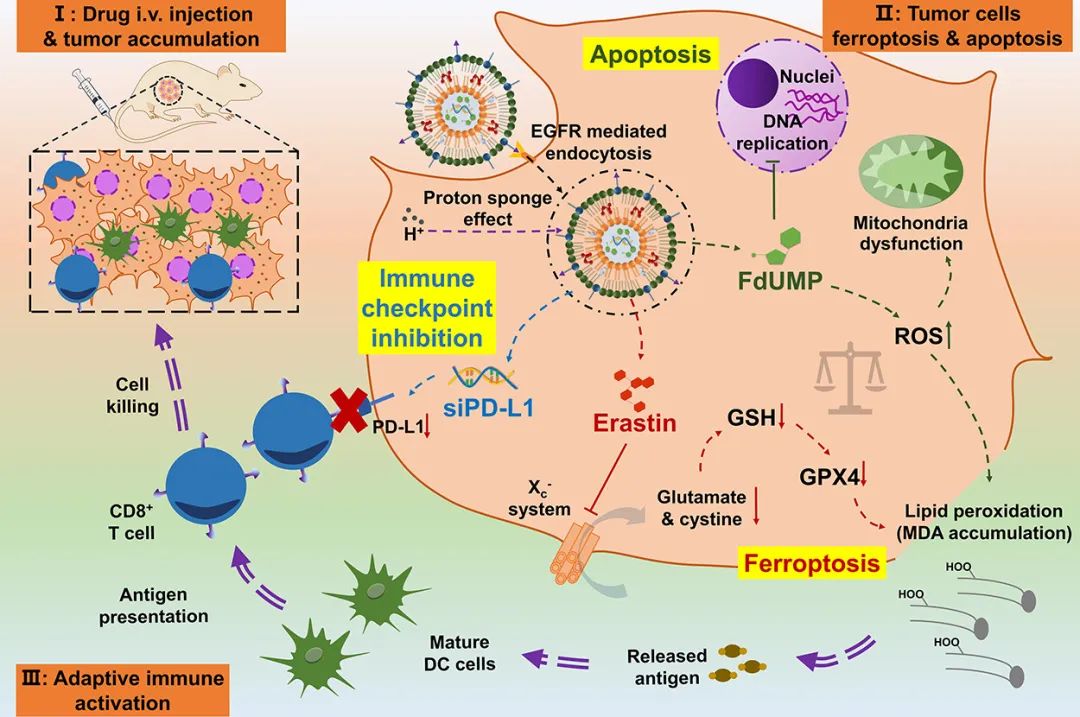
图2 GL-EF@siPD-L1 LNPs发挥协同抗癌作用
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c04901


