【TCT】MD安德森30年间三千例一线自体移植多发性骨髓瘤的结局变化趋势
时间:2024-06-17 16:01:18 热度:37.1℃ 作者:网络
MM自体移植的趋势
一线造血干细胞移植(auto-SCT)是新诊断多发性骨髓瘤(NDMM)患者的标准方案,但随着新药的不断涌现,auto-SCT的作用也受到挑战。MD安德森癌症中心学者评估了单中心1988-2021年三十多年期间共三千例接受一线auto-SCT的NDMM患者特征、治疗和结局的趋势。近日发表于《Transplantation and Cellular Therapy》。

本文要点
·回顾性研究了1988-2021年三千例auto-SCT后NDMM患者的结局
·移植患者的平均年龄和合并症负担随着时间的推移而增加
·过去30年NDMM患者auto-SCT后预后改善,包括高危患者
·中位PFS从1988-2000年的22.3个月改善到2016-2021年的58.6个月
·中位OS从1988-2000年的55.1个月改善到2016-2021年未达到
研究结果
患者、疾病和治疗特征
作者回顾性分析了1988-2021年接受auto-SCT的3041例NDMM患者,分为1988-2000、2001-2005、2006-2010、2011-2015和2016-2021五个时间段,分别有249例、373例、568例、815例和1036例。auto-SCT的中位年龄随着时间的推移而增加,从1988-2000年的52岁增加到2016-2021年的62岁 (p<0.001),1988-2000年只有1%的患者≥65岁,而2016-2021年高达38% (p<0.001)。在已知细胞遗传学的患者中,高危细胞遗传学的发生率从1988-2000年和2016-2021年的15%增加到40% (p<0.001)。R-ISS分期随着时间的推移保持稳定,在整个研究期间,7-11%的患者处于R-ISS III期(p=0.54)。通过HCT-CI测量的共病负担随着时间的推移而增加,1988-2000年17%的患者HCT-CI>3,而2016-2021年为28% (p<0.001)。
诱导方案随着时间的推移而发展,从1988-2000年以传统化疗为主(39%)到2016-2021年以IMiD和PI为基础,74%的患者接受含IMiD-PI的三药 [39%为VRD,35%为KRD] (p<0.001)。1988-2000年,主要的预处理方案包括塞替派、白消安和环磷酰胺(47%),从2000年开始,单药美法兰成为主要的治疗方案,>75%的患者使用单药美法兰。2005年后,白消安和美法兰的联合使用越来越多,在2006-2010年、2011-2015年和2016-2021年期间分别有5%、12%和18%。维持治疗的使用有所波动,在1988-2000年期间有73%的患者接受维持治疗,在2001-2005年下降到30%,从2011年起增加到80%以上。2005年后最常见的维持方案为以来那度胺为基础方案,从2006年起至少77%的患者使用来那度胺。表1总结了患者和疾病特征。
缓解率及MRD
诱导治疗后和移植前的缓解率稳步上升,1988-2000年期间,4%和10%的患者达到≥完全缓解(CR)和≥非常好的部分缓解(VGPR),2016-2021年期间,分别有19%和65%的患者达到≥CR和≥VGPR (p<0.001)。2011年之前MRD检测并不常见,在2011-2015年和2016-2021年,移植前MRD阴性率分别为58%和57%。
移植后第100天的缓解率随着时间的推移稳步增加。在1988-2000年期间,分别有24%和49%的患者达到≥CR和≥VGPR,而在2016-2021年期间分别为41%和81%。移植后最佳缓解率也随着时间的推移而提高,1988-2000年期间分别有33%和53%达到≥CR和≥VGPR, 2016-2021年期间分别有63%和91%。2011-2015年和2016-2021年,移植后MRD阴性率分别为75%和63%。
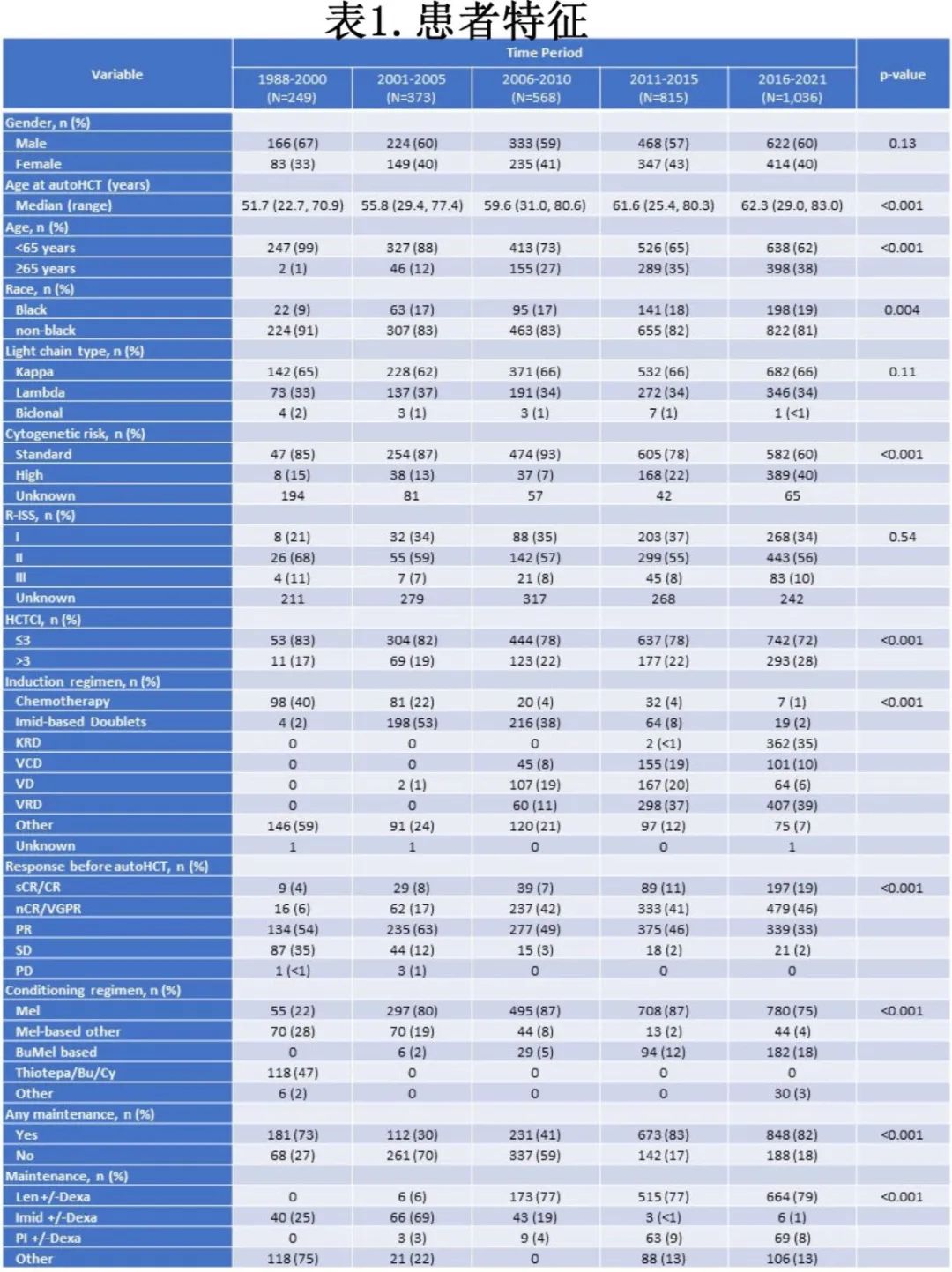
生存结局
整个研究人群的中位PFS为38.3个月,从1988-2000年的22.3个月提高到2016-2021年的58.6个月(HR=0.40)。值得注意的是,近年来高危细胞遗传学患者的PFS也有显著改善,2011-2015年的中位PFS为28.0个月(HR=0.38,p<0.001),2016-2021年的中位PFS为36.8个月(HR=0.32,p<0.001),而2001-2005年仅为13.7个月。此外年龄≥65岁的患者中位PFS也有显著改善,从2001-2005年的33.6个月增加到2016-2021年的52.8个月(p<0.001)。在RISS III期队列中,基于移植时间的PFS无显著差异。
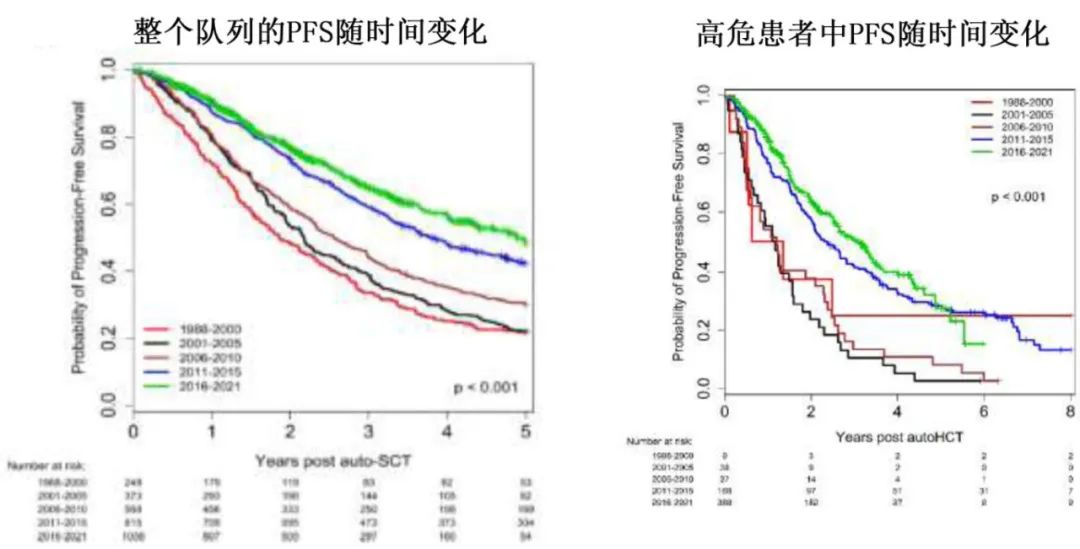
整个研究人群的中位OS为99.4个月,从1988-2000年的55.1个月稳步改善到2016-2021年的未达到(HR=0.31,p<0.001)。对于高危细胞遗传学患者,OS从2001-2005年的中位32.9个月改善到2016-2021年的66.5个月(HR=0.32,p<0.00)。此外对于年龄≥65岁的患者,中位OS从2001-2005年的67.2个月改善至2016-2021年的未达到,差异无统计学意义(HR=0.67, p=0.08)。
第100天,整个队列的NRM为1%。1988-2000年间,第100天NRM为6%,而从2001年起NRM保持在≤1% (p<0.001)。
第二原发恶性肿瘤
在整个队列中,295例患者(9.7%)发生第二原发性恶性肿瘤(SPM),主要包括实体瘤(n=131,44%),其次为非黑色素瘤皮肤恶性肿瘤(n=80,27%);69例(23%)患者发生髓系恶性肿瘤(主要为MDS,n=61),13例(4%)患者发生淋系恶性肿瘤。123例患者(42%)在MM进展后发生SPM, 63例(21%)在MM进展前发生SPM,109例(37%)发生SPM而无MM进展。在单因素分析中,与1988-2000年队列相比,2016-2021年最新队列中移植的患者在2年和3年的SPM发生率有更高的趋势[(HR=3.48,p=0.09)和(HR=2.77,p=0.053)]。在整个随访期间,2016-2021年队列中SPM的绝对风险明显更高(HR=1.72,p=0.038)。但在校正移植年龄后,2年和3年SPM发生率以及整个随访期间SPM的总体风险在不同队列之间相似(p=0.30,p=0.59和p=0.87)。
总结
该回顾性单中心研究纳入3041例MM患者。auto-SCT的中位年龄从52岁(1988-2000)增加到62岁(2016-2021),高危细胞遗传学的发生率从15%增加到40% (p<0.001)。以HCT-CI>3衡量的合并症负担从1988-2000年的17%增加到2016-2021年的28% (p<0.001)。诱导方案从以化疗为主演变为以免疫调节剂和蛋白酶体抑制剂为基础的方案,2016-2021年有74%的患者接受IMiD-PI三药治疗[39%的患者接受VRD, 35%的患者接受KRD]。auto-SCT前的缓解率稳步上升,达到≥CR和≥VGPR的分别为4%和10%,而1988-2000年和2016-2021年期间分别为19%和65%。auto-SCT后第100天的缓解率分别从1988-2000年的24%和49%提高到2016-2021年的41%和81%,达到≥CR和≥VGPR。中位PFS从1988-2000年的22.3个月提高到2016-2021年的58.6个月(HR=0.42,p<0.001)。高危细胞遗传学患者的中位PFS从13.7个月增加到36.8个月(HR=0.32,p<0.001)。年龄≥65岁的患者的中位PFS也从2001-2005年的33.6个月改善到2016-2021年的52.8个月(HR=0.56,p=0.001)。中位OS从1988-2000年的55.1个月改善到未达到(HR=0.41,p<0.001)。2016-2021年间,高危细胞遗传学患者的中位OS从32.9个月改善至66.5个月(HR=0.39,p<0.001)。2001年以后第100天的非复发死亡率≤1%。不同时期移植患者的第二原发恶性肿瘤的年龄校正发生率相似。
总的来说,在过去三十年中,尽管患者年龄和合并症负担随时间增加,但包括高危患者在内的NDMM患者接受一线auto-SCT的缓解深度和生存结局均显著改善。
参考文献
1,Pasvolsky O,et al.Trends in Outcomes After Upfront Autologous Transplant for Multiple Myeloma over Three Decades, Transplantation and Cellular Therapy (2024), doi: https://doi.org/10.1016/j.jtct.2024.06.001
2,Pasvolsky O,et al.The 65th ASH Annual Meeting Abstracts. Trends in Outcomes over Three Decades after Upfront Autologous Stem Cell Transplant for Multiple Myeloma at MD Anderson Cancer Center. Blood 142 (2023) 4962–4964


