最新ACS Nano:通过靶向热休克蛋白90抑制增强磁热疗疗效,揭示胶质瘤治疗中免疫介导的治疗协同作用
时间:2024-06-29 10:01:35 热度:37.1℃ 作者:网络
暴露于磁高温介导的癌症治疗(MHCT)时,由热休克蛋白(HSPs)的产生介导的热应激反应(HSR)诱导降低了肿瘤部位局部热治疗的疗效,因此治疗仍然是一个重大挑战。
在此,印度知识城纳米科学技术研究所Deepika Sharma等人检测了在不同肿瘤微环境条件(2D单层、3D单培养和共培养球体)下MHCT后神经胶质瘤细胞中引发的差异性HSR,以识别下调时可增强MHCT治疗效果的靶基因。MHCT后的基因表达分析显示,与HSP70相比,HSP90得到了上调。因此,为了提高治疗效果,作者研究了MHCT后使用17-DMAG作为HSP90抑制剂的组合策略。这一组合治疗显示了增强的治疗效果,最大限度地导致神经胶质瘤细胞死亡。总的来说,该研究结果表明,MHCT可激活宿主免疫系统,并有效地与HSP90阻断剂协同抑制远处转移肿瘤的生长。相关工作以“Enhancing Magnetic Hyperthermia Efficacy through Targeted Heat Shock Protein 90 Inhibition: Unveiling Immune-Mediated Therapeutic Synergy in Glioma Treatment”为题发表在ACS Nano。

【文章要点】
本文在2D和3D培养模型之间比较了MHCT介导的HSR在细胞活力、氧化应激、细胞完整性以及HSPs、Akt和Caspase-3的基因表达水平方面的作用。此外,还使用共培养的肿瘤球体模型来分析成纤维细胞生成的胶原对MHCT治疗结果的影响。最终,HSP90被确定为比HSP70更好的MHCT潜在靶点,此外,在胶质瘤模型的原发和继发肿瘤部位评估了HSP90和MHCT联合治疗产生的抗肿瘤免疫反应。作者评估了各种细胞因子和炎症标志物的基因表达水平,以验证神经胶质瘤模型中脓肿效应介导的免疫调节的激活。在2D单层、3D肿瘤球体和异种移植物神经胶质瘤模型中,作者还使用17-DMAG以抑制HSP90,从而有效地增加了神经胶质瘤细胞对MHCT的敏感性。对包括白细胞介素、TNF-α、IFN-γ、半胱氨酸蛋白酶-3、Akt和钙网织蛋白在内的各种因素的基因表达的分析表明,MHCT和17-DMAG治疗可快速抑制肿瘤,并在继发性肿瘤部位产生潜逃效应(图1)。
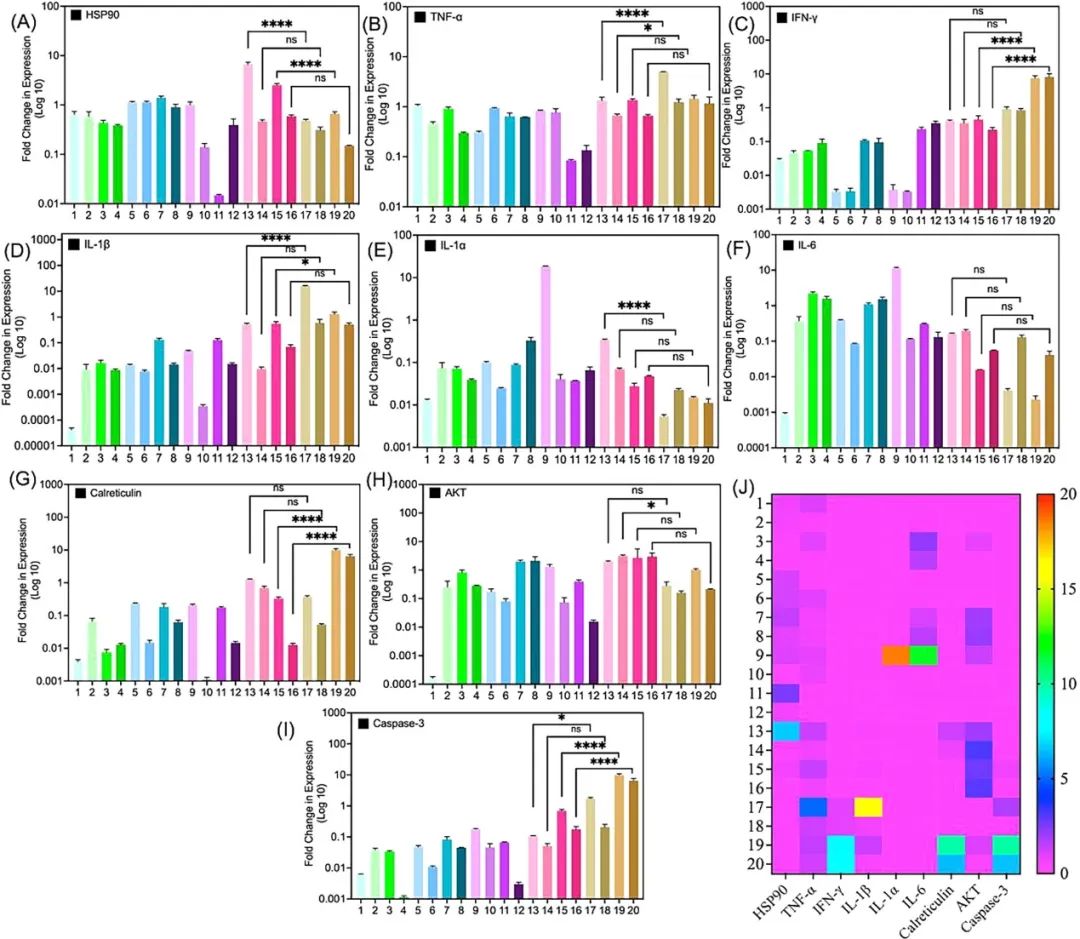
图1 体内基因表达分析
具体而言,在小鼠神经胶质瘤模型中,在MCHT+17-DMAG组的原发和继发肿瘤部位,在8天内分别观察到了65%和53%的快速肿瘤抑制,在MHCT的20天内,潜逃效应介导了两个肿瘤部位的完全肿瘤抑制。从垂死的肿瘤细胞中细胞外释放的HSP90进一步表明,在MHCT+17-DMAG组中,IFN-γ和钙网织蛋白基因的上调支持了免疫反应的诱导(图2)。
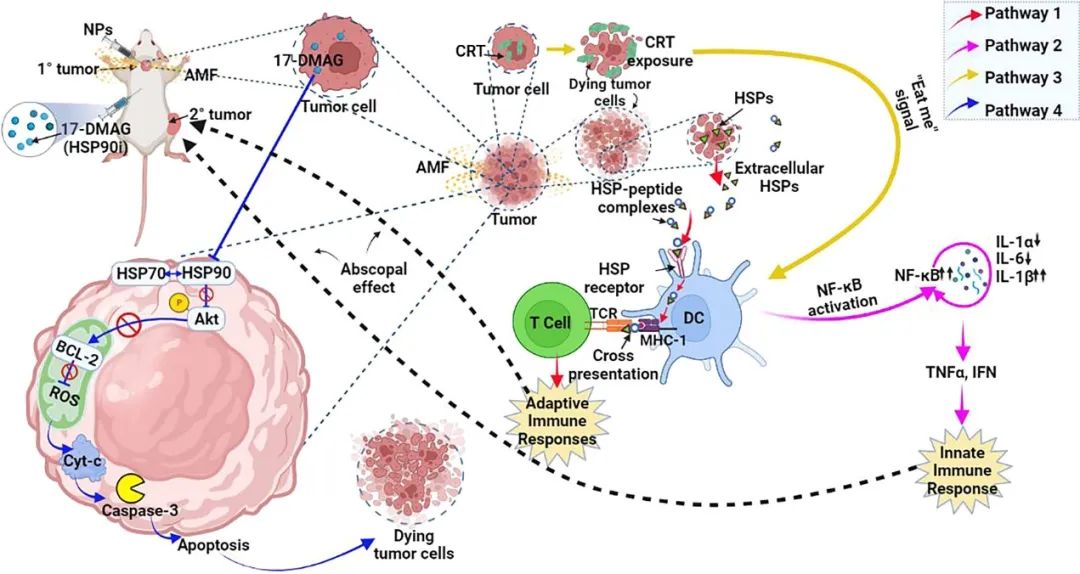
图2 HSP抑制激活抗肿瘤免疫反应示意图
原文链接:
https://pubs.acs.org/doi/10.1021/acsnano.4c03887


