Nature Cancer:结合临床、病理及基因组数据的泛癌免疫治疗预后模型LORIS,可指导临床决策与精准分层
时间:2024-07-01 18:00:28 热度:37.1℃ 作者:网络
近年来,免疫检查点阻断(ICB)方法在肿瘤治疗中取得了重要进展,但大多数患者对ICB治疗无应答,因此需要识别生物标志物来预测哪些患者能从治疗中受益。目前,肿瘤突变负荷(TMB)被认为是预测实体肿瘤ICB疗效的重要生物标志物之一,但其在不同癌症类型中的预测效果不同,无法作为预测所有癌症类型ICB治疗反应的通用生物标志物。
除TMB外,其他与ICB治疗反应相关的临床、病理和基因组特征,如PD-L1、微卫星不稳定性(MSI)等也被用于广泛研究。已有研究尝试将多组学数据的特征集成到单个机器学习模型中,以提高ICB治疗应答的预测能力。但癌症药物反应是一个复杂的过程,很难完全区分应答和无应答患者。评估患者对特定治疗的反应概率具有重要价值,可指导临床医生做出更精确的治疗决策。
近日,美国国立卫生研究院和纪念斯隆凯特琳癌症中心的科研人员在Nature Cancer发表了题为“LORIS robustly predicts patient outcomes with immune checkpoint blockade therapy using common clinical, pathologic and genomic features的文章”。研究团队分析了一个包含18种实体瘤类型患者的大型数据集,综合分析了其涵盖的20多种临床、病理和基因组特征;利用六特征逻辑回归模型,开发了一种名为LORIS的临床评分。
经验证,与先前特征相比,LORIS在预测ICB反应和患者生存方面表现优异,在TMB或PD-L1表达水平低的患者中也能实现有效预测;LORIS可准确预测大多数癌症类型中患者的客观反应以及短期、长期生存。此外,LORIS与ICB反应概率和患者生存期之间呈现出近似单调的关系,可对患者进行精确分层。综上,LORIS是一种准确、可解释的方法,可帮助改善精准医疗临床决策,最大限度地提高患者获益。

文章发表在Nature Cancer
夏日防中暑
研究团队首先收集了来自多个队列2,881名接受ICB治疗患者的数据,共包含18种实体肿瘤类型,并纳入了841名未接受ICB治疗患者(非ICB治疗队列);为评估患者结局,检测三个指标:客观反应、无进展生存期(PFS)和总生存期(OS)。
在多个队列中,研究团队评估了20多种临床、病理和基因组特征,主要包括性别、年龄、癌症类型、ICB药物类别、系统治疗史、TMB、血白蛋白水平和血液粒细胞-淋巴细胞比率(NLR)等;探索了其在泛癌水平上的相关性。结果显示,TMB与体细胞拷贝数改变(FCNA)、年龄呈正相关,PD-L1肿瘤比例评分(TPS)与血小板呈正相关。有趣的是,PD-L1 TPS与FCNA呈负相关,血红蛋白与白蛋白水平存在较强正相关性。
接下来,研究团队基于以上测量特征,使用20种不同的机器学习架构构建ICB反应预测模型。对于每个模型,在训练集上使用五折交叉验证调整最优超参数,随后使用2000次重复的五折交叉验证评估其性能,以确保生成无偏倚结果。
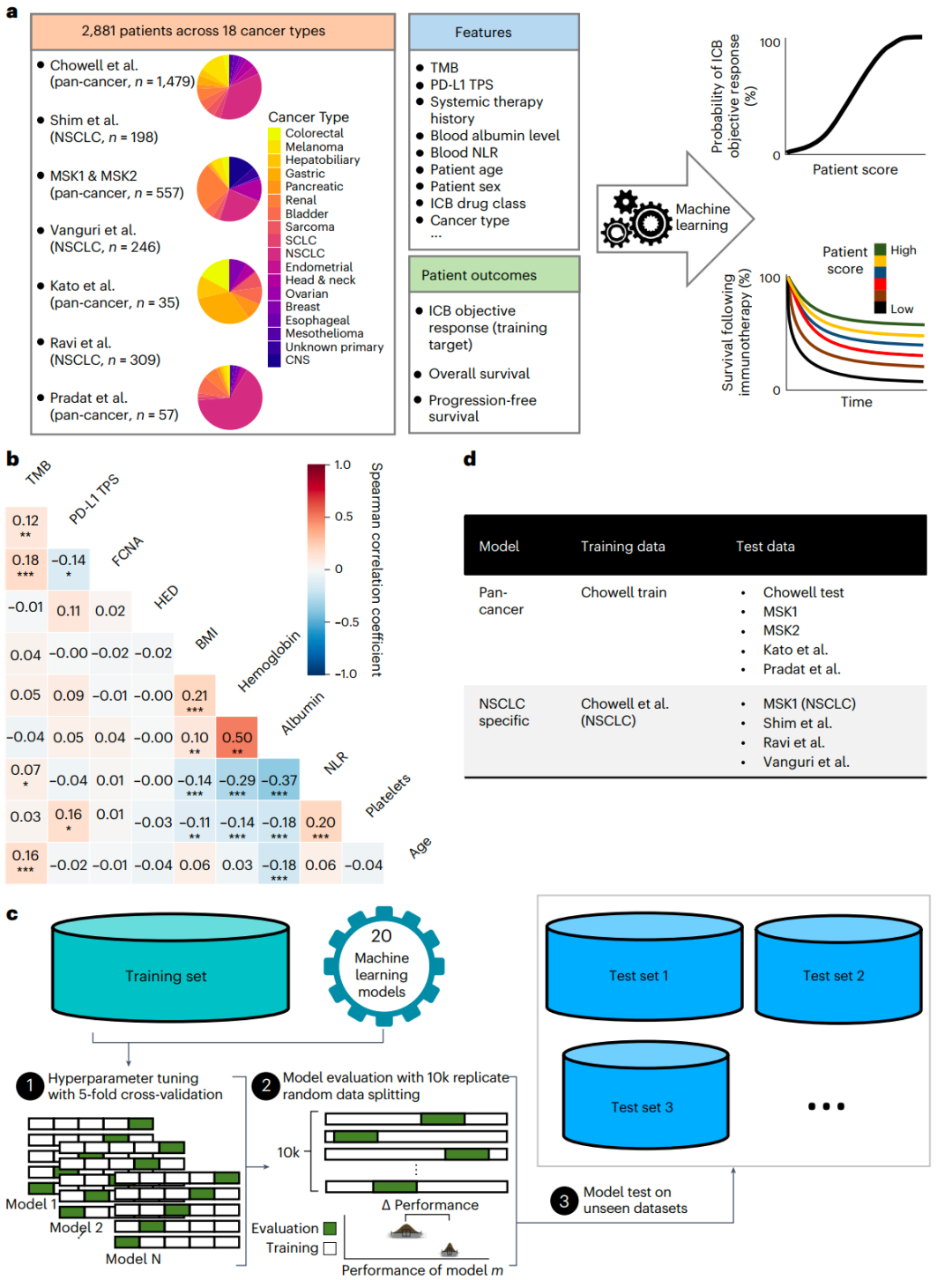
图1. 研究概略图
01 免疫治疗反应的泛癌症预测模型
研究团队首先开发了一个泛癌逻辑回归模型,使用八个主要特征来预测参与者对ICB治疗的客观反应,并进行五折交叉验证以确定最佳超参数。结果显示,性别和ICB药物类别信息对预测影响较小,在去除这两个特征后,发现最佳模型是六特征逻辑LASSO回归模型(LLR6),该模型包括TMB、全身治疗史、血液白蛋白、血液NLR、年龄和癌症类型等特征,可捕获预测不同类型癌症参与者ICB反应的最重要信息。
与其他模型(如RF16等)的比较分析显示,LLR6具有诸多优势:优越的性能和较低的过拟合倾向、仅使用少数临床可测量的特征、高透明度和可解释性、模型训练时间短等。研究团队将使用LLR6计算的输出称为基于逻辑回归的免疫治疗反应评分(LORIS)。
接下来,研究团队将LLR6应用于五个独立数据集中以评估其通用性。在所有数据集中,LLR6的表现始终优于RF6和TMB生物标志物,即使是训练数据中未见的癌症类型;LLR6预测ICB治疗应答者的LORIS评分也显著高于无应答者。LLR6的AUC分别高于RF6和TMB生物标志物;在大多数数据集上,LLR6也显示出优越的AUPRC。
研究团队进一步研究了LORIS评分能否预测免疫治疗后患者的生存结果。泛癌Kaplan–Meier分析显示,与高评分患者相比,低LORIS评分(<0.5)患者的生存显著较差。特别地,LORIS识别了相当一部分可从免疫治疗中获益的低TMB参与者,其获益程度与高TMB 参与者相似。
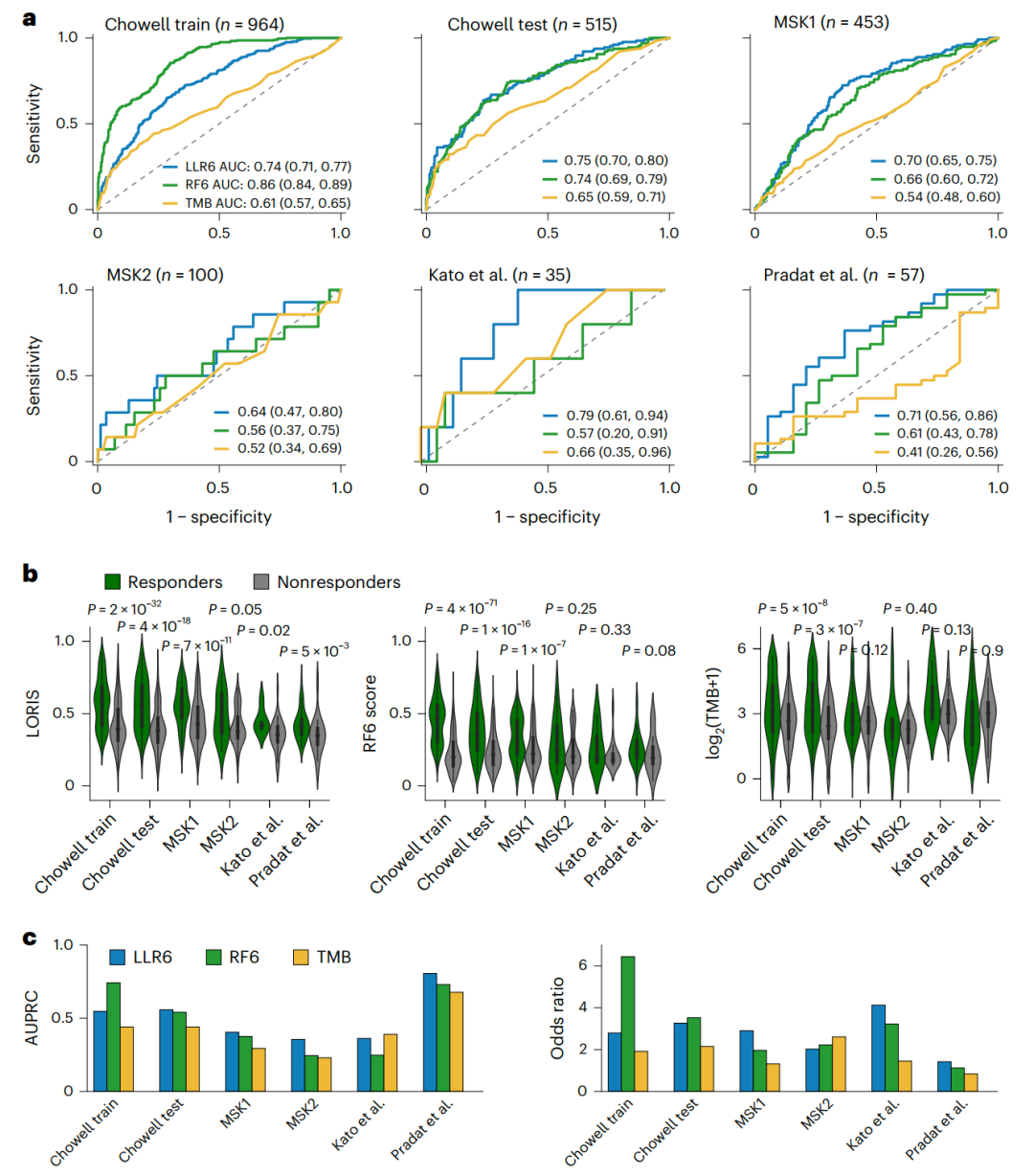
图2. LLR模型可预测对泛癌免疫治疗的客观反应
02 LORIS的疗效预测的价值较强
由于生物标志物可能具有预后价值、预测价值或两者兼而有之,研究团队探索了LORIS在未接受ICB治疗患者预后中的预测能力,计算了非ICB治疗队列中患者的LORIS评分。结果显示,虽然LORIS在非ICB治疗情况下对患者生存具有中等预后价值,但其AUC显著低于ICB治疗组。此外,在未接受ICB治疗的参与者中,较高的LORIS评分与生存率改善之间的相关性缺乏明显的单调趋势。
在单一癌症类型中,LORIS的风险评估能力也下降,并且在非ICB队列中区分短期和/或长期患者生存的统计能力较差。上述结果表明,LORIS既具有预后价值也具有ICB治疗预测价值,但其预测价值似乎比其作为癌症患者一般预后标志物的价值强得多。
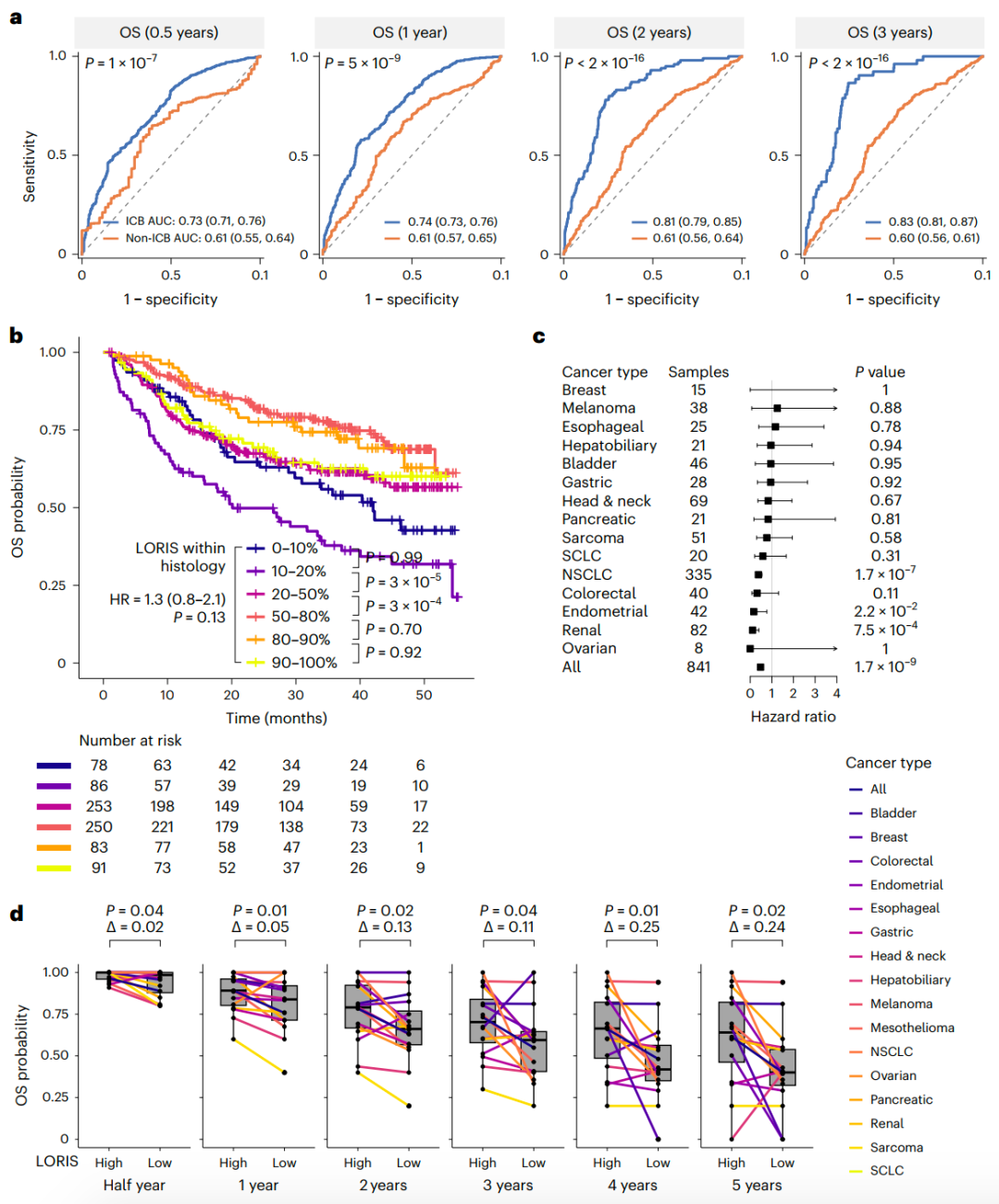
图3. LORIS表现出更强的预测能力
03 LORIS增强肺癌免疫治疗反应的预测
上述结果展示了研究团队开发的泛癌模型在预测ICB反应方面的卓越能力,为探究该方法能否扩展以开发癌症类型特异性模型,研究团队测试了使用逻辑LASSO回归(LLR)为数据集中样本量最大的癌症类型——非小细胞肺癌(NSCLC)创建特定模型的潜力。
研究团队使用与泛癌症研究类似的方案构建、训练和评估了NSCLC特异性模型,使用PD-L1 TPS取代了泛癌LLR6模型中的“癌症类型”特征,共评估了324名NSCLC参与者。与其他模型相比,NSCLC特定的LLR6模型在2,000次五折交叉验证中表现最佳。在五个外部数据集中,NSCLC特异性LLR6性能始终优于TMB和PD-L1 TPS生物标志物,其AUC更高。此外,NSCLC特异性模型预测高、低LORIS参与者之间ICB反应的比值远高于TMB和PD-L1 TPS。在所有数据集中,应答者的LORIS均显著高于无应答者。
研究团队进一步将NSCLC特定的LLR6模型应用于其他癌症(包括胃癌、食道癌和间皮瘤),发现即使在这些不同癌症类型中,该模型仍表现出优于TMB或PD-L1 TPS的预测能力。
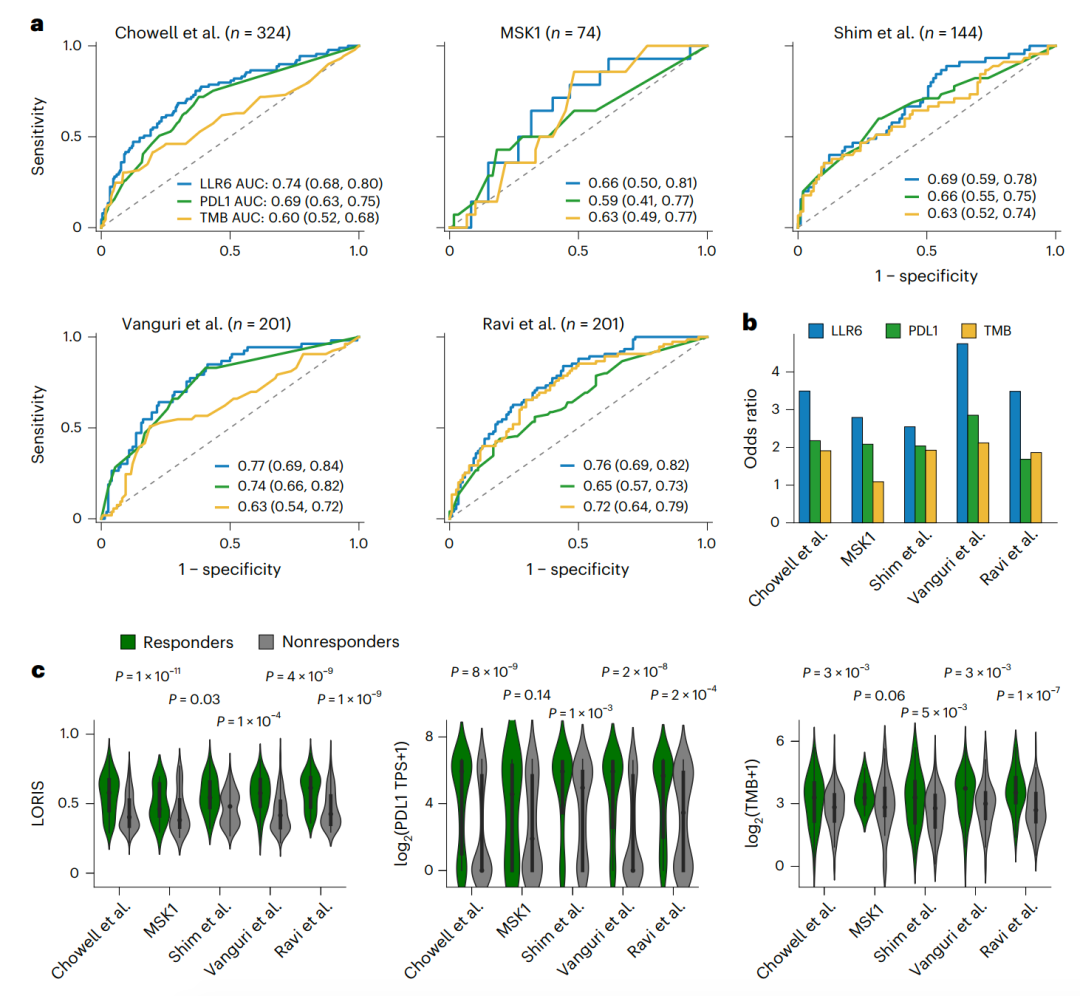
图4. LORIS对NSCLC的稳健预测
结 语
综上所述,研究团队通过分析大型接受免疫治疗的癌症患者数据,包括临床、病理和基因组数据以及ICB应答信息,确定了关键的预测因素,并开发了一种基于逻辑回归的机器学习系统(LORIS)来预测患者在ICB治疗后的客观反应和生存。LORIS整合了一些易于测量的患者特征,可产生单调评分,是预测ICB治疗中患者临床结果的有力工具,有助于促进临床决策和患者分层。
目前,LORIS公开在https://loris.ccr.cancer.gov上,可供癌症免疫治疗研究人员、临床医生和患者使用。
论文原文:
Chang, TG., Cao, Y., Sfreddo, H.J. et al. LORIS robustly predicts patient outcomes with immune checkpoint blockade therapy using common clinical, pathologic and genomic features. Nat Cancer (2024). https://doi.org/10.1038/s43018-024-00772-7
https://www.nature.com/articles/s43018-024-00772-7


