AJHG:龙尔平/Jiyeon Choi团队利用高通量功能组学技术解析肺癌多基因易感机制
时间:2024-07-01 18:00:59 热度:37.1℃ 作者:网络
人类的基因组被视作是一本书写生命的“天书”:凭借A、T、C、G四种碱基,排列组合出超过60亿种可能性,蕴含着人类演化与生老病死的奥秘。自人类基因组计划起,科学家们前赴后继地开启了对人类基因组的探索,其中最核心的使命之一,是理解个体罹患疾病风险的差异,即回答:为什么有的人容易得病,而有的人不容易?
研究发现,大多数人类常见病是由多个基因和环境因素共同参与的复杂性疾病。全基因组关联分析 (Genome-wide association study, GWAS) 是目前研究复杂性疾病的主流策略,其主要原理是通过对比大量患者与健康人群基因组,来确定与疾病易感性存在显著统计学关联的大致基因组区域--基因座。自GWAS研究开展18年来,已发现了近20万个基因座与疾病的遗传易感性显著相关。然而,由于连锁不平衡的存在,基因座内通常有成百上千个可能致病的变异位点,这是传统的单位点分子功能实验无法承受的量级。如何高通量测定变异位点的功能性,有效筛选致病的功能位点,是解析GWAS基因座需要攻克的关键难题。
近日,中国医学科学院基础医学研究所龙尔平与美国国立卫生研究院Jiyeon Choi合作,在The American Journal of Human Genetics上发表了题为“High-throughput characterization of functional variants highlights heterogeneity and polygenicity underlying lung cancer susceptibility”的研究论文,建立大规模平行报告分析体系(Massively parallel reporter assay, MPRA),运用高通量测序和条形码技术模拟位点的单碱基突破,打破了连锁不平衡的限制,表征了42个基因座2245个变异位点的等位基因转录活性,联合功能多组学、转录因子分析、CRISPRi等技术,为解析肺癌的遗传易感机制提供了全面的分子基础和功能注释。

研究团队首先建立MPRA体系,同时考虑了两种肺癌亚型的细胞微环境和烟草暴露,高通量测定了东亚和欧洲人群肺癌GWAS的42个基因座2245个候选变异的等位基因转录活性。结果显示,有37个基因座的844个候选位点有显著的等位基因转录活性,表明大部分基因座(88.1%)可能通过转录调控发挥功能。进一步结合基因组表观遗传特征构建位点评分系统,在效应显著的功能位点中优选出高置信度位点:发现15q21.3等部分基因座只有一个高可信位点,但大多数基因座(63%)包含高度连锁的多个功能位点。同时,20%的功能位点的效应存在显著的细胞类型相互作用。由于位点功能由转录因子潜在介导,团队通过预测TF-motif结合优选了潜在的功能调控因子,如A549细胞系中特异性表达并结合功能位点的ELF3,能够和多个功能位点结合的IRF蛋白、STAT蛋白等。最终,团队整合功能多组学方法(QTLs、增强子、近端调控元件)鉴定功能位点的靶基因,并通过CRISPRi实验验证了RTEL1,SOX18,ARFRP1等多个靶基因。
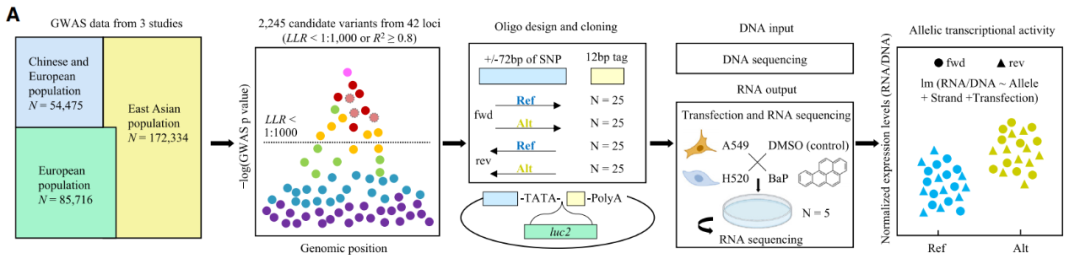
图1. MPRA设计、实验及分析的总流程
综上,该工作建立了“高通量+多组学”的Post-GWAS研究体系,从多个层面(基因、转录、修饰等)和场景(细胞、微环境)测绘“从基因到表型”的发生过程,为突破GWAS的转化瓶颈,推动疾病的遗传易感性研究带来了新的机遇。
龙尔平研究员(中国医学科学院)和Jiyeon Choi研究员(美国国立卫生研究院)为本文通讯作者。
原文链接:
https://doi.org/10.1016/j.ajhg.2024.05.021


